Реакция липолиза: — липолиз — Биохимия
— липолиз — Биохимия
Мобилизация жира
В настоящее время, после открытия в 2004 году адипоцитарной триглицеридлипазы (ATGL, adipose triglyceride lipase, деснутрин), прежняя концепция липолиза получила новое прочтение. ATGL несет ответственность за большую часть липолитической активности как в базальных, так и в стимулированных условиях.
В обычных условиях на поверхности липидной капли находятся белок перилипин, ATGL и ее коактиватор под названием CGI-58 (comparative gene identification-58, или также Abhd5, abhydrolase domain-containing 5).
Гормон-чувствительная липаза (HSL, hormone sensitive lipase) и белок, переносящий жирные кислоты (БПЖК, FABP, fatty acid binding protein) в это время преимущественно находятся в цитоплазме.
В спокойном адипоците
- ATGL отщепляет жирные кислоты (С16-С18) во 2-м положении триацилглицерола с образованием свободной жирной кислоты и 1,3-ДАГ.
 Происходит базальный липолиз.
Происходит базальный липолиз.
В стимулированном адипоците
- перилипин, фосфорилируемый протеинкиназой А, изменяет свою конформацию и уходит от поверхности липидной капли в цитозоль.
- белок CGI-58 отделяется от перилипина и присоединяется к ATGL, формируя с ней активный комплекс и меняя ее специфичность.
- триглицеридлипаза (ATGL), после связывания с CGI-58, начинает отщеплять жирные кислоты от 1-го положения триацилглицеролов, продуцируя 2,3-ДАГ. Именно 2,3-ДАГ является субстратом гормон-чувствительной липазы (HSL).
- гормон-чувствительная липаза (HSL) фосфорилируется протеинкиназой А и/или протеинкиназой G и в такой активной форме мигрирует к липидной капле. Отсутствие перилипина позволяет этой липазе подобраться к ядру липидной капли, где она гидролизует 2,3-диацилглицеролы до 2-моноацилглицеролов и свободной жирной кислоты.

- МАГ-липаза находится как в цитозоле, так и на поверхности липидной капли и гидролизует моноацилглицеролы.
Хотя главным субстратом HSL являются диацилглицеролы, также она может гидролизовать ТАГ и МАГ, в соотношении скоростей гидролиза 20 : 2 : 1 для ДАГ:ТАГ:МАГ соответственно.
Жирные кислоты покидают жировую клетку и, связываясь с сывороточным альбумином, переносятся кровотоком. Затем они освобождаются от альбумина и с помощью тканевых белков, переносящих жирные кислоты, проникают в мишеневые клетки.
Регуляция липолиза в адипоците
Основную роль в липолизе играет изменение состояния перилипина под воздействием протеинкиназы А. Фосфорилирование гормон-чувствительной липазы, хотя и повышает ее активность в 2-3 раза, тем не менее, не способно обеспечить возрастание общей мощности процесса до 50 раз, которое наблюдается при гормональной стимуляции.
Субстратный цикл
Базальный распад и синтез триацилглицеролов в жировой ткани объединены в субстратный цикл, который заключается в том, что 1,3-ДАГ, продукт малоактивной ATGL, является предпочтительным субстратом одного из ферментов синтеза триацилглицеролов – ДАГ-ацил-трансферазы.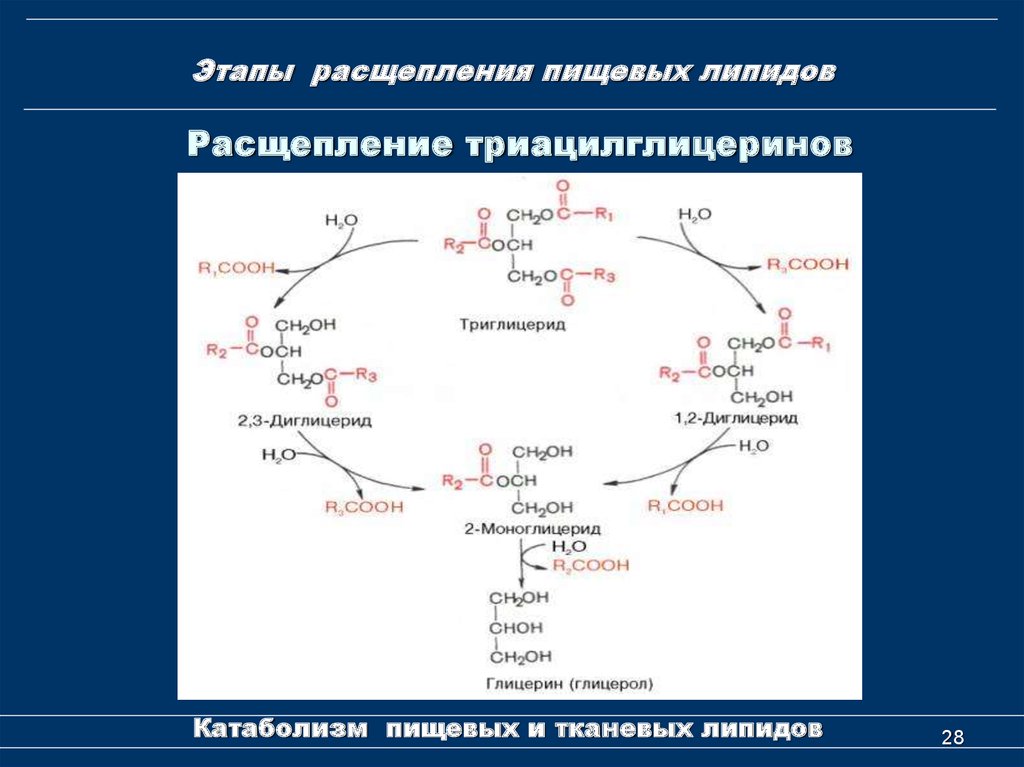 В результате ATGL и ДАГ-ацил-ТФ действуют скоординированно и поддерживают непрерывный цикл гидролиза-реэтерификации ТАГ.
В результате ATGL и ДАГ-ацил-ТФ действуют скоординированно и поддерживают непрерывный цикл гидролиза-реэтерификации ТАГ.
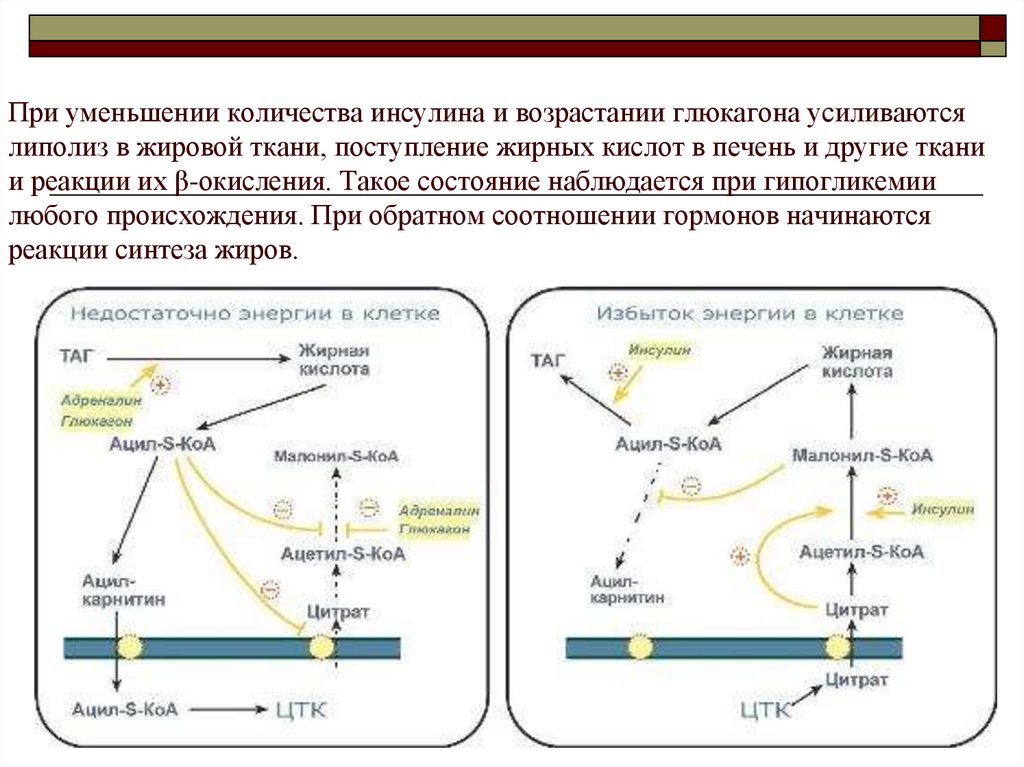
В состоянии покоя около 70% жирных кислот, высвобожденных при участии малоактивной ATGL, не покидают клетку и включаются обратно в состав ТАГ. Остальные 30% жирных кислот выходят в кровь. Вышедшие в кровь жирные кислоты используются в тканях, и их часть неминуемо попадает в печень, где они реэтерифицируются в ТАГ, далее формируется их транспортная форма ЛПОНП. При метаболизме последних в плазме крови образуются остаточные ЛПОНП, некоторая часть которых превращается в синусоидах печени в атерогенные ЛПНП. Нетрудно представить, что количество образуемых ЛПОНП и ЛПНП напрямую зависит от жировой массы, что связывает ожирение и развитие атеросклероза.
Активации субстратного цикла жирных кислот также способствует часто наблюдающийся дисбаланс между потреблением насыщенных и полиненасыщенных жирных кислот, так как липидная капля в адипоците окружена монослоем фосфолипидов, которые должны содержать ПНЖК.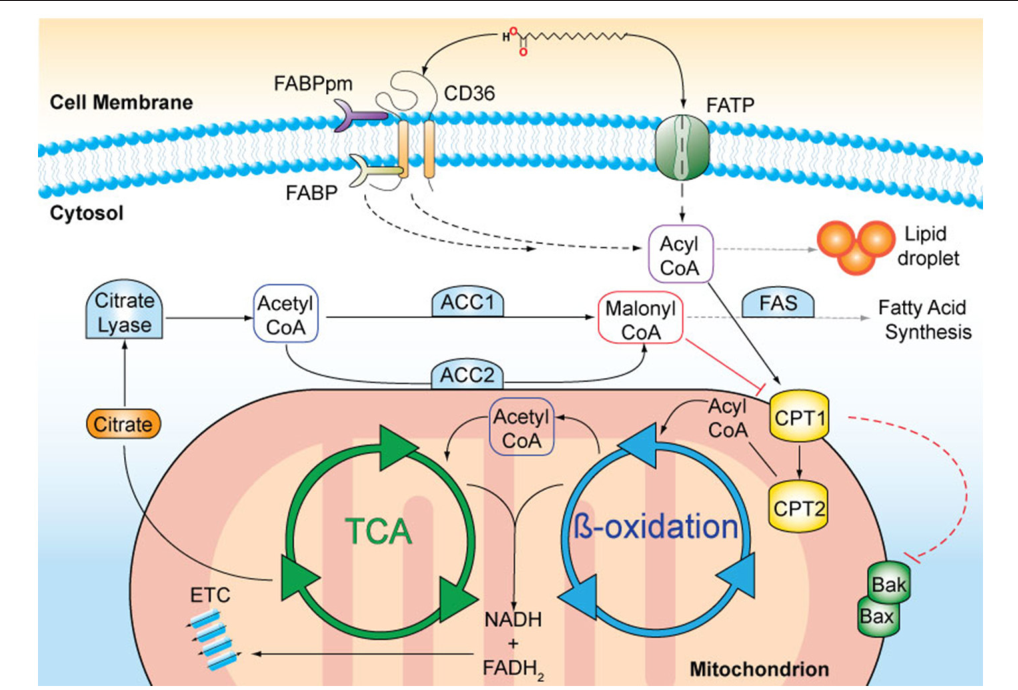 При нарушении синтеза фосфолипидов доступ ATGL-липазы к триацилглицеролам облегчается и их гидролиз ускоряется, возрастает доля насыщенных ЖК, выходящих в кровь.
При нарушении синтеза фосфолипидов доступ ATGL-липазы к триацилглицеролам облегчается и их гидролиз ускоряется, возрастает доля насыщенных ЖК, выходящих в кровь.
Избыток насыщенных ЖК крови легко переходит в мембраны клеток эндотелия сосудов и гладких миоцитов и задерживается здесь, образуя кластеры. Это меняет свойства мембраны, нарушает ионные потоки, что повышает тонус гладких мышц, ухудшает взаимодействие рецепторов с их лигандами.
Липолиз, окисление жирных кислот. Метаболизм кетоновых тел
Под
катаболизмом липидов мы должны
подразумевать всю совокупность химических
реакций распада липидов и образования
из них более простых молекул вплоть до
углекислого газа и воды, а также
энергии, аккумулированной в молекулах
АТФ. Это основной путь катаболизма
липидов. Липолиз— мобилизация
липидов из жировой ткани, стимулируется
адреналином (при стрессе и физической
нагрузке) и глюкагоном (при голодании),
когда необходима организму энергия.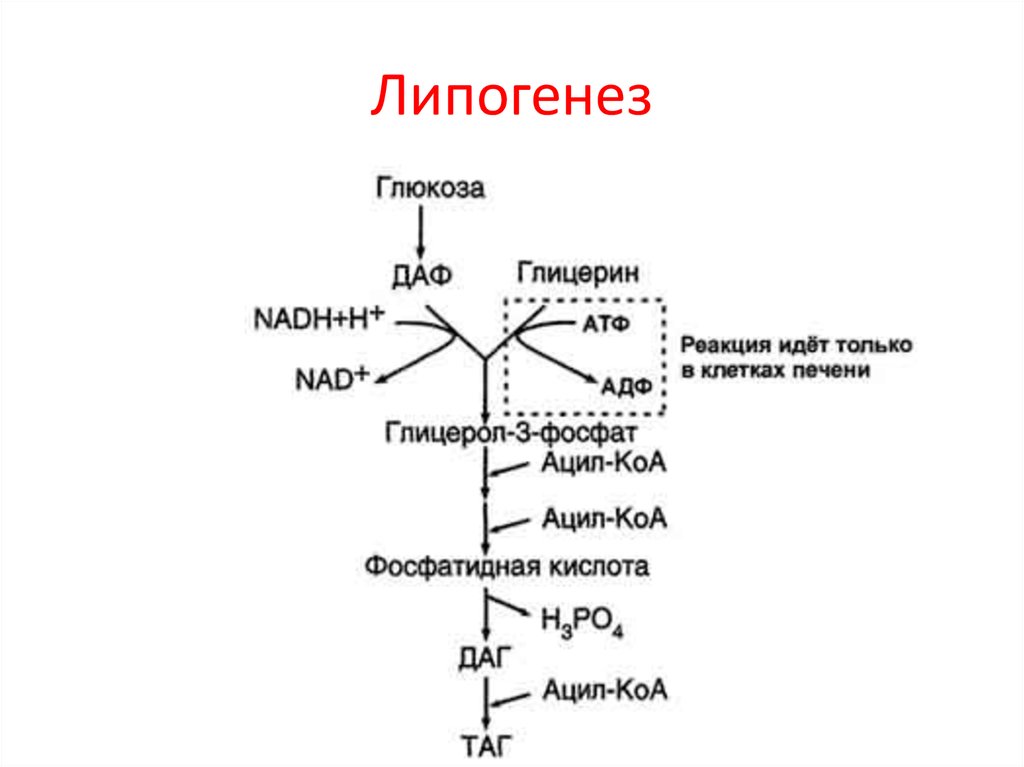
Эти гормоны активируют по каскадному
механизму (гормоны – рецептор –
аденилатциклаза – цАМФ – протеинкиназа
– триацилглицерол-липаза) регуляторный
фермент триацилглицерол-липазу. Продукты
липолиза триацилглицеролов в жировой
ткани (глицерин и ВЖК) далее подвергаются
окислению. В цитоплазме клеток глицерин
в анаэробных условиях распадается
до лактата, а в аэробных — до ацетил-КоА
и далее окисляются в ЦТК.
Высшие
жирные кислоты окисляются в митохондриях.
Однако мембрана этих субклеточных
образований непроницаема
для них. Переносятся они в митохондрии
с помощью специального энзима-переносчика
при участии карнитина. Там ВЖК распадаются
до ацетил-КоА в ходе-окисления,
который затем окисляется в цикле
трикарбоновых кислот до углекислого
газа и воды. Процесс окисления одной
молекулы ацетил-КоА в ЦТКсопряжен
с переносом протонов и электронов по
цепи биологического окисления и
фосфорилированием 12 молекул АДФ. В
целом, при полном окислении,например,толькоодной
молекулы пальмитиновой кислоты в клетке
образуется 129 (131-2) молекул АТФ. При
При
окислении ненасыщенных жирных кислот
происходит: изменение их цис-конформации
в транс-форму, перенос двойной связи,
а далее присоединение воды по месту
разрыва двойной связи и-оксиление.
Количество образуемых АТФ при этом
уменьшается.. При окислении жирных
кислот с нечетным числом атомов углерода
в последнем цикле образуются молекулы
ацетил КоА и пропионил КоА, который
имеет 3 углеродных атома. Пропионил –КоА
превращается в сукцинил-КоА и далее
окисляется в ЦТК.
При недостатке
энергии в клетках происходит образование
кетоновых тел(ацетоацетат,-гидроксибутират,
ацетон) . Они синтезируются только в
митохондриях печени, используются
тканями мозга, скелетных мышц, сердца
и почек, но печенью как источник энергии
не используются. Биосинтез кетоновых
тел происходит из ацетил-КоА. Ацетон
образуется при высоких концентрациях
кетоновых тел и удаляется из организма
с мочой и выдыхаемым воздухом, как
источник энергии он не используется.
При окислении ацетоацетата и-гидроксибутирата
в тканях мозга, сердца и скелетных мышц
и почек образуется 23 и 26 АТФ соответственно.
Содержание кетоновых тел в плазме
составляет 0,2-0,6мМ/л — в норме, и повышается
до 20 мМ/л — при патологиях (сахарном
диабете, голодании, когда усиливается
β-окисление ВЖК и снижается скорость
окисления ацетил-КоА в ЦТК) в результате
чего формируются кетонемия, кетонурия,
кетоз.
Катаболизм
фосфолипидов в тканях происходит при
участии тканевых фосфолипаз
(А1,
А2, С, D). Конечными продуктами
распада фосфолипидов являются глицерин,
ВЖК, фосфорная кислота, азотсодержащие
молекулы, инозитол. Действие фосфолипазы
А2приводит к образованию
лизофосфолипидов.
Липолиз – определение, механизм и процесс
Липолиз Определение
Липолиз – это процесс расщепления жиров в нашем организме с помощью ферментов и воды, или гидролиз. Липолиз происходит в наших запасах жировой ткани, которые представляют собой жировые ткани, которые смягчают и выстилают наши тела и органы. На самом деле, жиры можно рассматривать просто как запасенную энергию.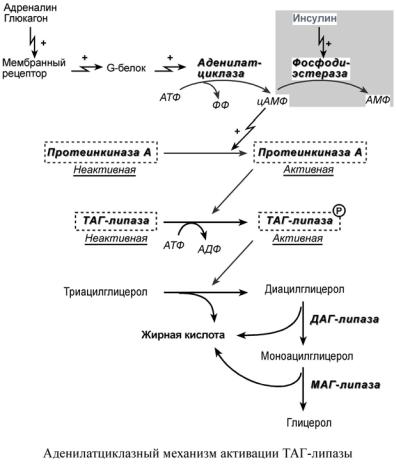 Жиры готовы и доступны, когда наши запасы глюкозы между приемами пищи истощаются, и имеет смысл липолиз, поскольку он облегчит движение этих накопленных жиров через наш кровоток. Расщепление этой «потенциальной энергии» на свободно движущиеся жирные кислоты может затем позволить их перепрофилировать или израсходовать в качестве топлива!
Жиры готовы и доступны, когда наши запасы глюкозы между приемами пищи истощаются, и имеет смысл липолиз, поскольку он облегчит движение этих накопленных жиров через наш кровоток. Расщепление этой «потенциальной энергии» на свободно движущиеся жирные кислоты может затем позволить их перепрофилировать или израсходовать в качестве топлива!
На самом деле липолиз связан с различными процессами в нашем организме. Свободные жирные кислоты являются жизненно важными коммуникаторами между клетками, являются основным ингредиентом глюконеогенеза и клеточного дыхания и могут усиливать транскрипцию белков, таких как разобщающие протонные каналы, которые выстилают нашу митохондриальную мембрану, что будет ингибировать синтез АТФ, не нарушая дыхательную цепь. . Таким образом, липолиз является ключевым биологическим процессом, поддерживающим жизнь; хотя в последнее время в косметических клиниках по всему миру оно приобрело новое значение из-за его обещания избавиться от нежелательного жира! Оба процесса технически «лизируют» или расщепляют жиры, но способы, которыми они этого добиваются, явно различаются — последний использует холодные лазеры или тепло для уменьшения жировых клеток.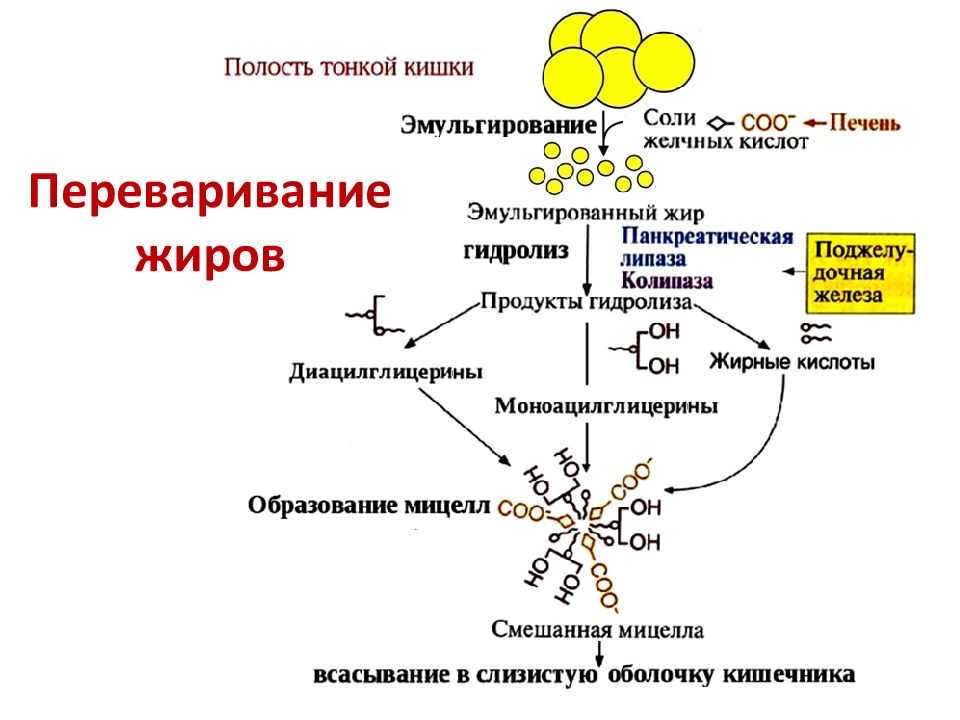
Механизм липолиза
Триглицериды, несомненно, являются основной энергетической молекулой в эукариотических клетках. Триглицерид представляет собой производное глицерина, которое хранится в виде капель липидов в наших жировых тканях, и здесь происходит липолиз. Давайте начнем с описания липолиза в широком масштабе. Эти липидные капли сначала становятся мишенью липолитических ферментов, которые строго регулируются и получают доступ к этим каплям в случае фосфорилирования.
Эти липазы будут последовательно гидролизовать наши триглицериды в их компоненты глицерин и жирные кислоты, пока мы не останемся с единственными глицеринами, и это происходит с тремя ферментативными реакциями. Расщепление жиров называется бета-окисление , или окисление «жирных кислот», потому что триглицериды окисляются до их основных функциональных частей. Таким образом, у нас остаются свободные жирные кислоты и глицерин, которые могут вступать в другие метаболические пути или находить новое назначение.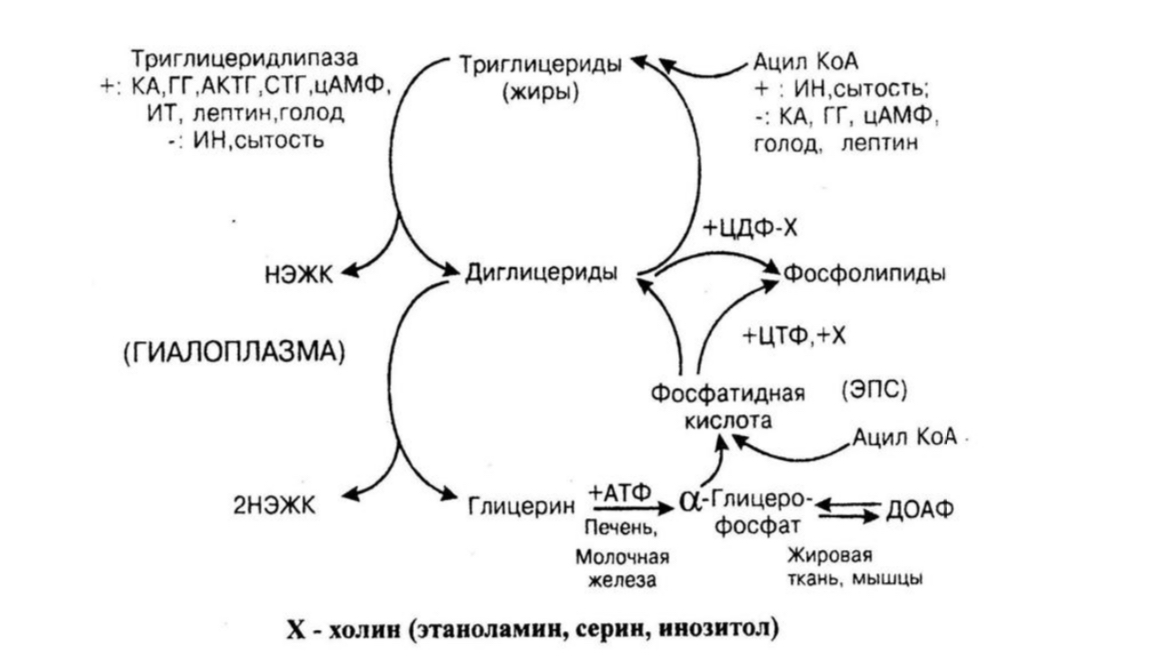 Давайте углубимся в детали.
Давайте углубимся в детали.
Рисунок 1
На изображении показан механизм липолиза, расщепление триглицеридов на жирные кислоты и глицерин.
Первый и ограничивающий скорость этап липолиза включает фермент жировую триглицеридлипазу (или ATGL), который чувствителен к гормонам. ATGL будет гидролизовать наш триацилглицерин в диацилглицерин, теряя свободную жирную кислоту, которая будет свободно мобилизоваться в нашем кровотоке. Затем на полученный диацилглицерин будет воздействовать гормоночувствительная липаза (HSL), которая удалит другую жирную кислоту с образованием молекулы моноацилглицерина. Наконец, моноацилглицеринлипаза (MGL) расщепляет моноацилглицерин до одной молекулы глицерина.
На рисунке ниже показаны основные «судьбы», если хотите, образующихся жирных кислот и глицерина. Жирные кислоты могут подвергаться бета-окислению и перепрофилироваться для создания ацетил-КоА. Конечно, ацетил-КоА больше всего известен как жизненно важная исходная молекула, запускающая цикл Кребса в клеточном дыхании.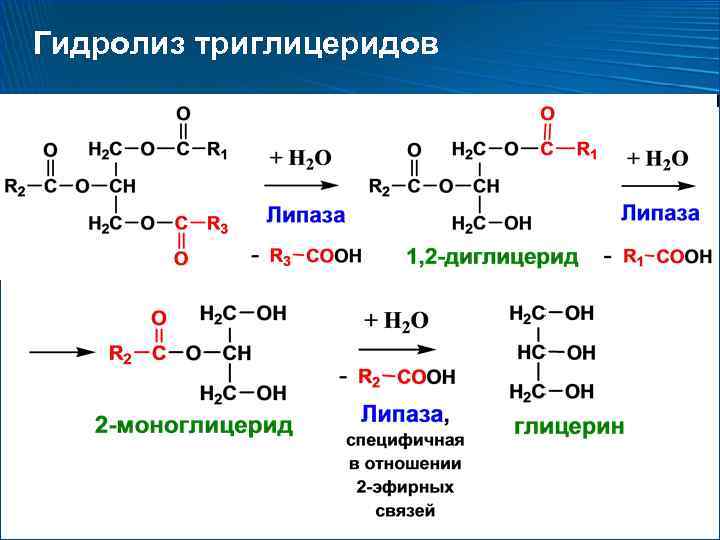 Это перераспределение жизненно важно, когда запасы глюкозы низки во время голодания или даже между приемами пищи, поскольку клеточное дыхание может продолжаться и поддерживать жизнь. Точно так же свободный глицерин может вступать в гликолиз. Обычно глюкоза превращается в G6P на первой стадии гликолиза. В случае, если уровень глюкозы низкий, глицерин будет преобразован в дигидроксиацетонфосфат и войдет в гликолиз во второй контрольной точке, чтобы поддерживать гликолиз. Таким образом, жиры являются лучшим запасом энергии, поскольку они обеспечивают продолжение клеточного дыхания и выработку АТФ.
Это перераспределение жизненно важно, когда запасы глюкозы низки во время голодания или даже между приемами пищи, поскольку клеточное дыхание может продолжаться и поддерживать жизнь. Точно так же свободный глицерин может вступать в гликолиз. Обычно глюкоза превращается в G6P на первой стадии гликолиза. В случае, если уровень глюкозы низкий, глицерин будет преобразован в дигидроксиацетонфосфат и войдет в гликолиз во второй контрольной точке, чтобы поддерживать гликолиз. Таким образом, жиры являются лучшим запасом энергии, поскольку они обеспечивают продолжение клеточного дыхания и выработку АТФ.
Рисунок 2
На рисунке показан липолиз и пути поступления жирных кислот и компонентов глицерина.
Регулирование липолиза
Как и любой жизненно важный биологический процесс, липолиз регулируется в соответствии с нашими потребностями. В любое время было бы чрезвычайно вредно иметь тонны свободных жирных кислот, протекающих через нашу кровь. Любой человек с высоким уровнем холестерина или артериальными бляшками подтвердит это. Таким образом, липолиз и его обратный процесс, липогенез, должны регулироваться и быть очень чувствительными к уровням определенных гормонов и белков. Например, стимулирующие гормоны, такие как адреналин, норадреналин, кортизол, глюкагон и гормон роста вызывают липолиз . Ключевые гормоны глюкагон и адреналин будут использовать одни и те же пути для индукции липолиза с небольшими отличиями.
Таким образом, липолиз и его обратный процесс, липогенез, должны регулироваться и быть очень чувствительными к уровням определенных гормонов и белков. Например, стимулирующие гормоны, такие как адреналин, норадреналин, кортизол, глюкагон и гормон роста вызывают липолиз . Ключевые гормоны глюкагон и адреналин будут использовать одни и те же пути для индукции липолиза с небольшими отличиями.
И глюкагон, и адреналин будут служить лигандами, которые будут связываться с рецепторами, связанными с G-белком, на поверхности жировых клеток. Затем G-белки активируют аденилатциклазу и усиливают превращение АТФ в цАМФ. Мы могли бы признать цАМФ знаменитым вездесущим вторичным мессенджером многих других биологических путей. Точно так же здесь цАМФ будет активировать протеинкиназу А (ПКА), которая будет расходовать молекулу АТФ на фосфорилирование и активацию гидролизной активности нашего фермента HSL, также известного как наш 9.0013 второй фермент в пути липолиза. В результате у нас остаются свободные жирные кислоты и глицерин, которые затем могут вступать в метаболические пути, например, для противодействия низкому уровню сахара в нашей крови.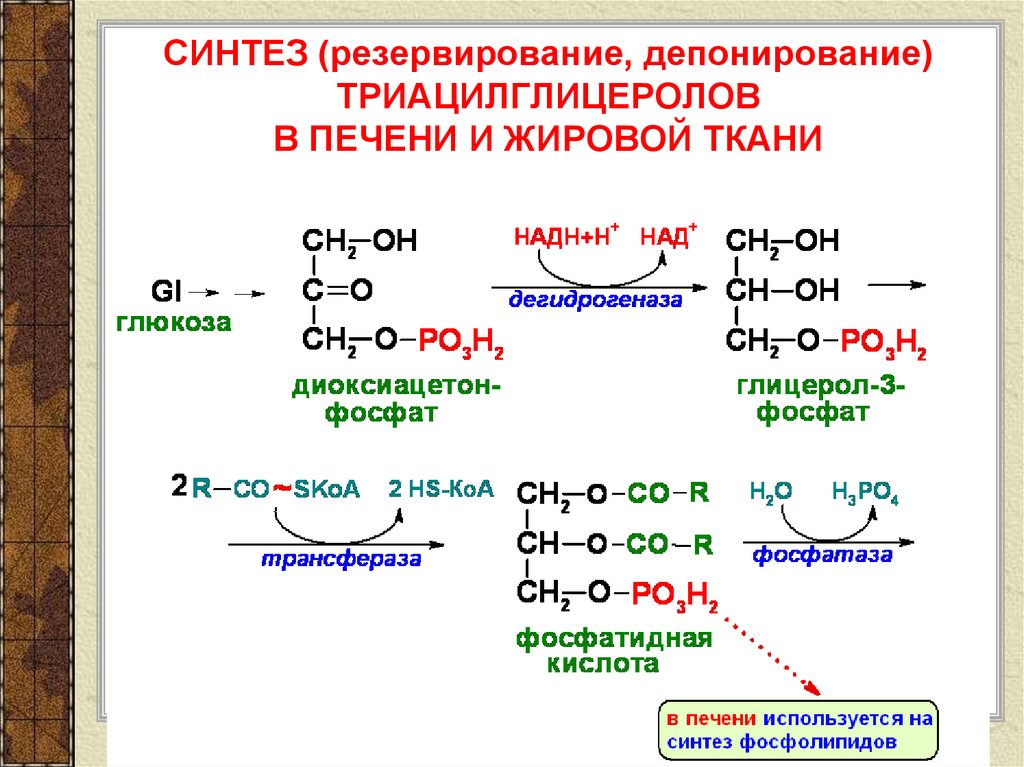 Понятно, что HSL считался определяющим скорость ферментом липолиза в течение некоторого времени до того, как было обнаружено, что TAG-липаза (или ATG, наш первый фермент) является ключевой инициативной стадией липолиза. Давайте быстро рассмотрим, почему глюкагон и адреналин имеют смысл запускать липолиз.
Понятно, что HSL считался определяющим скорость ферментом липолиза в течение некоторого времени до того, как было обнаружено, что TAG-липаза (или ATG, наш первый фермент) является ключевой инициативной стадией липолиза. Давайте быстро рассмотрим, почему глюкагон и адреналин имеют смысл запускать липолиз.
Глюкагон-индуцированный липолиз
Глюкагон — это пептидный гормон, который синтезируется клетками поджелудочной железы в случае снижения уровня глюкозы и, следовательно, инсулина. Затем глюкагон заставит нашу печень расщепить свои запасы гликогена и высвободить столь необходимую глюкозу в нашу кровь. И наоборот, когда наши уровни глюкозы и инсулина высоки, инсулин у здоровых людей позволяет глюкозе выходить из кровотока и поглощаться инсулинозависимыми тканями. Конечно, у диабетиков ткани больше не будут хорошо реагировать на инсулин, и этот сахар не достигнет тканей, а вместо этого вызовет хаос в кровотоке.
Возвращаясь к липолизу, запасы глюкагона малы и быстро расходуются.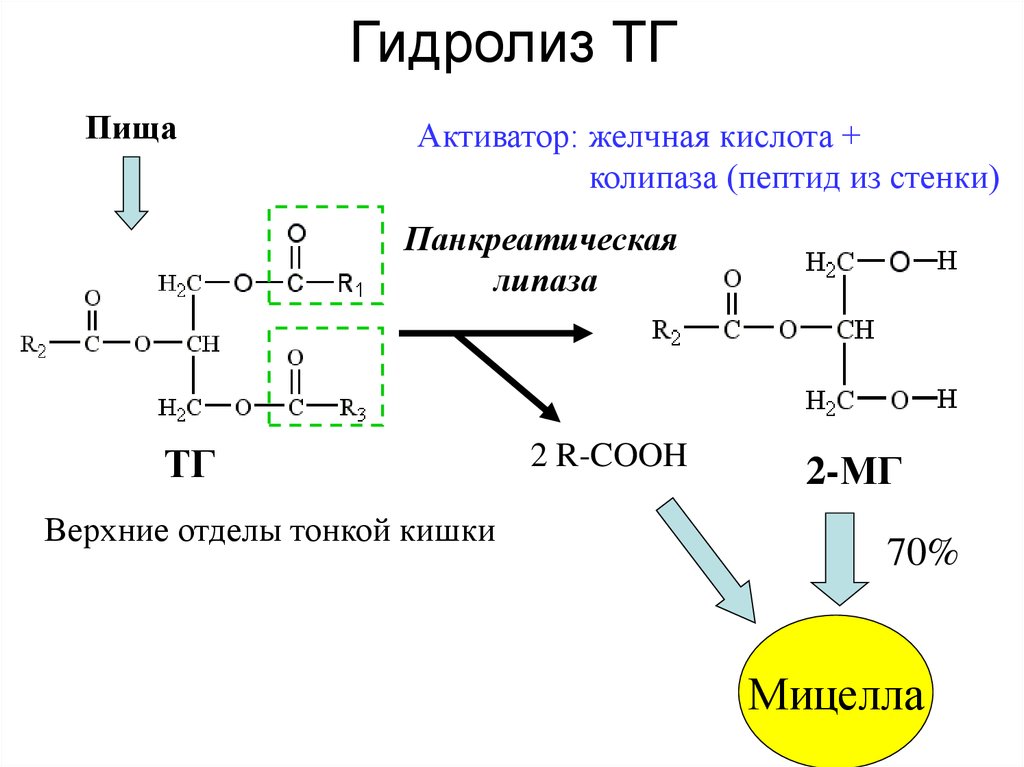 С другой стороны, жировые запасы огромны и готовы к использованию. Здесь глюкагон выполняет свою ключевую роль. Глюкагон будет связываться с рецепторами, связанными с G-белком глюкагона, на мембранах жировых клеток и запускать описанный ранее путь активации HSL. Высвобожденный глицерин может затем попасть в печень или почки, где он в конечном итоге будет преобразован в GA3P и вступит в гликолиз и наш путь глюконеогенеза для синтеза крайне необходимой глюкозы (см. Рисунок 2).
С другой стороны, жировые запасы огромны и готовы к использованию. Здесь глюкагон выполняет свою ключевую роль. Глюкагон будет связываться с рецепторами, связанными с G-белком глюкагона, на мембранах жировых клеток и запускать описанный ранее путь активации HSL. Высвобожденный глицерин может затем попасть в печень или почки, где он в конечном итоге будет преобразован в GA3P и вступит в гликолиз и наш путь глюконеогенеза для синтеза крайне необходимой глюкозы (см. Рисунок 2).
Липолиз, индуцированный адреналином
Рисунок 3
На диаграмме конкретно показан индуцированный адреналином липолиз через путь, опосредованный G-белком.
Эпинефрин также связывает рецепторы G-белка на мембранах жировых клеток, однако они специфически связываются с бета-адренорецепторами. Это связывание также приведет к фосфорилированию чувствительной к гормонам липазы под влиянием цАМФ/ПКА, что в конечном итоге приведет к высвобождению свободных жирных кислот и глицерина. Эпинефрин известен своей связью с нашей инстинктивной реакцией «бей или беги». Это гипервозбуждение возникает, когда мы воспринимаем нападение или угрозу нашему выживанию. Таким образом, логично предположить, что адреналин запускает липолиз и, как следствие, ускорение метаболических процессов. Если мы когда-нибудь будем голодать, наше тело обязательно отреагирует на эту угрозу и использует запасы жировой энергии, чтобы отреагировать и поддержать жизнь любой ценой.
Это гипервозбуждение возникает, когда мы воспринимаем нападение или угрозу нашему выживанию. Таким образом, логично предположить, что адреналин запускает липолиз и, как следствие, ускорение метаболических процессов. Если мы когда-нибудь будем голодать, наше тело обязательно отреагирует на эту угрозу и использует запасы жировой энергии, чтобы отреагировать и поддержать жизнь любой ценой.
Липолиз в популярной культуре
Как кратко упоминалось выше, забавным фактом является то, что липолиз стал популярным термином в косметическом мире. Не путать с путями жирового липолиза, подробно описанными в этой статье, лазерный липолиз и даже инъекционный липолиз являются клинически проверенными методами уменьшения количества жировых клеток без хирургической липосакции. Неинвазивное уменьшение жира стало новым основным косметическим средством и обещает воздействовать на жировые клетки за счет использования тепла, охлаждения (с помощью лазеров или радиочастот) или, реже, инъекций дезоксихолевой кислоты без нарушения окружающих тканей.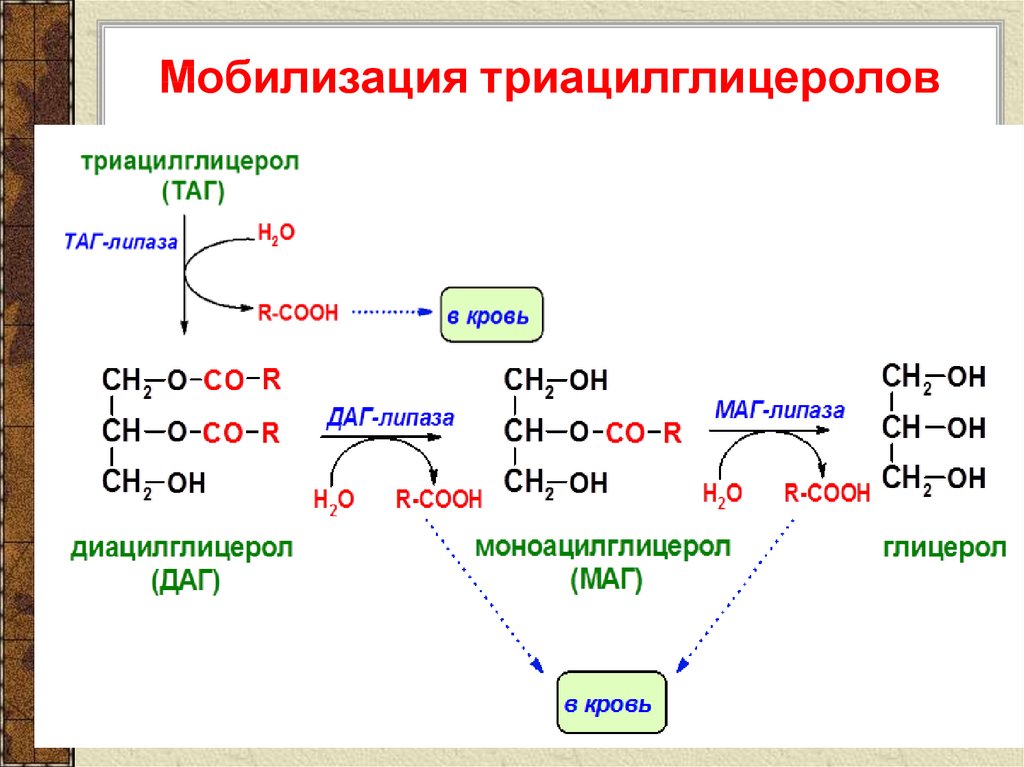
Тест
1. Какой из следующих ферментов является ферментом, определяющим скорость липолиза?
A. HSL
B. ATGL
C. MGL
D. Ничего из вышеперечисленного
Ответ на вопрос №1 9.005 B 9.005 верен Как упоминалось выше, исследователи обнаружили, что первый этап липолиза, опосредованный ATGL, по совпадению является этапом, определяющим скорость липолиза. Ранее считалось, что это HSL, поскольку он подвергается фосфорилированию.
2. Что из следующего будет индуцировать липолиз?
A. Высокий уровень инсулина/низкий уровень адреналина
B. Высокий уровень инсулина/высокий уровень адреналина
C. Низкий уровень инсулина/высокий уровень адреналина
D. Низкий уровень инсулина/низкий уровень адреналина
90 Ответ на вопрос
7 90
C правильно. Низкий уровень инсулина и высокий уровень адреналина вызывают липолиз. Это имеет смысл, если наше тело постоянно реагирует на обратную связь. Когда уровни глюкозы и инсулина низкие, нам потребуются жиры для поддержания глюконеогенеза и клеточного дыхания. Высокий уровень адреналина будет возникать перед лицом угрозы жизни, которая потребует управления расходом энергии жира.
Низкий уровень инсулина и высокий уровень адреналина вызывают липолиз. Это имеет смысл, если наше тело постоянно реагирует на обратную связь. Когда уровни глюкозы и инсулина низкие, нам потребуются жиры для поддержания глюконеогенеза и клеточного дыхания. Высокий уровень адреналина будет возникать перед лицом угрозы жизни, которая потребует управления расходом энергии жира.
Ссылки
- Binienda, Z et al. «Роль свободных жирных кислот в физиологических условиях и митохондриальной дисфункции». SCIRP: Food and Nutrition Sciences, Vol. 4 No. 9A, 2013. Источник
- Американского общества пластических хирургов (2018). «Нехирургическое уменьшение жира: минимально инвазивные процедуры». Пластическая хирургия.org. По состоянию на 2018 г., 29 мая, с сайта
- Уорд, Колин (2015). «Липолиз и липогенез».
Диапедия: 51040851148 рев. нет. 17. По состоянию на 29 мая 2018 г.:
- Engelking, Larry R. (2014). «Глава 70 – Липолиз». Учебник ветеринарной физиологической химии (3-е издание), страницы 444-449. По состоянию на 30 мая 2018 г. по адресу
- Fruhbeck, G et al. «Регулирование липолиза адипоцитов». Nutr Res Rev. 2014 июнь; 27(1): 63-93. Doi: 10.1017/S095442241400002X
Метаболизм липидов | Анатомия и физиология II
Цели обучения
К концу этого раздела вы сможете:
- Объяснять, как можно получать энергию из жира
- Объясните цель и процесс кетогенеза
- Опишите процесс окисления кетоновых тел
- Объясните цель и процесс липогенеза
Жиры (или триглицериды) в организме поступают в организм с пищей или синтезируются адипоцитами или гепатоцитами из предшественников углеводов.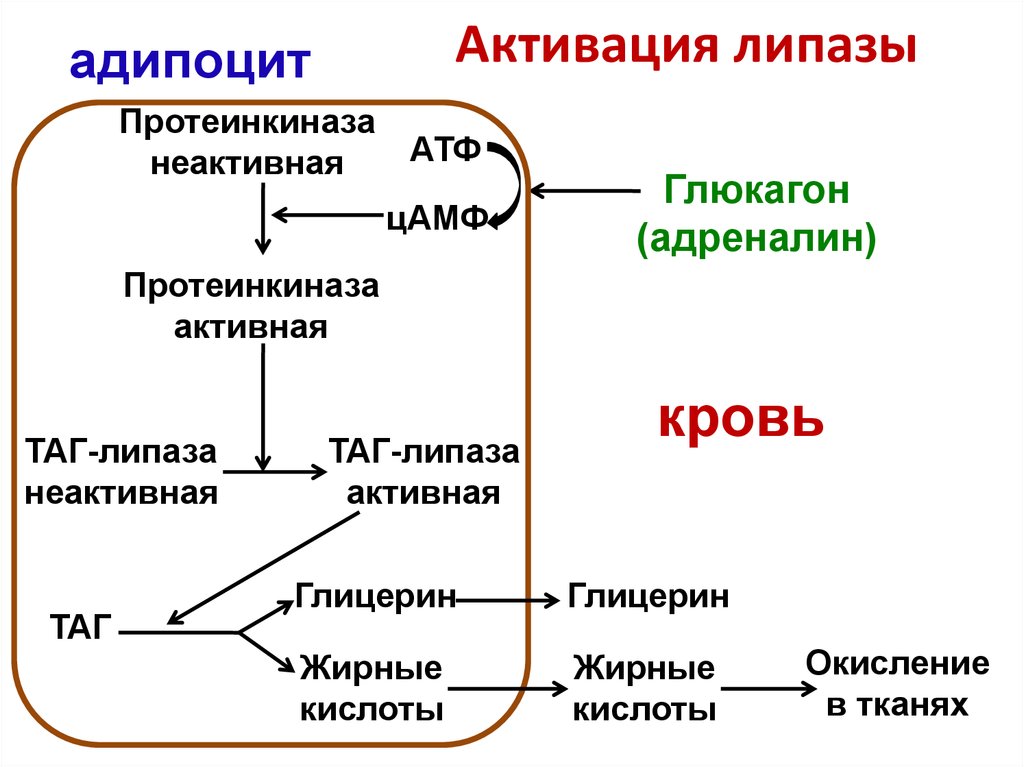 Метаболизм липидов влечет за собой окисление жирных кислот либо для получения энергии, либо для синтеза новых липидов из более мелких составляющих молекул. Липидный обмен связан с углеводным обменом, так как продукты глюкозы (например, ацетил-КоА) могут превращаться в липиды.
Метаболизм липидов влечет за собой окисление жирных кислот либо для получения энергии, либо для синтеза новых липидов из более мелких составляющих молекул. Липидный обмен связан с углеводным обменом, так как продукты глюкозы (например, ацетил-КоА) могут превращаться в липиды.
Рис. 1. Молекула триглицерида (а) распадается на моноглицерид (б).
Метаболизм липидов начинается в кишечнике, где проглоченные триглицеридов расщепляются на жирные кислоты с более мелкой цепью, а затем на молекул моноглицеридов панкреатических липаз , ферментов, расщепляющих жиры после их эмульгирования солями желчных кислот . Когда пища достигает тонкой кишки в виде химуса, пищеварительный гормон под названием холецистокинин (ХЦК) высвобождается кишечными клетками в слизистой оболочке кишечника. CCK стимулирует высвобождение панкреатической липазы из поджелудочной железы и стимулирует сокращение желчного пузыря для высвобождения накопленных желчных солей в кишечник.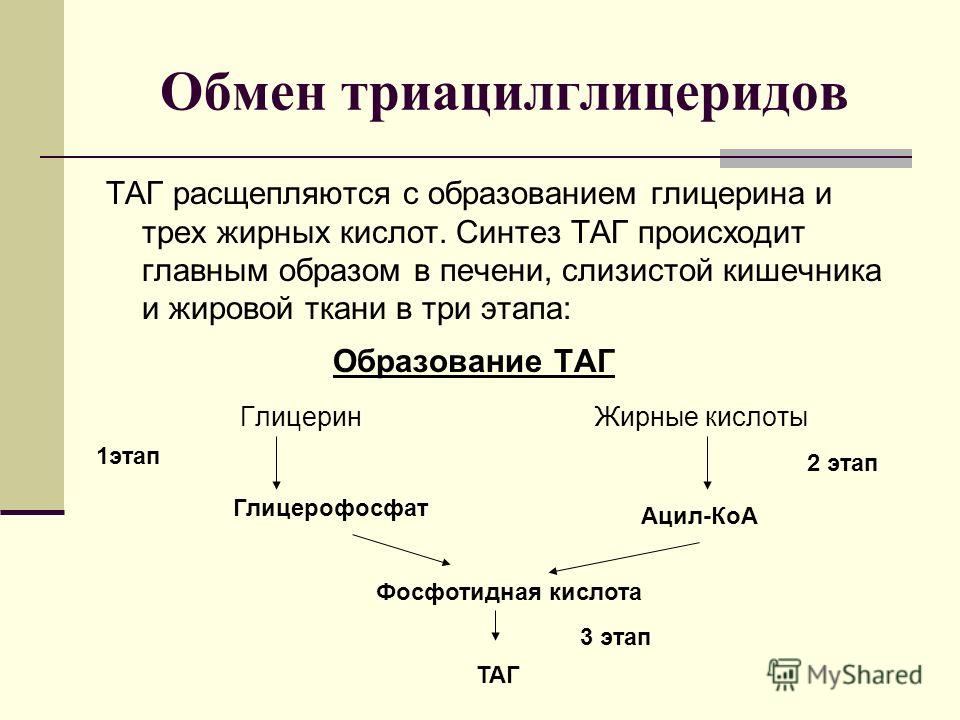 CCK также попадает в мозг, где может действовать как подавитель голода.
CCK также попадает в мозг, где может действовать как подавитель голода.
Рис. 2. Хиломикроны содержат триглицериды, молекулы холестерина и другие аполипопротеины (белковые молекулы). Они переносят эти нерастворимые в воде молекулы из кишечника через лимфатическую систему в кровоток, который переносит липиды в жировую ткань для хранения.
Вместе липазы поджелудочной железы и соли желчных кислот расщепляют триглицериды до свободных жирных кислот. Эти жирные кислоты могут транспортироваться через кишечную мембрану. Однако, как только они пересекают мембрану, они рекомбинируются, снова образуя молекулы триглицеридов. В клетках кишечника эти триглицериды упакованы вместе с молекулами холестерина в фосфолипидные везикулы, называемые хиломикронами . Хиломикроны позволяют жирам и холестерину перемещаться в водной среде вашей лимфатической и кровеносной систем. Хиломикроны покидают энтероциты путем экзоцитоза и попадают в лимфатическую систему через млечные железы в ворсинках кишечника.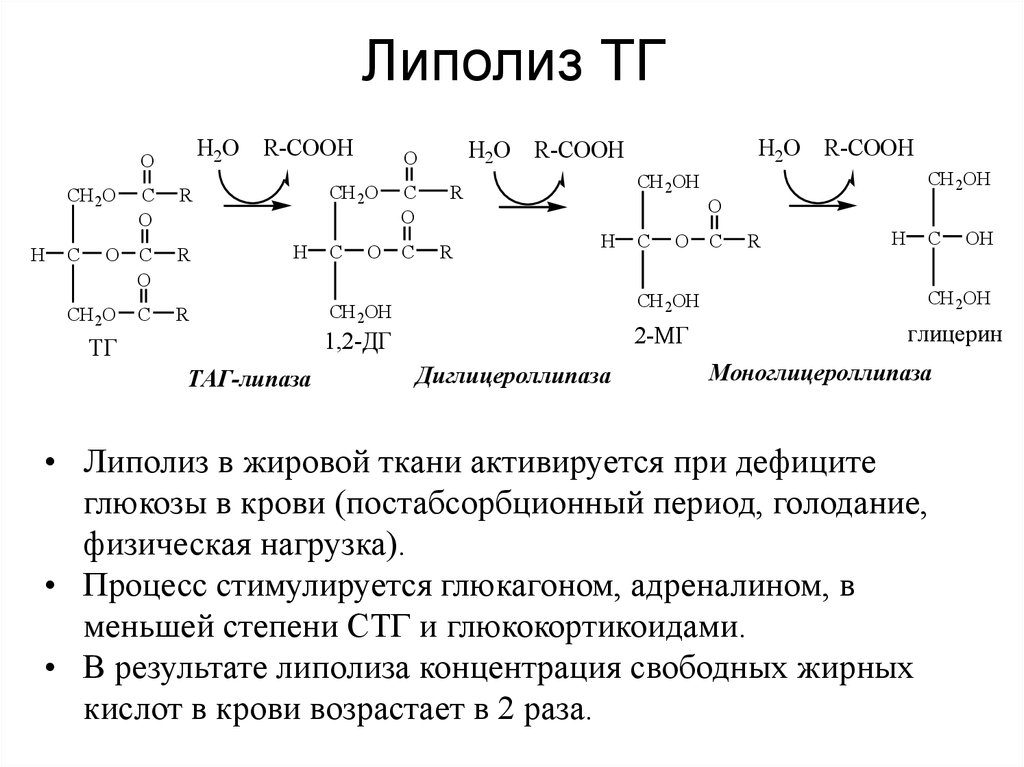 Из лимфатической системы хиломикроны транспортируются в кровеносную систему. Попав в кровоток, они могут либо попасть в печень, либо отложиться в жировых клетках (адипоцитах), которые содержат жировую (жировую) ткань, обнаруженную по всему телу.
Из лимфатической системы хиломикроны транспортируются в кровеносную систему. Попав в кровоток, они могут либо попасть в печень, либо отложиться в жировых клетках (адипоцитах), которые содержат жировую (жировую) ткань, обнаруженную по всему телу.
Липолиз
Чтобы получить энергию из жира, триглицериды должны быть сначала расщеплены путем гидролиза на два их основных компонента: жирные кислоты и глицерин. Этот процесс, называемый липолизом , происходит в цитоплазме. Образующиеся жирные кислоты окисляются путем β-окисления до ацетил-КоА, который используется в цикле Кребса. Глицерин, который высвобождается из триглицеридов после липолиза, непосредственно входит в путь гликолиза в виде ДГАФ. Поскольку одна молекула триглицерида дает три молекулы жирных кислот с 16 или более атомами углерода в каждой, молекулы жира дают больше энергии, чем углеводы, и являются важным источником энергии для человеческого организма. Триглицериды дают более чем в два раза больше энергии на единицу массы по сравнению с углеводами и белками.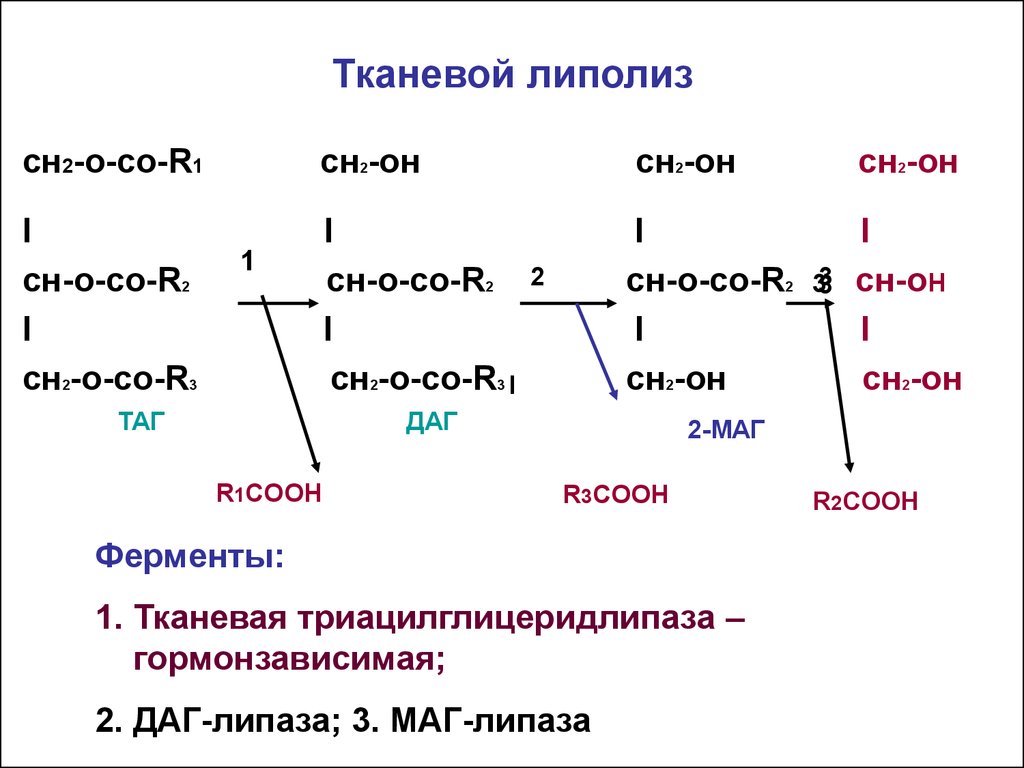 Следовательно, когда уровень глюкозы низкий, триглицериды могут быть преобразованы в молекулы ацетил-КоА и использованы для образования АТФ посредством аэробного дыхания.
Следовательно, когда уровень глюкозы низкий, триглицериды могут быть преобразованы в молекулы ацетил-КоА и использованы для образования АТФ посредством аэробного дыхания.
Расщепление жирных кислот, называемое окислением жирных кислот или бета (β)-окислением , начинается в цитоплазме, где жирные кислоты превращаются в молекулы жирных ацил-КоА. Этот жирный ацил-КоА соединяется с карнитином, образуя молекулу жирного ацил-карнитина, которая помогает транспортировать жирную кислоту через митохондриальную мембрану. Оказавшись внутри митохондриального матрикса, молекула жирного ацил-карнитина снова превращается в жирный ацил-КоА, а затем в ацетил-КоА. Новообразованный ацетил-КоА входит в цикл Кребса и используется для производства АТФ так же, как ацетил-КоА, полученный из пирувата.
Рис. 3. Нажмите, чтобы увеличить изображение. Во время окисления жирных кислот триглицериды могут расщепляться на молекулы ацетил-КоА и использоваться для получения энергии при низком уровне глюкозы.![]()
Кетогенез
Если в результате окисления жирных кислот образуется избыток ацетил-КоА, а цикл Кребса перегружен и не может с этим справиться, ацетил-КоА направляется на создание кетоновых тел . Эти кетоновые тела могут служить источником топлива, если уровень глюкозы в организме слишком низок. Кетоны служат топливом во время длительного голодания или когда пациенты страдают от неконтролируемого диабета и не могут использовать большую часть циркулирующей глюкозы. В обоих случаях жировые запасы высвобождаются для выработки энергии в рамках цикла Кребса и будут генерировать кетоновые тела, когда накапливается слишком много ацетил-КоА.
В этой реакции синтеза кетона избыток ацетил-КоА превращается в гидроксиметилглутарил-КоА (ГМГ-КоА) . ГМГ-КоА является предшественником холестерина и промежуточным продуктом, который впоследствии превращается в β-гидроксибутират, первичное кетоновое тело в крови.
Рисунок 4. Избыток ацетил-КоА направляется из цикла Кребса в путь кетогенеза.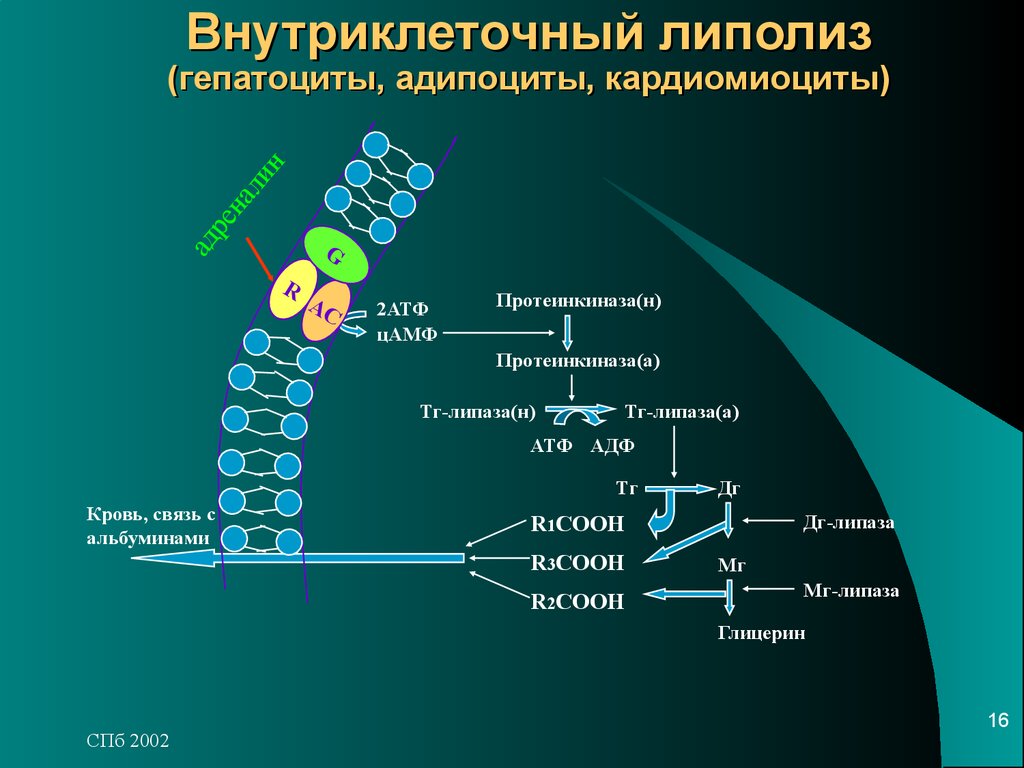 Эта реакция происходит в митохондриях клеток печени. Результатом является производство β-гидроксибутирата, основного кетонового тела, обнаруженного в крови.
Эта реакция происходит в митохондриях клеток печени. Результатом является производство β-гидроксибутирата, основного кетонового тела, обнаруженного в крови.
Окисление кетоновых тел
Органы, которые, как считалось классически, зависят исключительно от глюкозы, такие как мозг, на самом деле могут использовать кетоны в качестве альтернативного источника энергии. Это поддерживает работу мозга, когда глюкоза ограничена. Когда кетоны производятся быстрее, чем их можно использовать, их можно разложить на CO 2 и ацетон. Ацетон удаляется выдохом. Одним из симптомов кетогенеза является сладкий запах изо рта пациента, напоминающий алкоголь. Этот эффект дает один из способов узнать, правильно ли диабетик контролирует болезнь. Образующийся углекислый газ может закислять кровь, что приводит к диабетическому кетоацидозу, опасному состоянию у диабетиков.
Кетоны окисляются для производства энергии для мозга. бета (β)-гидроксибутират окисляется до ацетоацетата и высвобождается НАДН.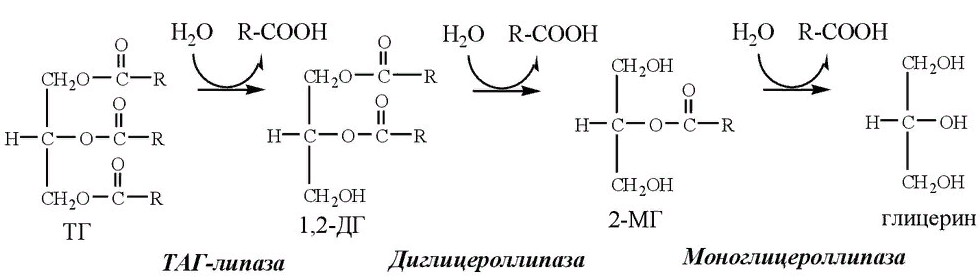 Молекула HS-CoA присоединяется к ацетоацетату, образуя ацетоацетил-CoA. Углерод внутри ацетоацетил-КоА, который не связан с КоА, затем отсоединяется, расщепляя молекулу на две части. Затем этот углерод присоединяется к другому свободному HS-CoA, в результате чего образуются две молекулы ацетил-CoA. Эти две молекулы ацетил-КоА затем перерабатываются в цикле Кребса для выработки энергии.
Молекула HS-CoA присоединяется к ацетоацетату, образуя ацетоацетил-CoA. Углерод внутри ацетоацетил-КоА, который не связан с КоА, затем отсоединяется, расщепляя молекулу на две части. Затем этот углерод присоединяется к другому свободному HS-CoA, в результате чего образуются две молекулы ацетил-CoA. Эти две молекулы ацетил-КоА затем перерабатываются в цикле Кребса для выработки энергии.
Рисунок 5. Когда уровень глюкозы ограничен, кетоновые тела могут окисляться с образованием ацетил-КоА, который используется в цикле Кребса для выработки энергии.
Липогенез
При высоком уровне глюкозы избыток ацетил-КоА, образующийся в результате гликолиза, может быть преобразован в жирные кислоты, триглицериды, холестерин, стероиды и соли желчных кислот. Этот процесс, называемый липогенезом , создает липиды (жир) из ацетил-КоА и протекает в цитоплазме адипоцитов (жировых клеток) и гепатоцитов (клеток печени). Когда вы едите больше глюкозы или углеводов, чем нужно вашему телу, ваша система использует ацетил-КоА, чтобы превратить избыток в жир.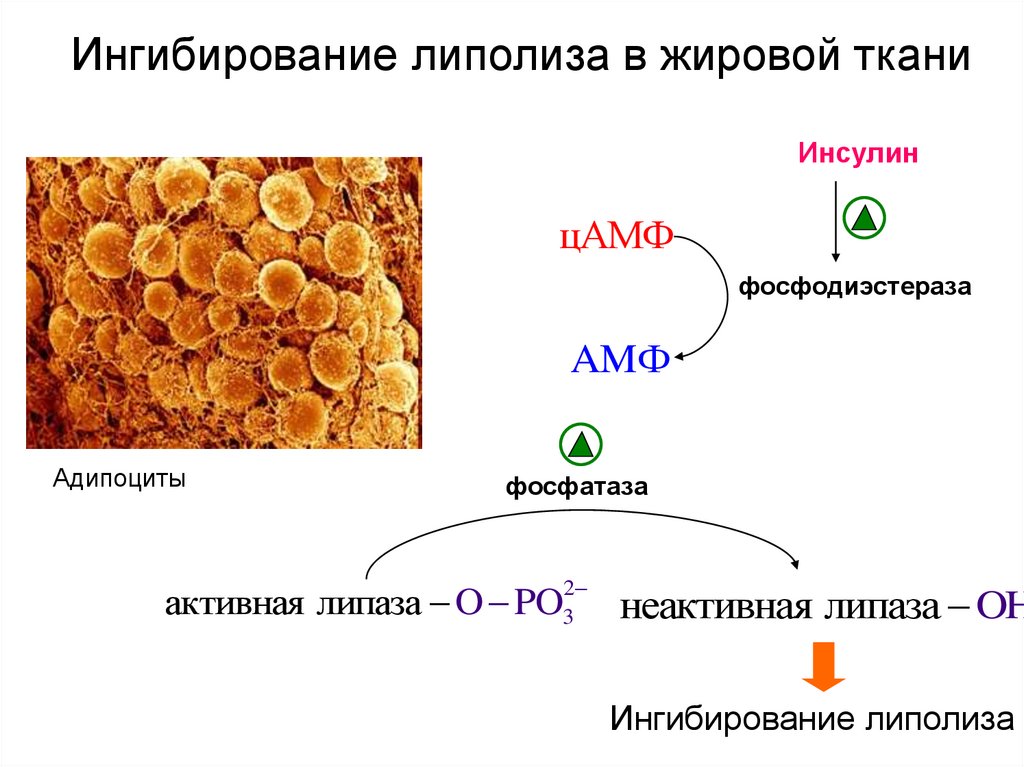 Хотя существует несколько метаболических источников ацетил-КоА, чаще всего он образуется в результате гликолиза. Доступность ацетил-КоА важна, поскольку он инициирует липогенез. Липогенез начинается с ацетил-КоА и развивается за счет последующего добавления двух атомов углерода из другого ацетил-КоА; этот процесс повторяется до тех пор, пока жирные кислоты не приобретут подходящую длину. Поскольку это анаболический процесс, создающий связи, расходуется АТФ. Однако создание триглицеридов и липидов является эффективным способом хранения энергии, доступной в углеводах. Триглицериды и липиды, высокоэнергетические молекулы, хранятся в жировой ткани до тех пор, пока они не потребуются.
Хотя существует несколько метаболических источников ацетил-КоА, чаще всего он образуется в результате гликолиза. Доступность ацетил-КоА важна, поскольку он инициирует липогенез. Липогенез начинается с ацетил-КоА и развивается за счет последующего добавления двух атомов углерода из другого ацетил-КоА; этот процесс повторяется до тех пор, пока жирные кислоты не приобретут подходящую длину. Поскольку это анаболический процесс, создающий связи, расходуется АТФ. Однако создание триглицеридов и липидов является эффективным способом хранения энергии, доступной в углеводах. Триглицериды и липиды, высокоэнергетические молекулы, хранятся в жировой ткани до тех пор, пока они не потребуются.
Хотя липогенез происходит в цитоплазме, необходимый ацетил-КоА образуется в митохондриях и не может транспортироваться через митохондриальную мембрану. Чтобы решить эту проблему, пируват превращается как в оксалоацетат, так и в ацетил-КоА. Для этих превращений необходимы два разных фермента. Оксалоацетат образуется под действием пируваткарбоксилазы, тогда как под действием пируватдегидрогеназы образуется ацетил-КоА. Оксалоацетат и ацетил-КоА объединяются с образованием цитрата, который может проникать через митохондриальную мембрану и проникать в цитоплазму. В цитоплазме цитрат снова превращается в оксалоацетат и ацетил-КоА. Оксалоацетат превращается в малат, а затем в пируват. Пируват возвращается через митохондриальную мембрану в ожидании следующего цикла липогенеза. Ацетил-КоА превращается в малонил-КоА, который используется для синтеза жирных кислот. На рисунке 6 обобщены пути метаболизма липидов.
Оксалоацетат и ацетил-КоА объединяются с образованием цитрата, который может проникать через митохондриальную мембрану и проникать в цитоплазму. В цитоплазме цитрат снова превращается в оксалоацетат и ацетил-КоА. Оксалоацетат превращается в малат, а затем в пируват. Пируват возвращается через митохондриальную мембрану в ожидании следующего цикла липогенеза. Ацетил-КоА превращается в малонил-КоА, который используется для синтеза жирных кислот. На рисунке 6 обобщены пути метаболизма липидов.
Рисунок 6. Липиды могут следовать одному из нескольких путей во время метаболизма. Глицерин и жирные кислоты следуют разными путями.
Обзор главы
Липиды поступают в организм из трех источников. Они могут поступать с пищей, накапливаться в жировой ткани организма или синтезироваться в печени. Жиры, поступающие с пищей, перевариваются в тонком кишечнике. Триглицериды расщепляются на моноглицериды и свободные жирные кислоты, а затем переносятся через слизистую оболочку кишечника.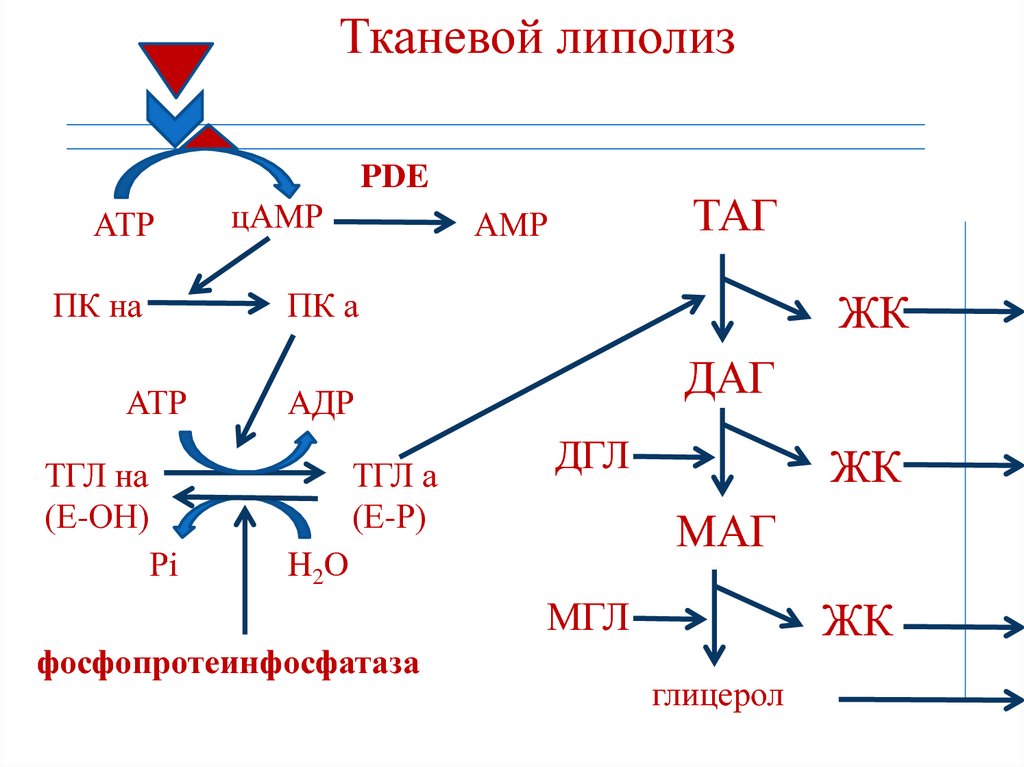

 Происходит базальный липолиз.
Происходит базальный липолиз.
 Диапедия: 51040851148 рев. нет. 17. По состоянию на 29 мая 2018 г.:
Диапедия: 51040851148 рев. нет. 17. По состоянию на 29 мая 2018 г.: