Подкожный клещ лечение у человека: Подкожный клещ — симптомы, диагностика и методы лечения
Симптомы ушного клеща и лечение демодекоза у собак
- Главная
- Лечение
- Симптомы болезней собак
- Подкожный клещ у собак
Демодекоз являет довольно характерной для собак это болезнью, другие домашние животные сталкиваются с этой проблемой редко. Заражение собаки подкожный клещом приводит к поражению кожных покровов. Раздражения на кожи появляется из-за продуктов жизнедеятельности, выделяемых клещами, они являются сильнейшими аллергенами.
После чего на коже появляются расчесы, нередко в этих областях выпадает шерсть. Сам клещ паразитирует в потовых железах и эпидермисе, но может поражать и внутренние органы.
В основном заражение демодексом происходит в возрасте до двух лет. Также, клещи чаще цепляются к гладкошерстным собакам. Развитию болезни способствуют сниженный иммунитет, инфекционные заболевания и наличие глистов. Для человека демодекоз не заразен, но для животного это заболевание является смертельно опасным. А значит откладывать поход в ветеринарную клинику нельзя.
А значит откладывать поход в ветеринарную клинику нельзя.
Симптомы заражения собаки подкожным клещом
- Резко возрастает агрессия, даже некогда дружелюбные питомцы могут не идти не контакт
- Собаку знобит и трясет, собаке холодно даже в теплом доме
- Появление воспаленных участков на теле, которые причиняют боль
- Наличие на коже гнойников с неприятным запахом
Опасность данного заболевания еще и в том, что воспаленные участки на коже животного являются отличной мишенью для сторонней инфекции. В открытые раны без труда проникают грибки и бактерии, что вкупе с ослабленным здоровьем собаки становится чрезвычайно опасным. Животное может получить заражение крови и погибнуть.
Как избавиться от подкожного клеща у собаки
Лечение проблем, связанных с подкожным клещом у собак, начинается с верной диагностики. При первых признаках заболевание следует обратиться к нам в ветцентр, где, уже на месте, врач произведет соскоб с кожи собаки для обследования, после чего станет ясно с какой болезнью мы имеем дело. Помимо соскоба, для точного диагностирования недуга ветеринару потребуются результаты анализов мочи и крови.
Помимо соскоба, для точного диагностирования недуга ветеринару потребуются результаты анализов мочи и крови.
Лечат подкожного клеща комплексно, применяется как местная, так и общая терапия. Непосредственно сам возбудитель лечат акарицидам, а кожу обрабатывают антисептиками. Эффективность применяемых способов лечения наблюдается в течение несколько недель.
Подкожный клещ у собаки: симптомы и лечение
Одна из проблем, с которыми сталкиваются собаководы — подкожный клещ у собаки. Как проявляются симптомы и какое необходимо проводить лечение.
Основная сложность с этим заболеванием заключается в том, что его возбудитель — демодексовый клещ — живёт в волосяных фолликулах абсолютного большинства животных. И только при ослаблении иммунитета или при наследственной предрасположенности у питомца развивается демодекоз.
Подкожный клещ у собаки: симптомы
Демодекоз в активной стадии легко спутать с дерматологическими заболеваниями грибковой или бактериальной природы. Его основные проявления:
Его основные проявления:
- Зуд, который периодически усиливается и провоцирует расчесывание и разгрызание кожных покровов.
- Изменения в поведении — вялость, апатия сменяющиеся периодами беспокойства, а также общая раздражительность, переходящая в агрессию.
- Шелушение кожи под шерстью.
- Выпадение шерсти (в первую очередь короткой — на лапах, ушах, морде).
- Снижение аппетита.
Описанные симптомы подкожного клеща у собаки могут накладываться на симптоматику других заболеваний. Связано это с тем, что при поражении кожных покровов часто происходит вторичное инфицирование, и у животного могут развиваться и грибковые инфекции.
Формы клещевых инвазий
Несмотря на то, что демодексовые клещи есть у большинства животных, их наличие приводит к появлению опасных симптомов только в редких случаях. Болезнь может протекать в 2 формах:
- Локализованной (юношеской).
 Для этой формы демодекоза характерно легкое течение практически без осложнений. У щенков и молодых собак в возрасте до 2 лет поражаются отдельные участки кожи, которые зудят и шелушатся. Почти всегда симптомы проходят быстро — важно пресекать попытки расчесов и обеспечить питание с достаточным количеством белка.
Для этой формы демодекоза характерно легкое течение практически без осложнений. У щенков и молодых собак в возрасте до 2 лет поражаются отдельные участки кожи, которые зудят и шелушатся. Почти всегда симптомы проходят быстро — важно пресекать попытки расчесов и обеспечить питание с достаточным количеством белка. - Генерализованной. Эта форма характеризуется масштабными поражениями кожных покровов, которые могут сопровождаться вторичным инфицированием. Генерализованный демодекоз доставляет беспокойство животному. Сильно ослабляет его и может привести к гибели собаки.
Приведенные на фото симптомы подкожного клеща у собак дают представление о том, насколько опасна эта патология.
Подкожный клещ у собак: лечение
Основа успешного лечения этого заболевания — вовремя проведенная диагностика. При появлении первых признаков (зуд, потеря шерсти) необходимо проконсультироваться с ветеринаром для назначения анализов. Диагностируют патологию на основе микроскопических исследований кожных соскобов. Иногда для подтверждения диагноза требуется анализ крови.
Иногда для подтверждения диагноза требуется анализ крови.
Максимальную эффективность при лечении демодекоза демонстрирует комплексная терапия. Она включает:
- Укрепление иммунной системы собаки.
- Нормализацию рациона, исключающую дефицит белков, витаминов и микроэлементов.
- Наружную обработку кожи и волосяного покрова противоклещевыми препаратами («Иммунопаразитан», «Амитраз» и аналоги).
- Обработку струпьев и расчесов антисептиками для предотвращения бактериальных или грибковых инфекций.
- Этиотропную терапию — подкожные инъекции составов, которые проникают в волосяные луковицы и угнетают развитие демодексовых клещей. Для этиотропной терапии используются такие средства как «Ивомек» или его аналоги.
Применение народных средств при лечении этой патологии не слишком эффективно. С другой стороны, обработка отварами полыни, чистотела или девясила может применяться в качестве профилактики вне обострений.
Схему лечения подкожной клещевой инвазии, а также перечень препаратов должен назначать квалифицированный ветеринар. Соблюдение его рекомендаций позволит купировать патологию — но в любом случае весь процесс может занять до полугода.
Демодекоз у собак и кошек
Очень часто к нам в клинику обращаются люди, которые подозревают у своих животных наличие подкожного клеща и очень напуганы этим. Действительно ли стоит бояться? Насколько это опасно для питомца и для окружающих? К каким последствиям может привести демодекоз? Давайте наконец-то разберемся в этих вопросах.
Во-первых, то о чем стоит знать, это то, что демодекс микроскопический клещ, которого невозможно обнаружить невооруженным взглядом. Для диагностики берутся соскобы с поверхности кожи, и иногда для обнаружения необходимо взять до 5 соскобов, которые врач изучает под микроскопом.
Что является симптомами заражения подкожным клещом? Каких-то особо характерных признаков демодекоза, к сожалению, нет. Владелец может заметить участки кожи, лишенные волос, немного покрасневшие, может присутствовать зуд. При этом, отсутствие любого из перечисленных симптомов не говорит о том, что животное не заражено демодексом. Но возраст является очень важным фактором при постановке данного диагноза и не стоит об этом забывать. У животных не достигших 3 месячного возраста крайне редко могут обнаруживаться симптомы демодекоза. В основном демодекоз начинает проявляться с 6-8 месячного возраста.
Владелец может заметить участки кожи, лишенные волос, немного покрасневшие, может присутствовать зуд. При этом, отсутствие любого из перечисленных симптомов не говорит о том, что животное не заражено демодексом. Но возраст является очень важным фактором при постановке данного диагноза и не стоит об этом забывать. У животных не достигших 3 месячного возраста крайне редко могут обнаруживаться симптомы демодекоза. В основном демодекоз начинает проявляться с 6-8 месячного возраста.
Давайте теперь выясним какой демодекоз бывает и как с ним бороться. Если демодекоз проявился в раннем возрасте и есть поражение одного участка — такой демодекоз называется ювенильным и может пройти спонтанно без противопаразитарного лечения. Также проявляется и также спонтанно может пройти и у взрослого животного локализованная форма подкожного клеща. У взрослых питомцев демодекоз не является первичным заболеванием. Он может появится на фоне сниженного иммунитета, в следствии применения кортикостероидов, болезней связанных с эндокринной системой. Риск состоит в том, что ювенильная и локализованная формы могут перейти в генерализированный демодекоз. Он проявляется поражением многих участков кожи, может сопровождаться инфекцией, сильным зудом, множественными алопециями(участками без шерсти) и также поражением внутренних органов(!). Животным с генерализированной формой обязательно необходимо лечение. Вот список пород, которые чаще всего страдают такой формой демодекоза: питбуль, бульдог, бостон терьер, бигль, колли, доберман, боксер, такса, шар-пей, ши-тцу. Животные с генерализированой формой исключаются из разведения.
Риск состоит в том, что ювенильная и локализованная формы могут перейти в генерализированный демодекоз. Он проявляется поражением многих участков кожи, может сопровождаться инфекцией, сильным зудом, множественными алопециями(участками без шерсти) и также поражением внутренних органов(!). Животным с генерализированной формой обязательно необходимо лечение. Вот список пород, которые чаще всего страдают такой формой демодекоза: питбуль, бульдог, бостон терьер, бигль, колли, доберман, боксер, такса, шар-пей, ши-тцу. Животные с генерализированой формой исключаются из разведения.
К счастью на современном рынке ветеринарных препаратов существует масса лекарств, способных справиться с данной проблемой. Очень важно, чтобы владелец ответственно подошел к рекомендациям врача по лечению животного. При любой форме демодекоза необходим контроль состояния животного каждые 3-4 недели, до полного выздоровления.
И теперь самый главный вопрос, волнующий всех владельцев: опасно ли животное с демодекозом для человека? И ответ: однозначно нет! У человека присутствует свой видовой возбудитель демодекоза, который не может обитать на коже животного, так же и подкожный клещ собаки или кошки не может жить на коже человека.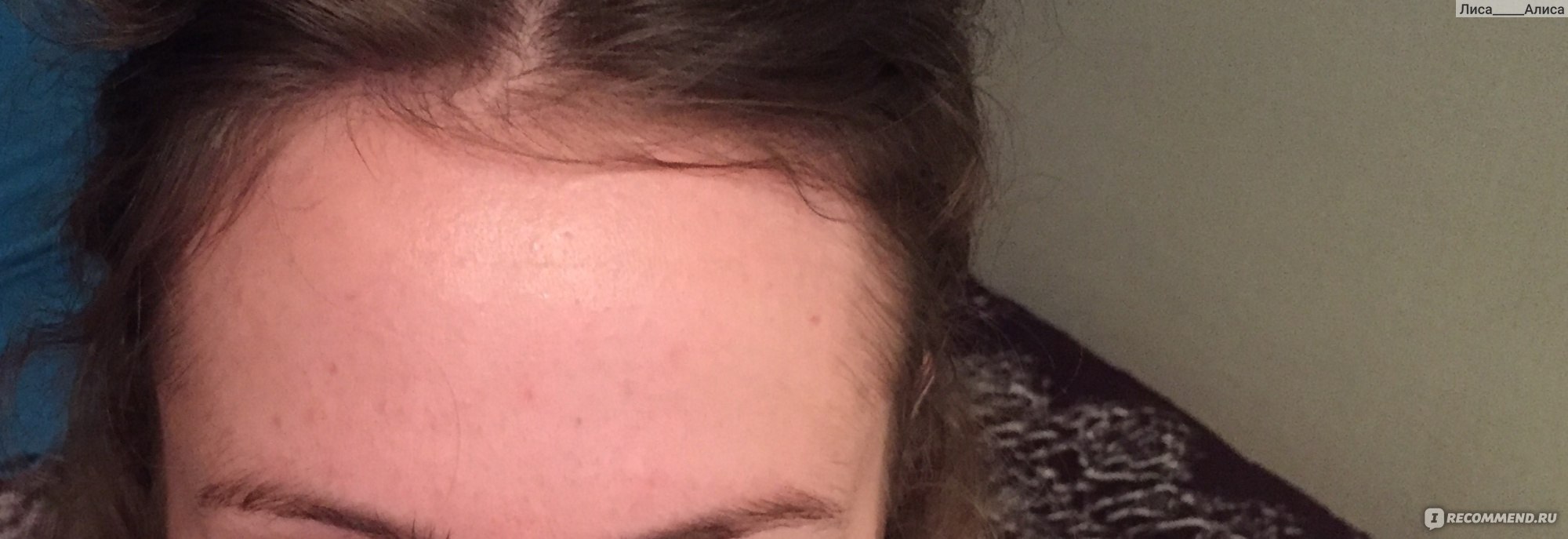
Если вас интересуют еще какие-то вопросы, связанные с данным заболеванием, вы можете обратиться к специалистам в ветеринарную клинику ВетМакс и получить больше информации. Если вы подозреваете у своего животного демодекоз приходите к нам на прием, не занимайтесь самолечением! Залог скорейшего выздоровления вашего любимца — это верно поставленный диагноз и своевременное лечение лечение.
Чучко Анна Олеговна, ветеринарный врач дерматолог.
симптомы и лечение, народные средства
В случае появления на лице у человека красной угревой сыпи или прыщей, следует обратить внимание на тот факт, что возможно поражение демодекозом, тем более, если привычные средства не позволяют от них избавиться. Присутствие у человека подкожных клещей вызывает этот недуг. В этой статье рассказывается, почему и как появляются подкожные клещи, а также, как эффективно от них избавиться, как аптечными средствами, так и народными методами.
Демодекоз: определение
Этот термин относится к обозначению хронического недуга, связанного с кожным покровом человека, который вызывается подкожным клещом. Угревая железница – это второе название этой болезни. Всемирная организация здравоохранения указывает на то, что около 90 % всего населения может быть поражено этим паразитом. Проявление демодекоза у человека связано с кожей лица, лба, век, носогубных складок, наружных слуховых проходов. Кроме этого, подкожный клещ селится в волосах на голове, на груди и на спине.
Угревая железница – это второе название этой болезни. Всемирная организация здравоохранения указывает на то, что около 90 % всего населения может быть поражено этим паразитом. Проявление демодекоза у человека связано с кожей лица, лба, век, носогубных складок, наружных слуховых проходов. Кроме этого, подкожный клещ селится в волосах на голове, на груди и на спине.
Виды подкожных клещей у людей и их особенности
Как правило, у человека приживаются 2 вида клещей, в зависимости от части тела, где они паразитируют. Например:
- Демодекс фолликулорум, который предпочитает жить в волосах, на бровях и на ресницах. Этот вид клеща достигает размеров от 0,2 до 0,4 мм.
- Демодекс бревис. Этот вид клеща паразитирует в сальных железах человека. Величина паразита – от 0,15 до 0,48 мм.
Интересно знать, откуда такое заболевание может взяться у человека?
Пути заражения
Это серьезное заболевание может появиться у любого человека, независимо от пола и других признаков. Насколько известно, существует два пути заражения демодекозом. А именно:
Насколько известно, существует два пути заражения демодекозом. А именно:
- В результате прямого контакта человека с человеком. Это может быть обычное рукопожатие, прикасание к коже человека, а также в результате поцелуя, может даже самого безобидного, дружеского.
- В результате непрямого контакта, посредством предметов каждодневного обихода. Такими предметами могут быть: постельные принадлежности, средства личной гигиены, накидка на кресло или диван, предметы интерьера и т.д.
Подкожный клещ прекрасно себя чувствует в условиях, когда иммунитет у человека ослаблен и, он не в состоянии справиться с жизнедеятельностью подобных паразитов. Эти членистоногие, из класса паукообразных, начинают активно размножаться при определенных условиях, о чем и пойдет дальнейший разговор.
Причины развития
Подкожный клещ – это паразит, который способен долгое время находиться в теле человека и ждать оптимальных условий для того, чтобы предстать «во всей красе», доставляя человеку максимум дискомфорта.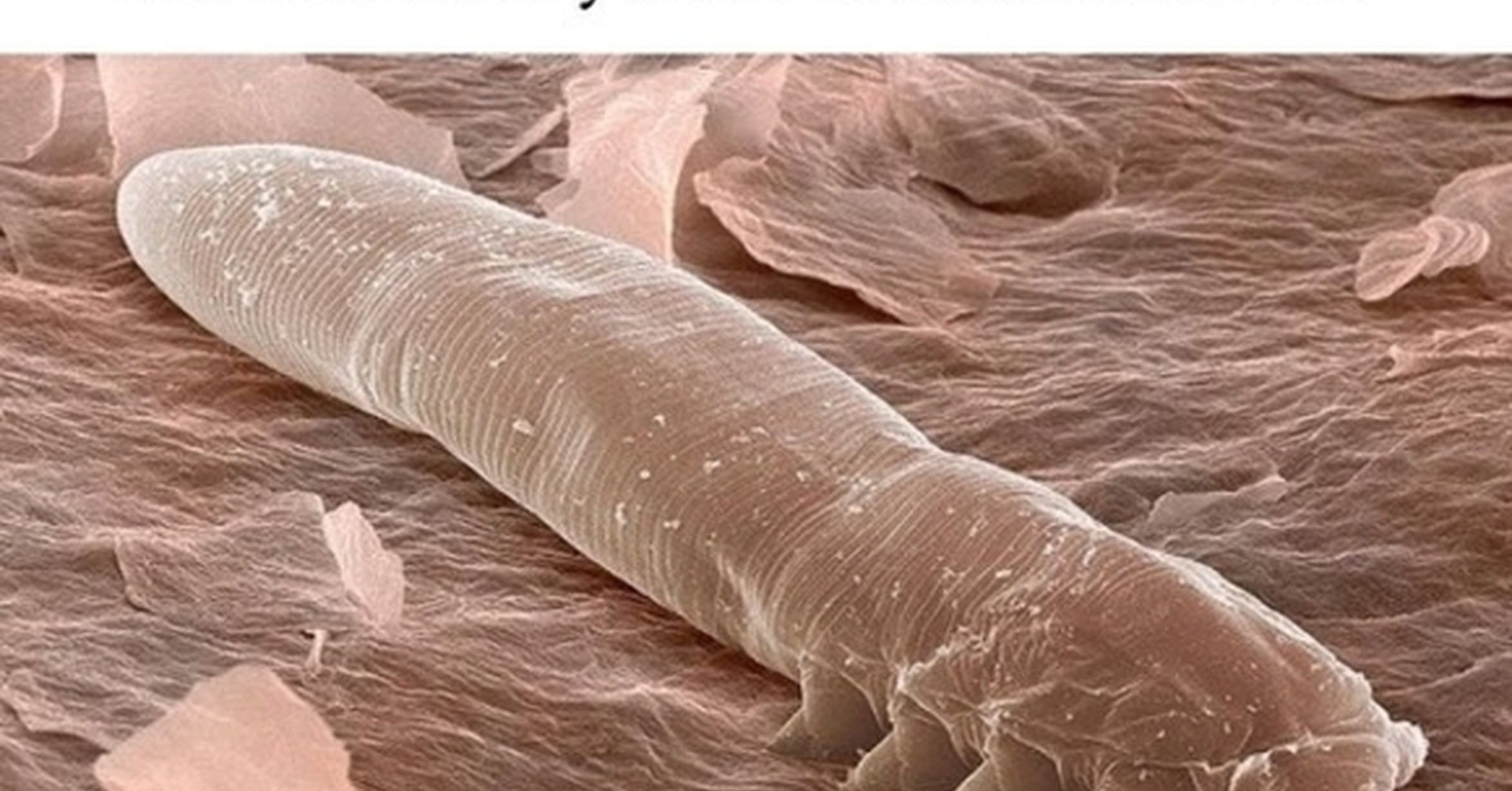 Когда такие благоприятные условия проявляются и, клещ начинает активно развиваться, развивается демодекоз. Дальнейшие действия – это лечение болезни.
Когда такие благоприятные условия проявляются и, клещ начинает активно развиваться, развивается демодекоз. Дальнейшие действия – это лечение болезни.
Появление подобного недуга связано с некоторыми факторами, которые, так или иначе, влияют на развитие болезни. Например:
- Слабое функционирование иммунной системы.
- Нарушения нормальной работы эндокринной системы.
- Ведение нездорового образа жизни.
- Проблемы с нормальной работой ЖКТ.
- Нервно-психическая неуравновешенность.
- Длительное нахождение под прямыми солнечными лучами.
- Нарушение гормонального баланса в организме.
- Нарушение обменных процессов.
- Период беременности.
- Проблемы с экологией.
- Увлечение косметикой, солярием и баней.
Подобная болезнь лечится, если к проблемам лечения человек подходит со всей серьезностью. Чтобы правильно определиться с лечением, необходимо хорошо изучить симптоматику этого заболевания.
ПОДКОЖНЫЙ КЛЕЩ У ЧЕЛОВЕКА. Демодекс под микроскопом в лаборатории. СИМПТОМЫ КАК ИЗБАВИТЬСЯ?
Демодекс под микроскопом в лаборатории. СИМПТОМЫ КАК ИЗБАВИТЬСЯ?
Watch this video on YouTube
Диагностика болезни
Как и всякая другая болезнь, демодекоз характеризуется проявлением внешних признаков, которые можно связать с появлением подкожного клеща у человека:
- У человека, пораженного подкожным клещом, кожа становится жирной, на теле проявляется повышенная влажность, о чем свидетельствует появившийся блеск.
- В результате того, что кожа теряет свойство дышать, на ней появляется сыпь, прыщи или мелкие язвы.
- В результате жизнедеятельности подкожных клещей, человек начинает ощущать, как бы присутствие в глазах инородного тела.
- В области век проявляется нестерпимый зуд и отечность, а внешний вид век указывает на признаки протекающего воспалительного процесса.
- Из глаз начинает выделяться слизь.
- У человека начинают выпадать ресницы, на фоне появления на них белых чешуек.
- На местах сильного воспалительного процесса видны гнойные корочки.

- В результате этого, больной ощущает сильный дискомфорт, особенно в ночное время, когда подкожный клещ проявляет максимум активности.
- У больного человека нос увеличивается в размерах, причем, весьма заметно, что удивляет окружающих.
- В местах, где растут волосы, ощущается сильный зуд, а также отмечается выпадение волос.
- В ушах так же ощущается нестерпимый зуд.
Все вышеперечисленные симптомы свидетельствуют о появлении подкожного клеща. Это сигнал к тому, чтобы незамедлительно начать лечение.
Подтверждение болезни
В случае появления первых признаков демодекоза следует тут же обратиться к врачу, чтобы подтвердить опасения. Чтобы определиться со схемой лечения, необходимо сдать анализы. Только так можно рассчитывать на быстрое выздоровление. Ни в коем случае не следует заниматься самолечением, поскольку избавиться от этого паразита не так просто.
Перед тем, как сдавать анализы, 24 часа нельзя осуществлять манипуляции по обработке проблемных участков и не употреблять противобактерицидных препаратов. Чтобы сделать анализ, с пораженных участков берут соскобы, после чего материал исследуют под микроскопом. Если концентрация этих членистоногих превышает больше 5-ти особей на 1 см. квадратный кожи, то диагноз демодекоз подтверждается. Подтверждение диагноза является основанием для начала полноценного курса лечения, чтобы избавиться от паразитов.
Чтобы сделать анализ, с пораженных участков берут соскобы, после чего материал исследуют под микроскопом. Если концентрация этих членистоногих превышает больше 5-ти особей на 1 см. квадратный кожи, то диагноз демодекоз подтверждается. Подтверждение диагноза является основанием для начала полноценного курса лечения, чтобы избавиться от паразитов.
Лечение подкожного клеща у человека
Справиться с подкожным клещом не так просто, тем более, если болезнь запущена. Как правило, демодекоз стараются лечить самостоятельно, что приводит только к ухудшению положения. Особенно это актуально в том случае, если поражены веки и ресницы. В таком случае придется обязательно посетить офтальмолога, чтобы он назначил дополнительное лечение. Но сначала нужно посетить дерматолога, который назначает комплексное лечение. Лечение демодекоза – это длительный процесс, который требует максимум терпения.
Врач-дерматолог определяется со схемой лечения, выписывая препараты, как для наружного, так и внутреннего применения. Задача сводится к тому, чтобы уничтожить паразитов на физическом уровне, восстановить функционирование кожных покровов, уменьшить чувство дискомфорта, и предупредить прогрессирование болезни в будущем.
Задача сводится к тому, чтобы уничтожить паразитов на физическом уровне, восстановить функционирование кожных покровов, уменьшить чувство дискомфорта, и предупредить прогрессирование болезни в будущем.
Кроме курса применения медикаментозных препаратов, очень важно знать, как правильно ухаживать за кожей лица, какие кремы лучше применять для этого и как правильно питаться.
Лучшие препараты против демодекоза
Лечение такой болезни, как демодекоз, требует комплексного подхода, иначе избавиться от подкожного клеща раз и навсегда вряд ли удастся. Чтобы избавиться от этой болезни, врачи назначают различные медикаменты, отличающиеся способом действия. Это позволяет максимально эффективно использовать все препараты. Например:
- Препараты противопаразитарной группы, на основе метронидазола или тинидазола. Подобные компоненты проникают в кожу, действуя на клещей, что вызывает их гибель.
- Противомикробные препараты, предназначенные для уменьшения числа паразитов и нормализации обменных процессов кожных покровов.

- Препараты антигистаминной группы, которые снимают нестерпимый зуд кожных покровов и снимают отечность.
- Противобактериальные средства, в том числе и в виде капель, для лечения демодекоза, поражающего веки и ресницы.
- Препараты сосудоукрепляющей группы.
- Препараты для стимулирования иммунной системы, что позволяет включить защитные функции организма.
В комплексе с медикаментозными средствами, врачи назначают ряд физиотерапевтических процедур, таких как:
- Сеансы физиотерапии.
- ТСА-пилинг, для очистки кожи от клеток эпидермиса, где находятся клещи.
- Озонотерапию, как средство, повышающее устойчивость организма к болезнетворным микроорганизмам.
- Лечение холодом (криотерапия), что помогает избавиться от жжения и зуда.
Если назначить правильное лечение, а потом неукоснительно придерживаться всех процедур, то от подкожного клеща можно избавиться раз и навсегда.
Народные средства клеща от подкожного клеща
Многие люди прибегают к лечению демодекоза различными мазями, настоями и отварами, приготовленными на основе природных компонентов. Они обладают противобактерицидным, антимикробным и противовоспалительным действием. Часто для лечения этой болезни используют березовый деготь, хозяйственное мыло, керосин и т.д.
Они обладают противобактерицидным, антимикробным и противовоспалительным действием. Часто для лечения этой болезни используют березовый деготь, хозяйственное мыло, керосин и т.д.
От подкожного клеща реально избавиться с помощью народных средств, приготовленных на основе различных рецептов. Например:
- Сок алоэ смешивается с кипяченой водой в одинаковых пропорциях. В этом растворе смачивается отрезок чистой ткани или отрезок марли, немного выжимается и прикладывается к проблемному месту на 20 минут. Сделать нужно 25 таких примочек, через день.
- Применение отвара из цветов липы. Для приготовления отвара из соцветий липы необходимо взять 2 ст. ложки исходного материала и залить его 200 мл очищенной воды. Затем все это ставится на водяную баню, где-то на 10 минут. После этого раствор процеживается. Когда он остынет, то этим раствором протирают пораженные участки тела утром и вечером, каждый день.
- Отвар из сухих соцветий ромашки.
 Способ приготовления такой же, как и с соцветиями липы. Отвар процеживается, после чего на его основе делают компрессы по несколько раз в день. При этом нужно чередовать холодные и горячие компрессы.
Способ приготовления такой же, как и с соцветиями липы. Отвар процеживается, после чего на его основе делают компрессы по несколько раз в день. При этом нужно чередовать холодные и горячие компрессы. - На основе травяного сбора. Для приготовления действующего средства понадобятся такие травы, как полынь, мята, подорожник, крапива, пижма и другие. Раствор готовится на основе одинакового объема всех компонентов (по 1 столовой ложке). Сюда же добавляется 2 ст. ложки череды, после чего исходный материал заливается 0,5 л. кипятка, накрывается крышкой и настаивается около получаса. После этого раствор процеживается и принимается внутрь по 100 мл за полчаса до еды в течение 1 месяца.
Обстоятельства, определяющие эффективность лечения
Как упоминалось ранее, избавляться от кожных клещей не так просто, поэтому эффективность лечения зависит от многих факторов, таких как выдержка, терпение, выполнение всех предписаний лечащего врача и т.д. кроме этого, нужно придерживаться ряда правил, таких как:
- Здоровое питание без жирной, острой, соленой и жареной пищи, с ограничением употребления углеводов.
 В основу рациона должны входить кисломолочные продукты, свежие овощи и фрукты. От курения и от употребления алкоголя придется отказаться.
В основу рациона должны входить кисломолочные продукты, свежие овощи и фрукты. От курения и от употребления алкоголя придется отказаться. - Придется так же отказаться от посещения бани, сауны и солярия.
- Сделать индивидуальными все аксессуары, такие как косметика, одежда и обувь.
- Отказаться от применения пуховых подушек и одеял, так как в них запросто могут жить клещи, и они могут вызвать рецидив.
- Обязательно, после стирки, гладить постельные принадлежности.
- Не следует самостоятельно выдавливать прыщи, которые появились вследствие жизнедеятельности клещей.
- Для умывания следует использовать только холодную воду.
- Запрещается заниматься самолечением, так как эта болезнь может перейти в хроническую стадию.
Демодекоз – это очень серьезное заболевание. Чем раньше начать лечение, тем раньше удастся избавиться от подкожных клещей. Когда болезнь запущена, то на лечение может уйти полгода, а то и больше. Поэтому, лучше не начинать лечение «бабушкиными» средствами, которые могут снять чувство дискомфорта, но клещей они не убьют, и они будут продолжать свою жизнедеятельность, хотя и не так активно. Избавиться от клещей помогут исключительно химические препараты и правильное лечение, с правильным чередованием различных препаратов. Другими словами, при первом же подозрении на подкожного клеща, лучше сразу же отправиться к врачу-дерматологу.
Избавиться от клещей помогут исключительно химические препараты и правильное лечение, с правильным чередованием различных препаратов. Другими словами, при первом же подозрении на подкожного клеща, лучше сразу же отправиться к врачу-дерматологу.
Демодекоз собак и кошек-симптомы, лечение, диагностика
Каждый третий домашний питомец является носителем клеща рода Демодекс, который приводит к тяжелым кожным заболеваниям. Сильный зуд, гнойнички и выпадение шерсти – все это только часть симптомов, сигнализирующих о присутствии паразита. Но это не значит, что именно ваш любимец находится в неминуемой опасности. Прежде чем бить тревогу, давайте разберемся, что такое демодекоз и чем он угрожает нашим животным.
Содержание:
1. Возбудитель демодекоза, жизненный цикл и путь заражения
2. Симптомы
3. Формы заболевания
4. Диагностика
5. Лечение и профилактика
Возбудитель демодекоза, жизненный цикл и путь заражения
Demodex Canis – это небольшой клещ 0,2-0,3 мм сигаровидной формы, обитающий в сальных железах кошек и собак. Он питается клетками кожи, рыхлой клетчаткой, а также жировым секретом. Его жизненный цикл составляет 21-28 дней. За это время из яйца вылупляется личинка, которая преобразуется в нимфу, а затем в имаго. В норме рост и развитие клеща сдерживается иммунными силами организма питомца. Но если имели место инфекционные заболевания, стрессы, плохой уход и неполноценное питание, то паразит начинает активно размножаться.
Он питается клетками кожи, рыхлой клетчаткой, а также жировым секретом. Его жизненный цикл составляет 21-28 дней. За это время из яйца вылупляется личинка, которая преобразуется в нимфу, а затем в имаго. В норме рост и развитие клеща сдерживается иммунными силами организма питомца. Но если имели место инфекционные заболевания, стрессы, плохой уход и неполноценное питание, то паразит начинает активно размножаться.
Передача паразита происходит контактным путем при взаимодействии больного и здорового животного. Чаще всего это происходит на первом году жизни собаки или кошки, когда иммунные силы значительно снижены.
Симптомы
Первым симптомом является изнуряющий зуд, вследствие которого животное активно чешется. Это приводит к возникновению расчесов и повреждению кожных покровов. Чуть позже начинает выпадать шерсть в области морды, лопаток, бедер или лап. К этому присоединяется покраснение кожных покровов, сыпь и прочее.
Типичные признаки:
- островковый тип аллопеции;
- наличие корок на кожных покровах;
- покраснение и зуд кожи;
- папулезная или пустулезная сыпь;
- расчесы
Формы заболевания
В процессе жизнедеятельности клещ формирует микроповреждения и каналы, которые являются входными воротами для инфекций. Также они выделяет фекалии, вызывающие зуд и аллергические реакции.
В зависимости от клинической картины и степени поражения, выделяют следующие формы заболевания:
- Локальная – развивается не более чем на 5 областях кожи и размер поражения не превышает 2-3 см в диаметре. Характеризуется наличием небольших очагов облысения, при этом на коже могут быть чешуйки или папулезная сыпь.
- Генерализованная – поражает практически всю кожу питомца и протекает с осложнениями. Наблюдаются значительные участки облысения, царапины на коже и развитие вторичной инфекции.
 В зависимости от преобладающего типа сыпи, может быть: чешуйчатая, папулезная, пустулезная или смешанная форма. Очень важно своевременно оказать медицинскую помощь.
В зависимости от преобладающего типа сыпи, может быть: чешуйчатая, папулезная, пустулезная или смешанная форма. Очень важно своевременно оказать медицинскую помощь.
Отдельно следует выделить ювенильную форму демодекоза кошек и собак. Она встречается у животных до 1 года и характеризуется легким течением. Как правило, заболевание или не возникает вообще или протекает без осложнений.
Диагностика
Достаточно объективного осмотра, чтобы ветеринарный врач заподозрил демодекоз. Для постановки диагноза нужно провести соскоб с последующим микроскопическим исследованием. В ветеринарной лаборатории «Шанс Био» вы в кротчайшие сроки получите результаты по анализу на ушного клеща и уже через один час ветеринарный врач сможет составить план лечения Вашего питомца.
Эктопаразиты и дерматофиты (микроскопия) — анализ лаборатории «Шанс Био» для диагностики демодекоза
Лечение и профилактика
Схемы лечения назначает исключительно ветеринарный врач при личном контакте. Это очень важно, поскольку некоторые препараты для лечения демодекоза могут нанести непоправимый вред здоровью питомца.
Это очень важно, поскольку некоторые препараты для лечения демодекоза могут нанести непоправимый вред здоровью питомца.
Помимо этиотропного лечения, также назначаются препараты для борьбы с вторичными инфекциями: противогрибковые, антибиотики, антисептики. При лечении генерализованных инфекций проводятся общие гигиенические мероприятия:
- подстригание животного;
-
обработка специальным шампунем; -
очистка кожных покровов и их обработка.
В состав комплексного лечения также входят иммуностимуляторы.
Для предотвращения развития демодекоза у кошек и собак достаточно проводить простые профилактические мероприятия. Речь идет о полноценном и сбалансированном питании, качественном уходе и применении витаминов.
Подкожный клещ у кошек (демодекоз): симптомы и лечение
Подкожный клещ у кошек — иное его название “демодекоз” — практически ничем не отличается от человеческого заболевания.
Это заболевание (демодекоз) паразитарного характера, которое провоцирует подкожный клещ.
Демодекоз поражает кожный и волосяной покров кошки. Заболевание может поразить практически любое животное, а получить его ваш питомец может от других кошек, котята — от матери, а также еще не родившиеся особи внутриутробным способом.
В норме подкожный клещ существует у всех здоровых кошек, но он никаким образом себя не проявляет.
Откуда же тогда возникает демодекоз?
Все дело в том, что у кошки начинается нехватка витаминов, возможно, недостаточно чистые условия проживания и как следствие — снижается иммунитет. В результате этого продукция жизнедеятельности подкожного клеща увеличивается, давая о себе знать в виде поражения кожи и шерсти, начинает негативно сказываться на здоровье кошки.
Выделяют два подвида заболевания.
Первый поражает одну или несколько локальных зон, не затрагивая при этом лапы кошки.
Второй вид наиболее тяжелый, проявляется в виде локальных поражений в нескольких местах и затрагивает лапки животного.
Обычно кошкам, перенесшим вторую форму демодекоза, рекомендуется делать стерилизацию, так как вероятность передать заболевание будущему потомству весьма высока.
Симптомы подкожного клеща у кошек
Симптомы подкожного клеща у кошки лучше всего, разумеется, стараться разглядеть на ранних стадиях. Чем раньше хозяин увидит признаки начавшегося заболевания, тем скорее обратится за помощью к нам, тем эффективнее и легче будет проходить лечение. Хотя ветеринары Био-Вет, безусловно, практикуют лечение демодекоза у кошек и на самых последних стадиях.
Итак, Вам следует как можно скорее обращаться к ветеринару, если вы заметили у вашей кошки подобные симптомы:
- появление на коже высыпаний, гнойничков, угрей;
- зуд;
- кошка постоянно чешется;
- ухудшается состояние шерсти в целом;
- кожа краснеет, появляется пигментация;
- выпадение шерсти вокруг глаз;
- кожа начинает локально шелушиться;
- шерсть выпадает также локально.

- иногда может наблюдаться потеря аппетита, вялость и прочее.
Признаки подкожного клеща у кошки довольно-таки специфичные, поэтому вам не составит особого труда разглядеть у вашей любимицы зачатки болезни.
Лечение подкожного клеща у кошек
Лечение подкожного клеща у кошек назначается после взятия всех необходимых анализов, главным образом, специального соскоба, определяющего вид клеща. Ветеринар обычно назначает больным кошкам витамины, препараты, направленные на укрепление и поднятие иммунитета, уколы, капли.
Кошку необходимо будет мыть специальным антибактериальным шампунем, а также мазать пораженные места мазями, которые также назначит врач. Правильное питание будет являться дополнительным стимулятором к выздоровлению вашего питомца.
Демодекоз собак
Демодекоз. Подкожный клещ – это паразитарное заболевание кожи.
Часто встречается у собак, вызывается повышенным числом клещей Demodex, которые являются симбионтами и присутствуют в нормальной микрофлоре кожи.
Клещи могут жить в волосяных фоликулах или на поверхности кожи. Передаются от матери щенкам в течение первых двух-трех дней после их рождения. Считается, что взрослые животные не могут заразиться демодекозом друг от друга. Развитие заболевания связано с иммунодефицитом. Полагают, что некоторые собаки предрасположены к наследственному дефекту Т-клеточного иммунитета различной степени сложности, угнетение выработки Т-лимфоцитов вызывается самими паразитами и соизмеримо с их количеством. Сопутствующая пиодермия способствует иммуносупрессии.
Восприимчивость к демодекозу повышена у чистокровных собак особенно у шарпея, мопса, вест хайленд уайт терьера, скотч терьера, английского и французского бульдогов, немецкой овчарки.
Типы поражения Demodex:
- Локализованный: не более пяти пятен. При поражении межпальцевых пространств — поражена одна конечность.
- Генерализованный. Начинается в ювенильном возрасте — более пяти пятен. При поражении межпальцевых пространств — поражены две и более конечностей, может возникать у взрослых животных.

Клинические симптомы:
Локализованный: начинается в три- шесть месяцев; не более пяти пятен; эритема кожи ( покраснение), алопеция (облысение), образование нежирных чешуек; зуд различной степени выраженности; часто поражается кожа в области морды и глаз.
Генерализованный: начинается в три — восемнадцати месячном возрасте; обычно развивается из локализованной формы заболевания вследствие отсутствия спонтанной ремиссии или после лечения глюкокортокойдами; множество поражений, особенно в области головы, конечностей и тела; эритема кожи, алопеция, шелушение, прогрессирующее до образования корочек и кровоточащих поражений; часто присоединяется пиодермия, обычно вызванная Staphyloccocus intermedius.
Довольно редко демодекоз начинает развиваться у взрослых животных. Обычно возникает на фоне внутреннего заболевания, злокачественных новообразований или при проведении иммуносупрессивной терапии.
Диагноз демодекоз ставится врачом на основании данных анамнеза (предоставленных владельцами), осмотра животного и проведения ряда лабораторных исследований (берется не менее пяти глубоких соскобов с кожи и. т.д.)
т.д.)
Лечение демодекоза:
При локализованной форме в большинстве случаев наблюдается спонтанное устранение заболевания через шесть — восемь недель. Ухудшение состояния указывает на прогрессирование к генерализованному демодекозу.
При генерализованной форме лечение проводится дольно длительно, в течение нескольких месяцев специфическими антипаразитарными препаратами. При наличии сопутствующей пиодермии назначают длительную антибиотикотерапию. Контроль лечения проводят один раз в четыре- пять недель (берут повторно соскобы). Прекращают лечение только после того, как в двух сериях соскобов с интервалом в один месяц ни в одном из соскобов не будет обнаружен ни один клещ, ни живой, ни мертвый.
Обычно внешнее выздоровление пациента наступает раньше, чем можно прекратить лечение. При преждевременном прекращении лечения рецидив (возобновление заболевания) очень вероятен.
Лечение может занять 2-5 месяцев, иногда дольше.
Прогноз:
В большинстве случаев благоприятный. При генерализованной форме демодекоза крайне редко возможны рецидивы болезни.
При генерализованной форме демодекоза крайне редко возможны рецидивы болезни.
Демодекоз наследуемое заболевание, поэтому животных с генерализованной формой не рекомендуют для разведения.
Лечение мигрирующей эритемы | Болезнь Лайма
Люди, получающие соответствующие антибиотики на ранних стадиях болезни Лайма, обычно быстро и полностью выздоравливают. Ранняя диагностика и правильное лечение антибиотиками болезни Лайма могут помочь предотвратить позднюю болезнь Лайма.
Схемы лечения, перечисленные в следующей таблице, относятся к мигрирующей эритемной сыпи, наиболее частому проявлению ранней болезни Лайма. Эти схемы, возможно, потребуется скорректировать в зависимости от возраста человека, истории болезни, основных состояний здоровья, статуса беременности или аллергии.Проконсультируйтесь со специалистом-инфекционистом относительно индивидуальных решений относительно лечения пациента.
| Возрастная категория | Лекарство | Дозировка | Максимум | Продолжительность, сутки | Список литературы |
|---|---|---|---|---|---|
| Взрослые | Доксициклин ИЛИ | 100 мг два раза в день перорально | НЕТ | 10-14 | 1–6 |
| Амоксициллин ИЛИ | 500 мг 3 раза в день перорально | НЕТ | 14 | 1, 3, 6 | |
| Цефуроксим | 500 мг два раза в день перорально | НЕТ | 14 | 6 | |
| Детский | Доксициклин ИЛИ | 4.4 мг / кг в день перорально, разделенные на 2 приема | 100 мг на дозу | 10–14 | 7,9 |
| Амоксициллин ИЛИ | 50 мг / кг в день перорально, разделенная на 3 приема | 500 мг на дозу | 14 | 7,8 | |
| Цефуроксим | 30 мг / кг в день перорально, разделить на 2 приема | 500 мг на дозу | 14 | 8 |
ПРИМЕЧАНИЕ: Для людей с непереносимостью амоксициллина, доксициклина и цефуроксима можно использовать макролиды азитромицин, кларитромицин или эритромицин, хотя они имеют более низкую эффективность. За людьми, принимающими макролиды, следует внимательно наблюдать, чтобы убедиться, что симптомы исчезнут.
За людьми, принимающими макролиды, следует внимательно наблюдать, чтобы убедиться, что симптомы исчезнут.
Лечение других форм болезни Лайма
Людям с другими формами диссеминированной болезни Лайма могут потребоваться более длительные курсы антибиотиков или внутривенное лечение антибиотиками, такими как цефтриаксон. Для получения дополнительной информации о лечении других форм болезни Лайма см .:
.
Рассмотрение подходов, лечение ранней болезни Лайма, артрита Лайма
Автор
Джон О. Мейерхофф, доктор медицины Клинический ученый в области ревматологии, отделение медицины, Синайская больница в Балтиморе
Джон О. Мейерхофф, доктор медицины, является членом следующих медицинских обществ: Американский колледж врачей, Американский колледж ревматологии
Раскрытие информации: Нечего раскрывать.
Соавтор (ы)
Рассел В. Стил, доктор медицины Клинический профессор, Медицинский факультет Тулейнского университета; Врач-штатный врач, Ochsner Clinic Foundation
Стил, доктор медицины Клинический профессор, Медицинский факультет Тулейнского университета; Врач-штатный врач, Ochsner Clinic Foundation
Рассел Стил, доктор медицины, является членом следующих медицинских обществ: Американской академии педиатрии, Американской ассоциации иммунологов, Американского педиатрического общества, Американского общества микробиологии, Американского общества инфекционных болезней, Медицинского центра штата Луизиана. Общество, Общество детских инфекционных болезней, Общество педиатрических исследований, Южная медицинская ассоциация
Раскрытие: Ничего не раскрывать.
Джеральд Зайдман, доктор медицины Профессор клинической офтальмологии Нью-Йоркского медицинского колледжа; Руководитель службы роговицы, директор отделения офтальмологии, Вестчестерский медицинский центр
Джеральд Зайдман, доктор медицины, является членом следующих медицинских обществ: Американской академии офтальмологии, Ассоциации исследований в области зрения и офтальмологии, Медицинского общества Вирджинии, Американского увеита Общество, Американский колледж хирургов, Американская медицинская ассоциация, Американское общество катарактальной и рефракционной хирургии, Медицинское общество штата Нью-Йорк, Phi Beta Kappa
Раскрытие информации: не подлежит разглашению.
Главный редактор
Герберт С. Даймонд, доктор медицины Приглашенный профессор медицины, отделение ревматологии, Медицинский центр Нижнего штата Нью-Йорка; Почетный председатель отделения внутренней медицины больницы Западной Пенсильвании
Герберт С. Даймонд, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha, Американский колледж врачей, Американский колледж ревматологии, Американская медицинская ассоциация, Phi Beta Kappa
Раскрытие информации: нечего раскрывать.
Благодарности
Стивен С. Аронофф, доктор медицины Уолдо Э. Нельсон Председатель и профессор кафедры педиатрии Медицинского факультета Университета Темпл
Стивен С. Аронофф, доктор медицины, является членом следующих медицинских обществ: Общества педиатрических инфекционных болезней и Общества педиатрических исследований
webmd.com»> Раскрытие: Ничего не раскрывать.Ричард Г. Бачур, доктор медицины Адъюнкт-профессор педиатрии Гарвардской медицинской школы; Заместитель начальника и директор по работе с коллегами, лечащий врач, отделение неотложной медицины, Детская больница Бостона
Раскрытие: Ничего не раскрывать.
Лоуренс Х. Брент, доктор медицины Доцент медицины, Медицинский колледж Джефферсона Университета Томаса Джефферсона; Заведующий, программный директор, Департамент медицины, Отделение ревматологии, Медицинский центр Альберта Эйнштейна
Лоуренс Х. Брент, доктор медицины, является членом следующих медицинских обществ: Американской ассоциации развития науки, Американской ассоциации иммунологов, Американского колледжа врачей и Американского колледжа ревматологии
.
Раскрытие: Abbott Honoraria Выступление и обучение; Гонорар Centocor Consulting Консультации; Грант Genentech / исследовательские фонды Другое; HGS / GSK Honoraria Устная речь и преподавание; Гонорар Omnicare Consulting Консультации; Pfizer Honoraria Устная речь и обучение; Рош Выступление и обучение; Спаситель Гонорария Речь и преподавание; UCB Honoraria Устная речь и преподавание
Уильям Э. Капуто, доктор медицины Главный врач-резидент, отделение неотложной медицины, больница округа Кингс
Уильям Э. Капуто, доктор медицины, является членом следующих медицинских обществ: Американского колледжа врачей скорой помощи, Американской медицинской ассоциации и Ассоциации резидентов скорой медицинской помощи
Раскрытие: Ничего не раскрывать.
com»> Eugene Y Cheng, MD, FCCM Консультант, Отделение анестезиологии, Permanente Medical GroupРаскрытие: Ничего не раскрывать.
Дэн Данцл, доктор медицины Председатель, профессор отделения неотложной медицины, Госпиталь Университета Луисвилля
Дэн Данцл, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии неотложной медицины, Американского колледжа врачей неотложной помощи, Американской медицинской ассоциации, Медицинской ассоциации Кентукки, Общества академической неотложной медицины и Общества дикой природы
Раскрытие: Ничего не раскрывать.
Джонатан Эдлоу, доктор медицины Доцент кафедры неотложной медицины Гарвардской медицинской школы; Заместитель председателя отделения неотложной медицины, Медицинский центр Бет Исраэль Дьяконис
webmd.com»> Джонатан Эдлоу, доктор медицины, является членом следующих медицинских обществ: Американского колледжа врачей неотложной помощи и Общества академической неотложной медициныРаскрытие: Ничего не раскрывать.
Дирк М. Элстон, доктор медицины Директор, Академия дерматопатологии Акермана, Нью-Йорк,
Дирк М. Элстон, доктор медицины, является членом следующих медицинских обществ: Американская академия дерматологии
Раскрытие: Ничего не раскрывать.
Килборн Гордон III, доктор медицины, FACEP Врач неотложной помощи
Килборн Гордон III, доктор медицины, FACEP является членом следующих медицинских обществ: Американской академии офтальмологии и Общества дикой природы
webmd.com»> Раскрытие: Ничего не раскрывать.Марвин Харпер, доктор медицины Доцент педиатрии кафедры неотложной медицины и инфекционных заболеваний Гарвардской медицинской школы; Директор программы информатики, Детская больница Бостона
Раскрытие: Ничего не раскрывать.
Синди Р. Хеннен, RPh Помощник директора клинической фармацевтической практики, больница Froedtert, Медицинский колледж штата Висконсин
Раскрытие: Ничего не раскрывать.
Джон Марк Хиршон, доктор медицины, магистр здравоохранения Доцент кафедры неотложной медицины, Медицинский факультет Университета Мэриленда
Джон Марк Хиршон, доктор медицины, магистр здравоохранения является членом следующих медицинских обществ: Alpha Omega Alpha, Американской академии неотложной медицины, Американского колледжа врачей неотложной помощи, Американской ассоциации общественного здравоохранения и Общества академической неотложной медицины
webmd.com»> Раскрытие: Ничего не раскрывать.R Филип Кинкель, доктор медицины, FAAN Доцент неврологии Гарвардской медицинской школы; Директор Центра рассеянного склероза Медицинского центра Бет Исраэль Дьяконис; Консультант невролог, Детская больница Бостона
Раскрытие: Ничего не раскрывать.
Кристин М. Лор, доктор медицины, магистр медицины Профессор кафедры внутренней медицины Центра улучшения женского здоровья и отделения ревматологии, директор учебной программы ревматологии Медицинского колледжа Университета Кентукки
Кристин М. Лор, доктор медицины, магистр медицины, является членом следующих медицинских обществ: Американского колледжа врачей и Американского колледжа ревматологии
Раскрытие: Ничего не раскрывать.
Ларри И. Латвик, доктор медицины Профессор медицины, Медицинская школа Нижнего штата Нью-Йоркского государственного университета; Директор по инфекционным болезням, Служба по делам ветеранов, система здравоохранения Нью-Йоркской гавани, Бруклинский кампус
Ларри Лютвик, доктор медицины, является членом следующих медицинских обществ: Американского колледжа врачей и Общества инфекционных болезней Америки
Раскрытие: Ничего не раскрывать.
Tarun Madappa, MD, MPH Лечащий врач, отделение легочной медицины и реанимации, больница общего профиля Элкхарт
Tarun Madappa, MD, MPH является членом следующих медицинских обществ: Американского колледжа грудных врачей и Американского торакального общества
Раскрытие: Ничего не раскрывать.
Аугусто Миравалле, доктор медицинских наук , научный сотрудник отделения неврологии, Медицинский центр Бет Исраэль Дьяконисса, Гарвардская медицинская школа
Аугусто Миравалле, доктор медицины, является членом следующих медицинских обществ: Американская академия неврологии
Раскрытие: Ничего не раскрывать.
Кристен Мовад, доктор медицины Доцент, отделение дерматологии, Медицинский центр Гейзингер
Кристен Мовад, доктор медицинских наук, является членом следующих медицинских обществ: Alpha Omega Alpha, Американская академия дерматологии и Phi Beta Kappa
.
Раскрытие: Ничего не раскрывать.
Гэри Дж. Ноэль, доктор медицины Профессор кафедры педиатрии Медицинского колледжа Вейля Корнелла; Лечащий педиатр пресвитерианской больницы Нью-Йорка
Гэри Дж. Ноэль, доктор медицины, является членом следующих медицинских обществ: Общество педиатрических инфекционных болезней
Раскрытие: Ничего не раскрывать.
Венди Пельтье, доктор медицины Директор программы, доцент кафедры неврологии Медицинского колледжа Висконсина
Раскрытие: Ничего не раскрывать.
Джули Л. Пуотинен, PharmD Координатор клинических служб фармацевтических служб, Департамент фармации, клинический инструктор, Медицинский центр Святого Луки
Раскрытие: Ничего не раскрывать.
Карен Л. Роос, доктор медицины Джон и Нэнси Нельсон, профессор неврологии, профессор неврологической хирургии, кафедра неврологии, Медицинский факультет Университета Индианы
Карен Л. Роос, доктор медицины, является членом следующих медицинских обществ: Американской академии неврологии и Американской неврологической ассоциации
Раскрытие: Ничего не раскрывать.
Hampton Roy Sr, MD Доцент кафедры офтальмологии Медицинского университета Арканзаса
Хэмптон Рой-старший, доктор медицины, является членом следующих медицинских обществ: Американской академии офтальмологии, Американского колледжа хирургов и Панамериканской ассоциации офтальмологов
Раскрытие: Ничего не раскрывать.
Майкл Дж. Шнек, доктор медицины Доцент кафедры неврологии и нейрохирургии Медицинской школы Стрича Университета Лойолы; Заместитель директора программы лечения инсульта, директор программы интенсивной терапии неврологии, медицинский директор отделения неврологии отделения интенсивной терапии, Медицинский центр Университета Лойола
Майкл Дж. Шнек, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии неврологии, Американского общества нейровизуализации, Общества нейрокритической помощи и Совета по инсульту Американской кардиологической ассоциации
.
Раскрытие информации: Boehringer-Ingelheim Honoraria Выступление и обучение; Санофи / BMS Honoraria Выступление и обучение; Pfizer Honoraria Устная речь и обучение; UCB Pharma Honoraria Выступление и преподавание; Гонорар «Талекрис» за консультацию Другое; Медицинский грант NMT / исследовательские фонды Независимый подрядчик; NIH Независимый подрядчик; Грант Санофи / исследовательские фонды Независимый подрядчик; Грант Boehringer-Ingelheim / исследовательские фонды Независимый подрядчик; Гонорар Baxter Labs Консультации Консультации
Роберт А. Шварц, доктор медицины, магистр здравоохранения Профессор и руководитель дерматологии, профессор патологии, педиатрии, медицины, профилактической медицины и общественного здравоохранения Медицинского университета и стоматологии Нью-Джерси — Медицинская школа Нью-Джерси
Роберт А. Шварц, доктор медицины, магистр здравоохранения является членом следующих медицинских обществ: Alpha Omega Alpha, Американская академия дерматологии, Американский колледж врачей и Sigma Xi
.
Раскрытие: Ничего не раскрывать.
Ричард Х. Синерт, DO Профессор неотложной медицины, клинический доцент медицины, директор по исследованиям Медицинского колледжа Государственного университета Нью-Йорка; Консультанты, отделение неотложной медицины, госпиталь округа Кингс
Ричард Синерт, доктор медицинских наук, является членом следующих медицинских обществ: Американского колледжа врачей и Общества академической неотложной медицины
Раскрытие: Ничего не раскрывать.
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Medscape Salary Employment
Флориан П. Томас, MD, MA, PhD, Drmed Директор отделения травм спинного мозга, Медицинский центр по делам ветеранов Сент-Луиса; Директор Центра рассеянного склероза Национального общества рассеянного склероза; Директор Центра передового опыта ассоциации невропатологов, профессор кафедры неврологии и психиатрии, доцент Института молекулярной вирусологии и кафедры молекулярной микробиологии и иммунологии Медицинского факультета Университета Сент-Луиса
Флориан П. Томас, доктор медицины, магистр медицины, доктор философии, Drmed является членом следующих медицинских обществ: Американской академии неврологии, Американской неврологической ассоциации, Американского общества параплегии, Консорциума центров рассеянного склероза и Национального общества рассеянного склероза
Раскрытие: Ничего не раскрывать.
Ричард П. Винсон, доктор медицины Ассистент клинического профессора, кафедра дерматологии, Центр медицинских наук Техасского технологического университета, Медицинская школа Пола Л. Фостера; Консультант, Дерматология Маунтин-Вью, PA
Ричард П. Винсон, доктор медицины, является членом следующих медицинских обществ: Американской академии дерматологии, Ассоциации военных дерматологов, Техасского дерматологического общества и Техасской медицинской ассоциации
.
Раскрытие: Ничего не раскрывать.
R Кристофер Уолтон, доктор медицины Профессор, директор службы увеитов и глазных воспалительных заболеваний, кафедра офтальмологии, Медицинский колледж Университета Теннесси
R Кристофер Уолтон, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии офтальмологии, Американского колледжа руководителей здравоохранения, Американского общества увеитов, Ассоциации исследований в области зрения и офтальмологии и Общества сетчатки глаза
.
Раскрытие: Ничего не раскрывать.
Мэри Л. Виндл, PharmD Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие: Ничего не раскрывать.
Сара Л. Вингертер, доктор медицины Лечащий врач отделения неотложной медицины Детской больницы Св. Кристофера; Клинический доцент педиатрии (адъюнкт), Медицинский факультет Университета Темпл
Сара Л. Вингертер, доктор медицины, является членом следующих медицинских обществ: Американская академия педиатрии
Раскрытие: Ничего не раскрывать.
Suyung Wu, MD Консультант, отделение неврологии, клиника Elkhart
Суюнг Ву, доктор медицины, является членом следующих медицинских обществ: Американской академии неврологии и Американской академии медицины сна
Раскрытие: Ничего не раскрывать.
Влияние местных кортикостероидов и лидокаина на Borrelia burgdorferi sensu lato в коже мышей: потенциальное влияние на клинические испытания на людях
Животные и
Borrelia видов
Мышей C3H / HeN (самцов или самок) выращивали в Институте бактериологии . Были протестированы три различных вида Borrelia : B. burgdorferi ss , B. garinii и B. afzelii. Различные штаммы, принадлежащие к этим трем основным видам, были использованы для экспериментов по заражению: B. burgdorferi ss штамм N40D10 / E9-экспрессирующая люцифераза 20 , B. burgdorferi ss штамм N40 (выделенный от клеща) и штамм 297 ( выделен от пациента с нейроборрелиозом), штамм B. afzelii NE4049 (выделен от клеща) и IBS 106 (выделен от пациента с мигрирующей эритемой) и B.garinii штамм PBi (выделен от больного нейроборрелиозом). Эти штаммы культивировали в полной среде BSK-H (Sigma) при 33 ° C и пассировали ≤ 7 раз перед использованием их для инфекций мышей. Животных инфицировали внутрикожно в нижней части спины, как описано ранее 34 .
Действие лидокаина in vitro и in vivo на
B. afzelii NE4049
In vitro
Сначала мы протестировали влияние различных концентраций хлоргидрата лидокаина без консерванта (исходный раствор Aguettant 10 мг / мл; 5 мг / мл было наивысшая концентрация, затем двукратное разведение) in vitro на культуре B.afzelii NE4049. Гентамицин (100 мкг / мл в качестве максимальной концентрации, затем двукратное разведение) был включен в качестве положительного контроля. Спирохеты совместно инкубировали с различными лекарственными средствами в 96-луночном микротитровальном планшете в течение 24 часов, затем переносили в пробирку Эппендорфа с 1 мл полной среды BSK-H и инкубировали при 33 ° C в течение 7 дней. Наблюдение с помощью темнопольной микроскопии было выполнено для оценки формы, подвижности и плотности Borreliae в каждой лунке в дни 1 и 7.
In vivo
Мы также оценили эффект инъекции лидокаина на Borreliae , инфицированных кожа, через 7 дней после инокуляции Borrelia .Лидокаин (50 мкл раствора 10 мг / мл) вводили в место инокуляции бактерий; позволили анестетику диффундировать в течение 30 минут, а затем собрали образцы биопсии кожи. Одну часть непосредственно замораживали при -80 ° C для количественной ПЦР и протеомных исследований (день 0), а другую часть культивировали в течение 7 (день 7) и 14 дней. На 7-й день также были проведены количественная ПЦР и протеомный анализ для измерения влияния культуры на экспрессию белков Borrelia и их обнаружения.
Proteomics
Биопсии кожи мыши (15 мг) экстрагировали вручную 600 мкл буфера для образцов Лэммли в измельчителе тканей Potter на 1 мл (Berktree, Cary, NC).Белки (50 мкг) были разделены с помощью 12% SDS-PAGE 15 . Полоски геля (10 ± 1) размером 2 мм иссекали вручную. Предварительное расщепление, расщепление и анализы наножидкостной хроматографии, масс-спектрометрии / масс-спектрометрии (наноЖХ-МС / МС) проводили, как описано ранее 16 , один раз для каждого образца. Массовые данные, собранные во время нано-ЖХ-МС / МС, были преобразованы в файлы «.mgf» с помощью программного обеспечения MSConvert (Proteowizard, версия 3.0.6090) и интерпретированы с помощью Mascot (Matrix Science, версия 2.5.1). Поиск был выполнен в собственной базе данных белков, состоящей из Borrelia и последовательностей белков мыши, извлеченных из NCBInr и UniProtKB-SwissProt, соответственно. Для бактерий использовались четыре различные справочные базы данных в зависимости от проанализированных штаммов: B. burgorferi ss B31 (1758 записей на 7 мая 2013 г.), B. burgdorferi ss N40 (1480 записей на 30 января 2015 г.), B. afzelii PKo (2186 записей на 16 октября 2014 г.) и B.garinii (B. bavariensis) PBi (1720 записей на 30 августа 2013 г.). Результаты Mascot были независимо загружены в программное обеспечение Proline (Proline Studio Release, версия 1.6). Были рассмотрены все спектры, приводящие к идентификации, превышающей минимальный установленный порог (Mascot Ion Score> 25, длина пептида> 7 аминокислот, довольно ранг = 1). Полученные спектры затем фильтровали, чтобы получить уровень ложного обнаружения белка менее 1%.
Реактивация
Borrelia после распространения путем местного нанесения кортикостероидов
Реактивация in situ
Мышей C3H / HeN (в возрасте 3–4 недель) инфицировали различными видами и штаммами Borrelia посредством инокуляции иглой.Мышам внутрикожно в дорсальную грудную область инокулировали 10 3 спирохет, суспендированных в 100 мкл BSK-H. Через две-три недели после бактериальной инокуляции присутствие антител IgG, специфичных к Borrelia , в сыворотке мышей определяли с помощью ELISA (данные не показаны). Мышей умерщвляли путем смещения шейных позвонков и различных органов, и собирали кровь для культивирования Borrelia и / или количественной ПЦР. После распространения бактерий спирохеты реактивировались в коже мышей между 40 и 90 днями после инфицирования путем нанесения местного кортикостероида на место инокуляции (спина) или в отдаленное место (ухо) два раза в день в течение 2 дней.Нереактивированных инфицированных мышей использовали в качестве отрицательного контроля (отсутствие реактивации Borrelia ).
Сравнение реактивации
Borrelia после применения различных дермокортикоидов
Кортикостероиды для местного применения с различной противовоспалительной активностью 19 были протестированы in vivo: ~ 10 мг 0,05% клобетазола пропионата (очень высокая) или 0,1% дезонида (высокая ) или 0,1% бетаметазона валерата (высокий уровень) или 0,5% крем гидрокортизона наносили на одну минуту путем массажа на дорсальную часть грудной клетки B.afzelii NE4049-инфицированных мышей дважды в день в течение 2 дней. Количественная оценка и культура Borrelia с помощью кПЦР были выполнены на биоптатах кожи, собранных в месте нанесения крема.
Сравнение реактивации
B. afzelii in situ или в отдаленном месте
У мышей, инфицированных B. afzelii , сравнивали два сайта реактивации клобетазола: место инокуляции на спине и удаленное место, ухо . После эвтаназии разные органы собирали для обнаружения присутствия Borrelia с помощью посева и / или количественной ПЦР.
Реактивация
Borrelia burgdorferi ss N40-люциферазы в коже инфицированных мышей
Чтобы лучше измерить степень реактивации Borrelia в коже, мы провели эксперименты по визуализации с использованием Borrelia -люциферазы с использованием кодон-оптимизированной люциферазы, экспрессирующей штамм N40 D10 / E9 20 .
Визуализация in vitro
Для подтверждения экспрессии люциферазы в B. burgdorferi ss для визуализации in vivo первые 10 4 и 10 6 спирохет обрабатывали 50 мкл натриевой соли d-люциферина, разведенной в PBS. или в метаноле (10 или 50 мг / мл, Sigma-Aldricht) в пробирках Эппендорфа.Люминесценцию оценивали с помощью системы визуализации IVIS Lumina X5 (Perkin Elmer, Массачусетс, США) с экспозицией 5 мин. Это были те же настройки, которые использовались для экспериментов по визуализации in vivo (см. Ниже).
Визуализация in vivo
мышей C3H / HeN наблюдали в разные дни после инокуляции luc -экспрессирующих B. burgdorferi N40 (10 6 инъецированных спирохет: 3 мыши наблюдались на 7 день после заражения (7 день) и 2 мыши на 90-й день (90-й день) после заражения.Перед визуализацией на 90-й день на кожу мышей в течение 2 дней наносили местный кортикостероид. Каждое животное анестезировали в обогащенной кислородом индукционной камере 2% изофлураном, а затем внутрибрюшинно вводили 100 мкл d-люциферина в метаноле (XenoLight d-Luciferin, Perkin Elmer). Мышь устанавливали вентрально в камере системы IVIS Lumina X5 (Perkin Elmer). Анестезия поддерживалась в течение всего процесса визуализации, а температуру тела животного регулировали с помощью цифровой термостатической кровати, встроенной в систему IVIS.Серия люминесцентных изображений была получена в течение первых 40 мин после введения d-люциферина. Сбор и анализ данных выполняли с использованием программного обеспечения Living Image 4.5.5 (Perkin Elmer). Люминесценция выражалась в фотонах / с / см2 / ср и нормализовалась относительно времени визуализации, площади изображения и расстояния между источником света (то есть мышью) и камерой устройства с зарядовой связью.
После каждого сеанса визуализации мышей подвергали эвтаназии и культивировали B. burgdorferi инфицированную кожу (место инокуляции на спине), сердце, удаленную кожу (ухо) и сустав для получения живых спирохет и количественно оценивали с помощью ПЦР.
Реактивация in vitro по сравнению с реактивацией in vivo кортизоном
Кожа, инфицированная B. afzelii , была собрана примерно на 40 день, либо после двух дней местного применения клобетазола in vivo, либо путем добавления растворенного in vitro преднизолона (20 мг) к посев инфицированной кожи 35 . Контролем служило культивирование инфицированной кожи без реактивации. За культурой инфицированного кожного биоптата (6 мм) наблюдали в течение 11 и 19 дней с помощью микроскопии в темном поле, подсчитывали спирохеты и количественно определяли с помощью qPCR.
Культура и количественная ПЦР
B. burgdorferi sensu lato из органов или крови мыши
Мышей умерщвляли смещением шейных позвонков на 3-й день после местного лечения кортикостероидами. Площадь 1 см 2 кожных покровов грудного отдела грудной клетки, а также ухо, сердце и сустав были удалены для количественной ПЦР и посева. Также была взята кровь для культивирования in vitro. Для обнаружения B. burgdorferi sl в культуре различные органы мыши препарировали в асептических условиях. Собранные органы и кровь (3 капли) помещали в 6 мл полной среды BSK-H, содержащей 30 мкг рифампицина (BioRad).Пробирки с культурами инкубировали при 33 ° C и еженедельно проверяли на наличие спирохет с помощью микроскопии в темном поле, как описано ранее 34 . Для каждого органа и образца крови тканевые материалы были разделены на две части: первая часть была проверена на наличие живых спирохет после культивирования in vitro. Если после инкубации культура оставалась отрицательной, вторую часть тестировали на ДНК с помощью КПЦР. Для всех образцов кожи были выполнены посевы и / или количественная ПЦР.
Оценка нагрузки
Borrelia в коже мыши с помощью кПЦР
Образцы ткани мыши были протестированы на присутствие B.burgdorferi sl с использованием кПЦР, нацеленной на ген flaB , как описано ранее 36 . ДНК выделяли из кожи отдельных мышей на оборудовании MagNA Pure. Количественную оценку гена flaB , специфичного для B. burgdorferi , проводили в системе LightCycler (Roche Diagnostics). Количественную оценку специфичного для мыши гена gapdh проводили на приборе ABI Prism 7,500 (Applied Biosystem) с использованием коммерческого набора (контрольный реагент TaqMan GADPH для грызунов; Applied Biosystem).Количество спирохет B. burgdorferi sl в образцах тканей было стандартизовано на 10 4 мышей gapdh копий гена 11 .
Статистический анализ
Для различных кинетических анализов использовалось от 5 до 20 мышей для каждой временной точки протокола. Для протеомных анализов, для различных протоколов заражения, были привиты от 10 до 22 мышей. Мы выбрали образцы кожи мышей с наибольшим количественным определением ПЦР, чтобы максимально выявить белок.Данные были проанализированы с помощью R core team версии 3.6.3 (https://www.r-project.org/index.html) для вычисления среднего значения со стандартным отклонением (SD) и создания гистограмм. Группы сравнивали с помощью теста Манна – Уитни с поправкой Бенджамини Хохберга, когда выполнялось несколько тестов. Значимое значение p представлено следующим образом: «*» для p <0,05 и «**» для p <0,01.
Заявление об этике
Протоколы, выполненные в этом исследовании, были одобрены Региональным комитетом по исследованиям животных в Страсбурге (CREMEAS — Комитет по этике экспериментов на животных Страсбургского университета).Название этического заявления: / №. CREMEAS 2015062210282757 и APAFIS № 9317. Протоколы, применяемые на животных, соответствуют европейским руководящим принципам: «директива 2010/63 / EU» в помещениях для животных №: d67-482-34.
Эрлихиоз и анаплазмоз | DermNet NZ
Автор: Мари Хартли, штатный писатель, 2009 г. Обновлено Ванессой Нган, штатный писатель, февраль 2014 г.
Что такое эрлихиоз?
Эрлихиоз (также называемый моноцитарным эрлихиозом человека) — это инфекция лейкоцитов, вызываемая бактериями Ehrlichia chaffeensis и Ehrlichia ewingii.
Эрлихиоз встречается в некоторых частях США, Европы и Африки. Ежегодно в США регистрируется около 600 случаев эрлихиоза. Однако вполне вероятно, что фактическая заболеваемость намного выше, поскольку о многих случаях не сообщается, а многие другие могут протекать без симптомов и, следовательно, не диагностироваться.
Эрлихиоз передается при укусе инфицированного клеща; Amblyomma americanum (клещ одинокой звезды) является основным вектором клеща. Эрлихиоз чаще всего диагностируют с весны до осени.
Что такое анаплазмоз?
Исторически термин эрлихиоз также охватывал очень похожее клещевое заболевание, вызываемое бактериями, под названием Anaplasma phagocytophilum. Это заболевание ранее было известно как гранулоцитарный эрлихиоз человека (ГГЭ), а позднее как гранулоцитарный анаплазмоз человека (ГГЭ). Оба этих названия относятся к одному и тому же заболеванию, ныне известному как анаплазмоз.
Анаплазмоз встречается в некоторых частях Соединенных Штатов и Европы. Ежегодно в Соединенных Штатах регистрируется около 600-800 случаев анаплазмоза, но это также, вероятно, недооценка, поскольку некоторые люди не заболевают или испытывают только очень легкие симптомы и не обращаются за медицинской помощью.Клещи Ixodes являются основными переносчиками анаплазмоза.
Каковы клинические признаки эрлихиоза и анаплазмоза?
Многие люди с эрлихиозом и анаплазмозом могут не иметь симптомов или иметь только очень легкие симптомы.
Пациенты с симптомами могут испытывать лихорадку, усталость, озноб, сильные головные боли, боли в мышцах, тошноту, рвоту и потерю аппетита. Эти симптомы обычно появляются после 5–21-дневного инкубационного периода. Могут возникать отклонения в анализе крови, такие как низкий уровень лейкоцитов и низкий уровень тромбоцитов.
У пациентов с ослабленным иммунитетом эрлихиоз и анаплазмоз могут быть более тяжелыми.
Каковы кожные проявления эрлихиоза и анаплазмоза?
Эрлихиоз
Доля пациентов с эрлихиозом, у которых появляется кожная сыпь, колеблется от 20 до 88% случаев. Когда присутствует сыпь, она принимает различные формы. Он был описан как красный, петехиальный (маленькие красные или пурпурные пятна из-за кровотечения в кожу), макулярный (плоское изменение цвета) и папулезный (небольшие шишки).Реже поражения описываются как пузырчатые, узловатые (более крупные твердые образования), васкулитные, пурпурные, крапчатые, пятнистые, покрытые коркой или изъязвленные. У одного пациента может быть несколько типов поражений.
В тяжелых случаях широко распространенная сыпь и шелушение (шелушение кожи) могут соответствовать критериям синдрома токсического шока.
Сыпь появляется с 0 по 13 день болезни. Сыпь распространяется по всему телу по-разному, но ладони и подошвы поражаются редко.
Анаплазмоз
Кожные проявления анаплазмоза редки и встречаются только в 1–16% случаев. Поражения описаны как красные, плоские или выпуклые, пустулезные (пузыри, заполненные гноем) или папулезные. По сравнению с эрлихиозом поражения, связанные с анаплазмозом, чаще индивидуальны, локализованы и могут представлять собой поражения от укусов клещей.
Как ставится диагноз эрлихиоза и анаплазмоза?
Эрлихиоз и анаплазмоз диагностируются с помощью серологического тестирования и тестирования полимеразной цепной реакции (ПЦР) образцов крови:
- Серологические тесты обнаруживают наличие антител к Ehrlichia или A.phagocytophilum — предпочтительным тестом является непрямое тестирование иммунофлуоресцентных антител.
- ПЦР или полимеразная цепная реакция усиливает ДНК бактерий для обнаружения, но в настоящее время немногие лаборатории способны выполнить этот тест.
Как лечить эрлихиоз и анаплазмоз?
Антибиотик тетрациклинового ряда, обычно доксициклин, рекомендуется для лечения эрлихиоза и анаплазмоза. Хлорамфеникол можно назначать пациентам, которые не могут принимать тетрациклины.
Как предотвратить эрлихиоз и анаплазмоз?
- Избегайте таких мест, как леса или поля, где обитают клещи.
- Нанесите средство от насекомых DEET на кожу и перметрин на одежду.
- Носите одежду с длинными рукавами, плотно облегающую запястья, талию и лодыжки.
- Проверяйте дважды в день на наличие прикрепленных клещей и немедленно удаляйте их. Надев защитные перчатки, аккуратно возьмите клеща пинцетом как можно ближе к коже и медленно, осторожно вытащите его.
Под кожей: клещи Ixodes в подкожной клетчатке красных лисиц (Vulpes vulpes) из Германии | Паразиты и переносчики
Лисы являются важными хозяевами для различных эндо- и эктопаразитов и, следовательно, резервуарами патогенов животных и зоонозов [28]. Наблюдаемая распространенность подкожных клещей (88,1%) в настоящем исследовании выше, чем в Польше (38%) [20] и Чехии / Румынии (15,4%) [18]. Причем распространенность подкожных клещей выше по сравнению с распространенностью внешних клещей у рыжих лисиц из Италии (7.4%) [29] и Румынии (53,9%) [30], но совпадает с исследованиями из Испании (51,1–84,6%) [31,32,33] и Германии (76,5–82,6%) [7, 34]. Кроме того, интенсивность заражения подкожными клещами (среднее значение = 10,8) в настоящем исследовании аналогична показателям внешних клещей из другого исследования, в котором изучались 1268 лисиц в Германии (среднее значение = 11,7) [34]. В этом исследовании 50,9% лисиц были заражены максимум 5 клещами на внешней поверхности, в то время как в настоящем исследовании 43,2% лис были заражены максимум 5 клещами.Однако в некоторых случаях как подкожных, так и наружных клещей собирали несколько раз у нескольких лисиц (3,6–5,7%), причем на одну лисицу приходилось более 50 клещей [7].
В Европе известно несколько клещей из родов Ixodes , Dermacentor , Haemaphysalis , Hyalomma и Rhipicephalus , паразитирующих на рыжих лисицах [7, 8, 29, 31, 32]. В Германии обычно собирали I. ricinus , I. hexagonus , I. canisuga и I. kaiseri , тогда как D.reticulatus и H. concinna [7, 9]. Соответственно, мы обнаружили три из ранее упомянутых лонгиростральных видов ( I. ricinus , I. hexagonus и I. canisuga ) в подкожной клетчатке. Аналогичным образом, ранее опубликованные данные из США и Чехии / Румынии показывают региональные различия видов клещей в подкожной клетчатке в зависимости от преобладающей фауны клещей [18, 20, 21].
Longirostra (например, Amblyomma , Hyalomma и Ixodes ) более глубоко внедряется в кожу хозяина по сравнению с brevirostra (напр.грамм. Dermacentor , Haemaphysalis и Rhipicephalus ), которые прикрепляются более поверхностно [10, 11]. В текущем исследовании из подкожной клетчатки лисиц было собрано только клещей Ixodes . Эти данные согласуются с опубликованными записями о подкожных клещах, где клещей Ixodes преобладали над видами Dermacentor spp. которые встречались лишь изредка [18, 20]. Ранее обсуждалось, что глубокое внедрение (как у longirostra) благоприятно для подкожного расположения клещей [18].Наши результаты согласуются с этим предположением, поскольку лонгиростры значительно чаще обнаруживались подкожно, чем бревиростры.
Период питания иксодовых клещей зависит от стадии развития клеща и колеблется от нескольких дней (неполовозрелые) до двух недель (самки) [12]. D’Amico et al. [18] подчеркнули, что большая продолжительность кормления заставляет клещей обнаруживаться в подкожной клетчатке. В соответствии с этим, значительно больше самок было обнаружено подкожно (97.0%; P <0,0001) по сравнению с самцами и нимфами в текущем исследовании. Самцы I. ricinus питаются факультативно, принимают небольшие порции крови и остаются на хозяине в поисках самок для спаривания [1]. Факультативное кормление может объяснить, почему только два самца были обнаружены индивидуально в подкожной области. Не исключено, что совокупляющиеся самцы отделяются от самок в процессе деградации или подготовки клещей. Самец Ixodes может оставаться в спаривании в течение 6–11 дней в течение периода кормления самки Ixodes [35], что также может объяснить, почему I.ricinus пары спаривания обнаруживаются в подкожной клетчатке. Редкие находки нимф, но не личинок, могут быть связаны с их более короткой гипостомой. Кроме того, их отсутствие может объясняться более короткой продолжительностью кормления неполовозрелых клещей. До сих пор продолжительность и механизм, вызывающий подкожную локализацию клещей, неизвестны, но длительное время кормления самок, по-видимому, имеет решающее значение для проникновения.
В этом исследовании подкожные клещи обычно располагались в трех основных частях тела: ушах, подмышечной впадине и паховой области, что соответствует предыдущим исследованиям.Smith et al. [21] сообщили о подкожных клещах в паховой, подмышечной и перианальной областях, в то время как Drozdz [14] обнаружил клещей в подкожной области в области ушей, плеч и живота. Ни один из этих отчетов не содержит информации о частоте возникновения. Настоящее исследование выявило наиболее значимые зараженные части тела красных лисиц. Поразительно, но эти части тела менее волосатые, складчатые, а кожа тонкая. Это согласуется с Руководством ESCCAP по борьбе с эктопаразитами у собак и кошек, которое в целом обнаружило одинаковые предпочтения в отношении прикрепления клещей у собак и кошек [36].
До сих пор сообщалось о подкожном наличии клещей в основном у рыжих лисиц [13,14,15,16,17,18,19,20,21]. Сообщалось только об единичных случаях подкожных клещей у енотовидных собак и у одного домашнего питомца. собака существует в настоящее время [22, 23]. В ходе исследования 134 косуль из меха изнутри и снаружи были обнаружены только внешние клещи и ни одного клеща в подкожной клетчатке [37]. На данный момент об этом явлении известно мало, поэтому остаются вопросы о механизмах того, как клещи становятся подкожными и какие животные могут быть затронуты.
Гистологическое исследование показало, что качество воспалительной реакции связано со стадией деградации клеща. Все подкожные клещи были окружены гранулематозным панникулитом, эти данные согласуются с данными D’Amico et al. [18]. Когда экзоскелет не был поврежден, воспаление было слабым-умеренным. Но в случае сломанных экзоскелетов наблюдалась тяжелая воспалительная реакция. У одного хорошо сохранившегося клеща наблюдалось острое и местное механическое раздражение дермы и эпидермиса.Это может быть признаком того, что клещ недавно проник под кожу. Внутренняя часть неповрежденного экзоскелета клещей содержала смесь клеточного мусора, и клеточная структура не была распознана, что может объяснить, почему выделение ДНК не было успешным.
Для медицинских работников: болезнь Лайма
Найдите подробную информацию о болезни Лайма для медицинских работников.
На этой странице
Что необходимо знать специалистам здравоохранения о болезни Лайма
Болезнь Лайма — серьезное заболевание, вызываемое бактерией Borrelia burgdorferi.Бактерия представляет собой спирохету, передающуюся некоторыми видами клещей Ixodes. Он передается через укусы инфицированных черноногих и западных черноногих клещей.
Медицинским работникам рекомендуется углублять свои знания о болезни Лайма в Канаде. Это включает возможность:
- понять и определить признаки и симптомы
- назначают соответствующее лечение пациентам с диагностированным заболеванием
- сообщают о случаях заболевания людей по соответствующим каналам
Дополнительную информацию см. В национальном определении случая заболевания.
Подписаться на список рассылки
Клинические проявления
Симптомы иногда проявляются в перекрывающихся стадиях, например:
- Ранняя локализованная болезнь Лайма
- Ранняя диссеминированная болезнь Лайма
- Поздняя диссеминированная болезнь Лайма
Важно отметить, что у некоторых людей с болезнью Лайма симптомы могут отсутствовать или быть минимальными.У других могут наблюдаться более серьезные симптомы.
У некоторых людей симптомы могут проявляться только через несколько недель после первого укуса, как описано ниже в разделе «Ранняя локализованная стадия заболевания». В этом случае они могут не вспомнить укус клеща или связать болезнь с укусом. Поскольку черноногий клещ такой маленький и обычно безболезненный, некоторые люди могут даже не знать, что их укусил.
Медицинские работники должны быть осведомлены о клинических проявлениях и эпидемиологических факторах риска болезни Лайма.Рассматривайте болезнь Лайма как часть дифференциального диагноза у пациента с похожими симптомами и признаками.
Точная диагностика и немедленное лечение — ключевые факторы успешного лечения болезни Лайма.
Ранняя локализованная болезнь Лайма (менее 30 дней)
Ранняя локализованная болезнь Лайма обычно проявляется как острое заболевание, характеризующееся:
- лихорадка
- артралгии
- миалгии
- головная боль
- Наличие одиночного локализованного поражения кожи, известного как мигрирующая эритема (EM)
Не все пациенты будут обращаться с ЭМ.Следовательно, диагноз не должен основываться исключительно на наличии ЭМ.
Большинство пациентов поступают с ЭМ в течение 7 дней после укуса клеща. Однако инкубационный период может составлять от 3 до 30 дней.
Поражение кожи обычно представляет собой кольцевидное эритематозное поражение диаметром более 5 см, которое:
- медленно увеличивается в размере
- обычно безболезненен и не вызывает зуда
Поражение иногда имеет центральное просветление, но может быть более однородным эритематозным.У темнокожих пациентов сыпь может больше походить на синяк.
Вариации EM с большой вероятностью указывают на болезнь Лайма и могут принимать следующие формы:
- пузыри
- солидные очаги
- образования с коркой
- сине-пурпурных оттенков
- вид в яблочко
Поражение кожи, называемое мигрирующей эритемой, может перерасти в «яблочко» на месте укуса клеща.Здесь он изображен на плече пациента. Сноска 1
Типичным признаком ранней недиссеминированной болезни Лайма является расширяющаяся сыпь, называемая мигрирующей эритемой. Это может выглядеть как бычий глаз. Сноска 1
Некоторые поражения кожи при болезни Лайма имеют равномерно красный цвет и не проявляются при использовании классического кольца. Сноска 1
Некоторые пациенты обращаются с волдырями в центре, которые часто принимают за укус паука. Вероятно, это связано с воспалительной реакцией на возбудитель, вызванной клещом. Сноска 1
Некоторые поражения кожи, вызванные болезнью Лайма, имеют сине-фиолетовый цвет.Они отличаются от синяков, поскольку идеально однородный круг имеет резко очерченную границу. Сноска 1
Болезнь Лайма передается через кровь на другие части тела. Таким образом, укус может привести к множественным поражениям кожи различной формы. Сноска 1
У некоторых людей могут быть незначительные симптомы.Поэтому лучше не ставить диагноз, основываясь исключительно на наличии или отсутствии бычьей сыпи. При дифференциальной диагностике болезни учитывайте другие признаки и симптомы, в том числе:
- усталость
- артралгия
- головная боль
- субфебрильная температура
Ранняя диссеминированная болезнь Лайма (менее 3 месяцев)
При отсутствии лечения бактерия, вызывающая болезнь Лайма, может:
- распространяются через кровоток в другие участки тела
- вызывают повреждение тканей тела на этих участках
Симптомы могут включать:
- утомляемость и общая слабость
- кожные признаки (например, множественные ЭМ-поражения)
- сердечных проявлений:
- атриовентрикулярная блокада
- тахиаритмии
- миоперикардит
- дисфункция миокарда
- неврологических симптомов, таких как:
- асептический менингит
- радикулопатия
- энцефалопатия
- Черепная невропатия (особенно паралич лицевого нерва)
- Множественный мононеврит
- тонкие когнитивные трудности
- моторно-сенсорная радикулоневропатия
- другие редкие проявления, такие как:
- увеит
- кератит
- Конъюнктивит
- гепатит легкой степени
- спленомегалия
Поздняя болезнь Лайма (более 3 месяцев)
Если не лечить, болезнь Лайма на поздней стадии может длиться месяцы или даже годы.
Симптомы могут быть скелетно-мышечными, например:
- киста Бейкера
- хронический артрит
- асимметричный олигоартикулярный артрит (обычно поражает колени)
- Преходящий мигрирующий артрит и выпот в 1 или несколько суставов
При отсутствии лечения артрит может рецидивировать в тех же или разных суставах.
Симптомы также могут быть неврологическими, например:
- подострая энцефалопатия легкой степени, проявляющаяся:
- хроническая аксональная полинейропатия легкой степени, проявляющаяся как:
- дистальные парестезии
- корешковая боль (реже)
- энцефаломиелит (редко)
- лейкоэнцефалопатия (редко)
Симптоматическая инфекция сердца при болезни Лайма встречается редко.Однако в период с 2012 по 2013 год в США было зарегистрировано 3 внезапных сердечных смерти, связанных с Лайм-кардитом.
Симптомы после лечения
У некоторых людей, лечившихся от болезни Лайма, симптомы продолжают проявляться через месяцы или годы после лечения.
Это состояние известно как синдром болезни Лайма после лечения (PTLDS). Его симптомы следует контролировать и лечить соответствующим образом.
Диагноз
Диагноз болезни Лайма в первую очередь клинический, подтвержденный историей возможного контакта с клещами.
Не у всех пациентов разовьются заметные симптомы. Таким образом, важно:
Дополнительным диагностическим инструментом является обнаружение антител с помощью двухуровневого серологического метода, описанного ниже.
Однако пациенты с явными симптомами ранней локализованной болезни Лайма должны быть диагностированы и лечиться без лабораторного подтверждения.Это связано с тем, что на ранней стадии болезни Лайма возможны ложноотрицательные результаты.
Лабораторные испытания
Лабораторные исследования следует использовать только для дополнения клинических данных, а не в качестве основы для диагностики ранней болезни Лайма.
Двухуровневое серологическое тестирование
Двухуровневый подход к серологическому тестированию рекомендуется при тестировании крови пациента на антитела против бактерии, вызывающей болезнь Лайма.Этот подход одобрен для использования в Канаде и включает:
- скрининговый иммуноферментный анализ (EIA)
- подтверждающий тест иммуноблот (ИБ) (если ИФА положительный или сомнительный)
Критерии интерпретации для тестов EIA и IB стандартизированы, и доступны краткие сведения о диагностических подходах к болезни Лайма. Footnote 2 Footnote 3 Если требуется тестирование, укажите предполагаемую зону воздействия (например, Северная Америка или Европа) в заявке.Местоположение определит, какие тесты будут использоваться, поскольку тесты различаются в зависимости от вида Borrelia.
При подозрении на менингит Лайма может оказаться полезным тестирование в аккредитованной лаборатории на интратекальные антитела IgG или IgM.
Все диагностические лаборатории по всей Канаде имеют системы, признанные органами по аккредитации, например:
- Аккредитация лаборатории Онтарио
- Колледж американских патологов
- Международная организация по стандартизации
Это относится ко всем процедурам, проводимым в лаборатории, в том числе специально для серологических тестов на болезнь Лайма.
Эти лаборатории должны:
- участвовать во внешних проверках квалификации, чтобы гарантировать высокое качество результатов
- иметь лицензию федерального правительства на проведение серологических тестов на болезнь Лайма
Канадские руководства по лабораторной диагностике болезни Лайма соответствуют действующим международным стандартам. Они также соответствуют тем, которым следуют органы общественного здравоохранения в США и Европе. Специалисты общественного здравоохранения в этих странах опасаются, что некоторые частные коммерческие лаборатории могут не использовать:
- правильно утвержденные тесты
- рекомендуемые стандарты для интерпретации результатов тестов
Примечания к серологическим тестам
Пациентам с болезнью, длившейся более месяца, следует проводить только тестирование на IgG (не на IgM).Одного положительного теста на IgM недостаточно для диагностики текущего заболевания у этих пациентов.
Из-за стойкости антител положительный серологический тест не позволяет отличить активную инфекцию от перенесенной.
Серологические тесты:
- не следует проводить в качестве теста на излечение
- не может использоваться для измерения ответа на лечение
Тест EIA:
- имеет низкую специфичность
- может давать ложноположительные результаты при использовании в качестве автономного теста
- может перекрестно реагировать с антителами к комменсальным или патогенным спирохетам.
- могут быть некоторые вирусные инфекции (например, ветряная оспа и вирус Эпштейна-Барра) при определенных аутоиммунных заболеваниях (например, волчанка)
Лечение
Схемы лечения, перечисленные в таблице ниже, представляют собой рекомендации для локализованной (ранней) болезни Лайма.В зависимости от возраста пациента может потребоваться корректировка схем:
- возраст
- аллергия
- история болезни
- статус беременности
- основных состояния здоровья
Проконсультируйтесь со специалистом по инфекционным заболеваниям для получения последних рекомендаций по лечению или индивидуальных решений относительно лечения пациента.
| Возрастная категория | Наркотик | Дозировка | Максимум | Продолжительность в днях (диапазон) |
|---|---|---|---|---|
| Взрослые | Доксициклин | 100 мг, стр.о., каждые 12 ч | НЕТ | 14 (с 14 по 21) |
| Цефуроксим аксетил | 500 мг, перорально, каждые 12 ч | НЕТ | 14 (с 14 по 21) | |
| Амоксициллин | 500 мг, перорально, каждые 8 ч | НЕТ | 14 (с 14 по 21) | |
| Детский | Амоксициллин | 50 мг / кг в сутки перорально, разделенные на 3 приема | 500 мг на дозу | 14 (с 14 по 21) |
| Доксициклин | 4 мг / кг в сутки р.о., разделенных на 2 приема | 100 мг на дозу | 14 (с 14 по 21) | |
| Цефуроксим аксетил | 30 мг / кг в сутки перорально, разделенные на 2 приема | 500 мг на дозу | 14 (с 14 по 21) |
Важные рекомендации по лечению
Доксициклин противопоказан, и амоксициллин является препаратом выбора для:
- детей младше 8 лет
- беременные или кормящие женщины
Кроме того, некоторые пациенты могут не переносить препараты, перечисленные в таблице.В данном случае:
- можно использовать макролид из следующего списка, хотя он будет иметь более низкую эффективность
- азитромицин
- эритромицин
- кларитромицин
- пациентов, получающих макролиды, должны находиться под тщательным наблюдением, чтобы гарантировать исчезновение их симптомов
Крупные популяционные исследования беременных женщин с болезнью Лайма, получавших лечение, не показали повышенного риска неблагоприятных исходов.
Некоторые специалисты рекомендуют предлагать доксициклин в разовой дозе 200 мг людям с массой тела менее 45 кг.Альтернативой является предложение доксициклина в нескольких дозах от 4 мг / кг до максимальной дозы 200 мг. Это для людей в возрасте 8 лет и старше, укушенных в районе с гиперэндемической инфекцией.
Нет данных о применении амоксициллина в качестве альтернативного профилактического антибиотика у детей младшего возраста.
Стойкие симптомы после лечения
В большинстве случаев эффективно своевременное лечение по соответствующей схеме, описанной в таблице выше.Однако у некоторых пациентов с болезнью Лайма после лечения симптомы сохраняются. Продолжаются исследования причин и методов лечения.
Нет окончательных доказательств того, что стойкие симптомы представляют собой продолжающуюся инфекцию. Постинфекционное воспаление, вызванное повреждением инфекционным процессом, может реагировать на противовоспалительные препараты.
Профилактика
Профилактическое лечение может быть начато, если пациент соответствует всем из следующих 4 критериев.
- Клещ можно надежно идентифицировать как черноногий, и, по оценкам, он прикреплялся более 36 часов.
- Это основано на степени нагрубания или достоверности того, когда человек был укушен.
- Профилактика будет начата в течение 72 часов после удаления кормящегося клеща.
- Местный уровень заражения клещами Borrelia burgdorferi составляет более 20% (уточните в местном отделении здравоохранения).
- Доксициклин не противопоказан.
Если все вышеперечисленные критерии соблюдены, однократная доза 200 мг доксициклина может быть введена по адресу:
- взрослых
- детей старше 8 лет
Пациентам с массой тела менее 45 кг следует назначать его в дозе 4,0 мг / кг, максимальная доза — 200 мг.
Доксициклин не рекомендуется детям младше 8 лет и беременным женщинам.
Профилактика
В настоящее время вакцины против болезни Лайма для человека не существует.Лучший способ избежать болезни — защититься от укусов клещей. Посоветуйте своим пациентам использовать профилактические меры.
Эпиднадзор за болезнью Лайма в Канаде
Болезнь Лайма стала национальной болезнью, подлежащей уведомлению в декабре 2009 г.
Канада продолжает следить за изменяющимся географическим распределением и распространенностью инфицированных клещей и случаев болезни Лайма. Следовательно, вы должны сообщать о клинически диагностированных или лабораторно подтвержденных случаях в органы здравоохранения вашей провинции или территории.
Медицинские работники в Канаде играют решающую роль в выявлении и регистрации случаев болезни Лайма. См. Раздел о надзоре для получения дополнительной информации о надзоре в Канаде.
Дополнительную информацию см. В национальном определении случая.
Снятие и отправка тиков на тестирование
- идентифицировать клеща
- снять галочку с корпуса
- поставить галочку для идентификации и возможного тестирования
Для получения дополнительной информации
Коинфекция человека Borrelia burgdorferi и Babesia microti в Соединенных Штатах
Borrelia burgdorferi , возбудитель болезни Лайма, и Babesia microti , возбудитель бабезиоза, все чаще становятся причиной растущего бремени клещевых болезней. на северо-востоке США.Эти патогены передаются через укус инфицированного клеща-переносчика, Ixodes scapularis , который способен укрывать и заражать хозяина несколькими патогенами одновременно. Клиническая картина заболеваний неоднородна и варьируется от легких гриппоподобных симптомов до почти смертельной сердечной аритмии. Хотя причина вариабельности неизвестна, существует вероятность того, что сопутствующее инфицирование как B. burgdorferi , так и B. microti может синергетически увеличивать тяжесть заболевания.Стремясь прояснить текущее состояние понимания коинфекции B. burgdorferi и B. microti , в этом обзоре мы обсуждаем географическое распространение и патогенез болезни Лайма и бабезиоза в Соединенных Штатах, иммунологический ответ от человека к инфекции B. burgdorferi или B. microti , существующим знаниям о патологии коинфекционного заболевания и критическим факторам, которые привели к неоднозначности в литературе относительно коинфекции, чтобы исключить путаницу при планировании будущих экспериментов и исследованиях.
1. Введение
Заболевания, передаваемые клещами, которые поражают как людей, так и других животных, растут в Соединенных Штатах, поскольку некогда необитаемая дикая природа продолжает урбанизироваться, что способствует увеличению заражения и передачи инфекции людям. Клещевые заболевания могут быть результатом нескольких типов патогенов, включая бактерии, вирусы и простейшие, и большинство инфекций являются следствием укуса инфицированного клеща. Дальнейшее усложнение диагностики и лечения этого семейства возникающих заболеваний заключается в том, что клещи могут содержать несколько патогенов и заражать людей несколькими паразитами.Двумя наиболее распространенными клещевыми заболеваниями в Соединенных Штатах являются болезнь Лайма, заболевание, вызываемое бактерией Borrelia burgdorferi , и бабезиоз, заболевание, возникшее в результате инфицирования Babesia microti . Эти два патогена встречаются в пересекающихся географических районах США и используют одного и того же переносчика-хозяина Ixodes scapularis . В литературе существует значительная путаница в отношении влияния коинфекции с B. burgdorferi и B.microti показывает тяжесть заболевания и прогноз. Чтобы прояснить, что понимается в отношении сопутствующей инфекции, в этой статье мы рассматриваем географическое распространение и патогенез болезни Лайма и бабезиоза в Соединенных Штатах, иммунологический ответ человека на B. burgdorferi или B. microti инфекции, существующие знания о патологии коинфекционных заболеваний и критические факторы, которые привели к неоднозначности в литературе относительно коинфекции.Более четкое понимание того, что в настоящее время известно в литературе, поможет направить будущие исследовательские усилия, а также улучшить клиническую диагностику и лечение.
2. Болезнь Лайма и бабезиоз
Болезнь Лайма, заболевание, вызываемое бактерией Borrelia burgdorferi , передается человеку через укус Ixodes scapularis , также известный под общим названием оленьи клещи или черноногие клещи. В 1993 году было доказано, что Ixodes dammini принадлежат к тому же виду, что и I.scapularis . Хотя использование названия I. scapularis является предпочтительным, I. dammini все еще иногда используется [1]. Для целей данного обзора название I. dammini будет заменено на I. scapularis , чтобы исключить путаницу. Кроме того, на западе США западный черноногий клещ Ixodes pacificus ответственен за передачу B. burgdorferi человеку [2]. Текущее географическое распространение I.scapularis в США в основном находится в северо-восточных, юго-восточных и среднезападных штатах (рис. 1).
Согласно данным Центра по контролю и профилактике заболеваний, болезнь Лайма, которая в настоящее время считается наиболее часто диагностируемым заболеванием, передаваемым клещами в Соединенных Штатах, только в 2013 году поразила более 25 000 человек [3]. Общее количество подтвержденных случаев варьировалось от минимума 11 700 в 1995 году до максимума 29 959 в 2009 году. Болезнь Лайма вызывается инфекцией спирохетной бактерией B.burgdorferi и первоначально вызывает сыпь на месте укуса инфекционного клеща, за которой следуют гриппоподобные симптомы, включая лихорадку, озноб, усталость, головную боль и общее недомогание на срок до месяца. Во время и после этого периода могут возникать мышечные боли, а также неврологические и сердечные патологии. В небольшом проценте случаев возникают тяжелые осложнения, такие как паралич лицевого нерва и опасная сердечная аритмия. Наконец, после нескольких месяцев заражения в суставах начинают проявляться симптомы, похожие на симптомы ревматоидного артрита.Обзор клинических данных показывает, что инфицирование B. burgdorferi следует часто непредсказуемому прогрессированию заболевания, вызывая только легкие симптомы у одних в течение длительного периода времени или вызывая быстрое начало потенциально смертельных эффектов у других. Естественно, это наблюдение приводит к вопросу о том, какие факторы могут влиять на переменное и непредсказуемое прогрессирование болезни Лайма у почти четверти миллиона пациентов, инфицированных в Соединенных Штатах каждый год [4].
В США I.scapularis — наиболее известный переносчик Babesia microti , естественного паразита грызунов [5]. Бабезиоз передается при укусе инфицированного клеща, а в некоторых редких случаях при переливании крови или врожденным путем, когда спорозоиты попадают в кровоток хозяина в результате укуса инфицированного клеща. После введения спорозоиты инфицируют эритроциты, воспроизводятся и образуют мерозоиты, которые затем способны прорезываться из инфицированных эритроцитов и инфицировать другие.Продолжение этого цикла очень быстро дает большую популяцию внутриэритроцитов [5]. Инфекция B. microti имитирует легкую форму малярии, основные симптомы которой связаны с гемолитической анемией. Действительно, инфекции B. microti часто даже диагностируются как малярия из-за похожего внешнего вида инфицированных эритроцитов, которые можно увидеть в мазке крови. В то время как бабезиоз может быть фатальным для людей с ослабленным иммунитетом или спленэктомии, здоровые люди выздоравливают после инфекции B.microti спонтанно, требуя лишь временного лечения симптомов [5].
Болезнь Лайма и бабезиоз человека чаще всего диагностируются в пересекающихся географических регионах (Рисунки 2 (a) и 2 (b)). Было обнаружено, что бабезиоз наиболее распространен на северо-востоке США, а также на верхнем среднем западе и диагностируется в районах с особенно высокой плотностью населения на северо-востоке, в Нью-Джерси, Нью-Йорке, Миннесоте и Висконсине [6]. Примечательно, что все эти штаты также входят в число тех, в которых ежегодно регистрируется наибольшее количество случаев болезни Лайма.В 2011 году 96% случаев болезни Лайма были зарегистрированы в 13 штатах: Коннектикут, Делавэр, Мэн, Мэриленд, Массачусетс, Миннесота, Нью-Гэмпшир, Нью-Джерси, Нью-Йорк, Пенсильвания, Вермонт, Вирджиния и Висконсин [7]. Географическое совпадение между возникновением болезни Лайма и бабезиоза предполагает, что эти две болезни, обе передаются вектором I. scapularis , могут одновременно инфицировать население в определенной географической области.
Клинические данные, подтверждающие идею о том, что коинфекция может быть возможной и более распространенной, чем первоначально предполагалось, включают, во-первых, наблюдение, что оба патогена обычно обнаруживаются у грызунов, пойманных в эндемичных районах; во-вторых, представление о том, что пациенты, у которых диагностирована болезнь Лайма, также часто оказываются серопозитивными в отношении антител против гениталий; и в-третьих, тот факт, что I.scapularis может передавать оба патогена одновременно [8–10]. В исследовании популяций грызунов в Prudence and Patience, Род-Айленд, тот факт, что более 50% отловленных Peromyscus leucopus и Microtus pennsylvanicus содержали как B. microti , так и B. burgdorferi , предполагает, что отдельные личинки I. scapularis глотает и передает оба патогена [11]. Другое исследование подтвердило, что грызуны и клещи-переносчики часто заражаются одновременно.В исследовании образцов клещей, отобранных в Нью-Джерси, из положительных на B. burgdorferi , B. microti или возбудитель гранулоцитарного эрлихиоза человека, 20% клещей были инфицированы как минимум двумя патогенами [12]. Также известно, что нимфы I. scapularis , инфицированные как B. burgdorferi , так и B. microti , способны одновременно передавать оба организма хомякам [13]. Наблюдение, что оба патогена часто проживают вместе в популяциях грызунов и клещах-переносчиках I.scapularis , безусловно, вызывает подозрение, что коинфекция у человека-хозяина возможна [14–16]. Множественные исследования по измерению титров человеческих антител действительно предоставляют некоторые доказательства того, что коинфекция действительно имеет место. К ним относится недавнее исследование, которое показало, что до 66% жителей Лонг-Айленда, штат Нью-Йорк, у которых была диагностирована болезнь Лайма, также были серопозитивными к антителам против B. microti [17, 18]. Напротив, в исследовании, в котором у пациентов впервые был диагностирован бабезиоз, 54% также обладали антителами IgG и IgM к B.burgdorferi [19]. Хотя простое присутствие антител к B. microti или B. burgdorferi никоим образом не гарантирует, что обе инфекции были переданы от одного и того же клеща, это вызывает интересные предположения относительно того, как временные вариации в приобретении бабезиоза и болезни Лайма, будь то от одного и того же клеща или в течение короткого периода времени от разных клещей, может повлиять на клиническое прогрессирование коинфекции.
Хотя точно установлено, что как B.microti и B. burgdorferi , безусловно, заражают хозяев-грызунов и клещей-переносчиков, клещевые переносчики способны передавать оба патогена одновременно, и что большой процент пациентов, страдающих болезнью Лайма или бабезиозом, также подвергался воздействию B. microti . или B. burgdorferi , соответственно, мало исследований было проведено в отношении патофизиологических эффектов сопутствующей инфекции. Ссылаясь на наблюдения мышей, у которых бабезиальная инфекция, по-видимому, усиливает миокардит при болезни Лайма, было высказано предположение, что коинфекция увеличивает тяжесть заболевания и может нарушить механизмы защиты хозяина [20].Есть данные, подтверждающие эту гипотезу, поскольку пациенты с коинфекцией сообщают о более длительной продолжительности болезни и обострении симптомов, включая миалгию, утомляемость, потливость, анорексию, мигрирующую эритему и конъюнктивит [17, 18]. В одном случае коинфекции даже наступила смерть от панкардита [21]. Однако в других исследованиях сообщается, что коинфекция , а не не ухудшает долгосрочный исход пациентов, страдающих инфекцией обоими патогенами, особенно в отношении распространенности конституциональных, скелетно-мышечных или неврологических симптомов [22].
Очевидно, хотя было установлено, что и B. microti , и B. burgdorferi могут сосуществовать в одном организме, инфицировать один и тот же переносчик, одновременно инфицировать млекопитающее-хозяина и вызывать ослабляющие симптомы, разногласия по-прежнему существенны и отсутствуют исследования синергетического или, возможно, только аддитивного эффекта сопутствующей инфекции. В то время как дебаты продолжаются, заболеваемость клещевыми инфекциями быстро растет из-за множества факторов, таких как более крупная популяция оленей, рост популяций клещей и более активное развитие лесных и сельских районов, приносящих людей, оленей и клещей даже ближе близость.Поскольку клещевые инфекции становятся все более распространенными в Соединенных Штатах и во всем мире, жизненно важна необходимость исследований клинических проявлений, иммунологического ответа, патофизиологического механизма и надлежащего лечения коинфекции с клещевыми патогенами.
3. Иммунологический ответ на
B. burgdorferi
Клетки врожденной иммунной системы составляют первую линию защиты от B. burgdorferi . Широко принятый механизм заключается в том, что модифицированные липидами мембранные белки и диацилглицерин-содержащие гликолипиды передают сигнал спирохет через гетеродимеры CD14 и / или Toll-подобного рецептора 2 (TLR2) / TLR1, чтобы способствовать провоспалительному ответу во время инфекции [23, 24].Хемокиновый рецептор CXCR2 также играет роль в генерации вызванного B. burgdorferi воспаления [25]. В частности, липопротеины и гликолипиды B. burgdorferi активируют иммунную систему путем связывания с TLR, в частности с TLR2, что приводит к цитокинам IL-6, IL-10, IL-12, TNF- α и IL-1. β высвобождается из клеток врожденной иммунной системы [26]. Эти цитокины служат связующим звеном между врожденной и адаптивной иммунными системами, влияя на реакцию и поляризацию опосредованного клетками-хозяевами и гуморального иммунного ответа против B.Бургдорфери . Впоследствии, когда Т-хелперы активируются, они дифференцируются в комбинацию Th2, Th3, Th27 или Т-регуляторных клеток, что приводит к поляризованному иммунному ответу. У разных людей могут развиваться иммунные ответы с разной поляризацией, и исследователи предположили, что поляризация клеточно-опосредованного иммунного ответа может влиять на общий исход инфекции B. burgdorferi . Хотя это и не исключение, адаптивная иммунная система борется с внутриклеточными патогенами посредством сильного ответа Th2, характеризующегося повышенной продукцией IFN-γ , в то время как сильный ответ Th3, жизненно важный для защиты хозяина от внеклеточных патогенов, характеризуется повышением уровня IL- 4 производства [26].
В конце 1990-х годов два исследования показали, что IFN- γ преобладает по сравнению с IL-4 во время инфекции B. burgdorferi . В одном исследовании исследователи отметили снижение синтеза ИЛ-4 и увеличение синтеза ИФН- γ у пациентов, инфицированных B. burgdorferi , по сравнению с контрольной группой [27]. Увеличение IFN- γ , наблюдаемое у этих пациентов, было результатом индуцированной поляризации Th2, способствующей усилению патогенеза бактерий и потенциальных аутоиммунных реакций.Во втором отчете Экерфельта и его коллег были обнаружены аналогичные результаты у взрослого населения, пораженного нервной инфекцией, вызванной B. burgdorferi . В этой популяции людей, страдающих нейроборрелиозом, продукция IFN-γ была значительно увеличена, в то время как продукция IL-4 была необычно низкой [28]. Эти два основополагающих исследования показывают, что у взрослых (особенно с тяжелым течением инфекции) сильная Th2-поляризация клеточно-опосредованного адаптивного иммунного ответа характерна для B.burgdorferi инфекция.
Наблюдаемый цитокиновый ответ на B. burgdorferi , по-видимому, также имеет временную изменчивость. У лиц с нехроническим нейроборрелиозом наблюдается начальное повышение уровня INF- γ с последующим увеличением IL-4, что соответствует клиренсу патогена, в то время как у лиц с хроническим нейроборрелиозом не наблюдается начальный ответ на IFN- γ . повышением уровня IL-4, предполагающим стойкий ответ Th2 [29].Интересно, что и генетика, и возраст хозяина могут влиять на эту временную поляризацию иммунитета; дети особенно предрасположены к выработке высокоэффективного сбалансированного ответа Th2 / Th3, тогда как взрослые с большей вероятностью будут генерировать в основном ответ Th2 [30]. Кроме того, сильный генетический компонент, участвующий в дифференциальной иммунной поляризационной реакции на B. burgdorferi , был отмечен у различных линий лабораторных мышей, которые проявляют разную восприимчивость к B.burgdorferi [31].
Одной из наиболее важных характеристик спирохеты B. burgdorferi является ее способность избегать иммунного обнаружения, часто в течение многих лет, избегая системы комплемента хозяина. Система комплемента — одна из наиболее универсальных частей иммунной системы, и ее активация приводит к фагоцитозу патогенов-мишеней или образованию комплексов мембранной атаки (МАК) [32]. В некоторых случаях регуляторные факторы комплемента хозяина рекрутируются патогенами, чтобы защитить их от MAC.Например, B. burgdorferi привлекает фактор H белков комплемента хозяина (FH) и фактор H-подобный протеин-1 (FHL-1) на свою собственную поверхность, эффективно препятствуя атаке комплемента хозяина на спирохеты. Два различных боррелиальных белка из семейства CRASP, приобретающих регулятор комплемента, были идентифицированы как лиганды для FH и FHL-1 [33, 34]. Экспрессия CRASP прямо коррелирует с сывороточной резистентностью, поскольку все сывороточно-резистентные изоляты экспрессируют эти белки, тогда как все сывороточно-чувствительные изоляты, проанализированные на сегодняшний день, не обладают белками с такой связывающей активностью [35, 36].Недавно опубликованные исследования рекомбинантного белка внешней поверхности OspE предполагают, что он также действует как лиганд для фактора H [37]. Эксперименты показали, что вмешательство в эти поверхностные белки, особенно OspE, может снизить выживаемость спирохет, что делает OspE хорошей терапевтической мишенью [38].
Недавно было обнаружено, что если спирохет B. burgdorferi вводили хозяину с помощью шприца, а не укуса инфицированного клеща, воспалительная реакция в коже хозяина изменялась.При инъекции с помощью шприца без связанных векторных слюны и молекул слюны спирохеты вызывали воспалительную реакцию, характеризующуюся повышенным продуцированием TNF- α и индукцией CRAMP, мышиного кателицидина (антимикробного пептида). В качестве альтернативы, когда мышей инокулировали B. burgdorferi через укус инфицированного клеща, воспалительный ответ был значительно снижен [39]. Такие результаты иллюстрируют важность естественной инфекции-переносчика и жизненно важную роль, которую играет слюна-переносчик в возникновении болезни Лайма.Первоначальное размножение спирохет в ткани кожи, по-видимому, происходит до распространения спирохет по всему телу, что позволяет предположить, что, если иммунитет в коже может быть улучшен или восстановлен посредством блокады иммуномодулирующих и иммуносупрессивных пептидов слюны, прогрессирование заболевания можно будет замедлить или предотвратить. Эта идея дополнительно обсуждается в разделе «Стратегии естественной и искусственной прививки».
Наконец, гуморальный иммунный ответ также жизненно важен для защиты хозяина от пагубных последствий стойкой инфекции.Эксперименты на различных моделях мышей показали, что как Т-клеточно-зависимые, так и независимые от Т-клеток механизмы способствуют активации В-клеток и гуморального иммунитета против B. burgdorferi . Когда мышам с тяжелым комбинированным иммунодефицитом (SCID) вводили сыворотку от иммунокомпетентных мышей, инфицированных B. burgdorferi , мыши SCID были защищены от заболевания даже при использовании высоких доз спирохет. Напротив, у мышей SCID, у которых инфекция уже была установлена, инъекция иммунокомпетентных сывороток мышей приводила к разрешению артрита Лайма, но не кардита, что указывает на то, что гуморальный ответ защищает от определенных аспектов B.burgdorferi , клеточные и Т-клеточные ответы жизненно важны для полного разрешения инфекции во всех органах [40].
4. Иммунологический ответ на
B. microti
Внутриэритроцитарный паразит B. microti обладает подробным жизненным циклом, в котором задействовано несколько хозяев. В природе для выживания паразита необходимы и грызун, и клещ-хозяин. Грызуну-хозяину, чаще всего белоногой мыши Peromyscus leucopus , спорозоиты вводятся от укуса инфицированного клеща, обычно I.scapularis , и инфицируют эритроциты мыши, где они либо воспроизводятся бесполым путем, либо подвергаются гаметогонии с образованием жизнеспособных гамет ([5] и ссылки в нем). Затем эти гаметы повторно вводятся окончательному хозяину, клещу из рода Ixodes , во время последующего приема пищи кровью. У окончательного хозяина гаметы соединяются, образуя оокинету, которая мигрирует в слюнные железы и подвергается спорогонии с образованием новых спорозоитов. В естественном жизненном цикле B. microti эти спорозоиты снова будут введены грызуну во время процесса поедания клещевой крови.Однако, если инфицированный клещ вместо этого ищет свою кровь у человека, спорозоиты попадают в организм человека-хозяина. Люди также могут искусственно заражать других посредством донорства и переливания крови, поскольку этот паразит большую часть своего жизненного цикла находится внутри эритроцитов. Бабезиоз, хотя и не является основным механизмом заражения, является наиболее распространенной инфекцией, передаваемой при переливании крови, с 1980 г. зарегистрировано 162 случая [41–43].
Иммунологический ответ человека-хозяина против B.microti отражает его продуманный жизненный цикл. В организме человека-хозяина инфицирование B. microti происходит в три фазы: установление, прогрессирование и разрешение [44]. Во время фазы установления инфекции спорозоиты, введенные укусом инфицированного клеща, свободны в плазме. Именно в это время антитела IgG ранее подвергшегося воздействию хозяина связываются со спорозоитами и способствуют их разрушению [44]. Как только спорозоиты проникают в эритроциты и устанавливают эритроцитарную фазу инфекции, врожденная иммунная система контролирует популяции паразитов во время так называемой стадии прогрессирования.Макрофаги, продуцирующие TNF- α , активные формы кислорода и оксид азота, а также естественные клетки-киллеры, продуцирующие IFN- γ , вносят вклад в врожденный иммунный ответ, хотя их механизм действия до сих пор неизвестен [44]. Продукция IL-12 макрофагами и естественными клетками-киллерами также жизненно важна для защиты хозяина на стадии прогрессирования, поскольку мыши, у которых отсутствуют как макрофаги, так и естественные клетки-киллеры, необычно восприимчивы к высокому уровню паразитемии после B.microti [45]. Цитокином, наиболее важным для борьбы с паразитемией и разрешения инфекции, на самом деле может быть IFN- γ . IFN- γ продуцируется не только клетками врожденного иммунитета и эффекторными Т-клетками на стадиях прогрессирования и разрешения инфекции B. microti . Экспериментальные исследования также показали, что IFN- γ жизненно важен для создания защитных иммунитет. В 1999 году Игараши и др. обнаружили, что мыши с дефицитом IFN- γ были полностью неспособны вызывать какой-либо значительный защитный иммунный ответ против B.microti , тогда как блокада IL-2, IL-4 и TNF- α моноклональными антителами не изменяла иммунный ответ [46]. Наконец, селезенка также помогает в процессе борьбы с паразитами, поскольку помогает очищать поврежденные и инфицированные эритроциты посредством фагоцитоза макрофагов.
Примерно через десять дней после инфицирования B. microti количество паразитов обычно уменьшается и начинается фаза разрешения, характеризующаяся активацией Т-клеток, продуцирующих CD4 + , IFN- γ [44].Роль Т-хелперов в защите против B. microti хорошо известна [47]. Гуморальный ответ на B. microti происходит на стадии разрешения и приводит к продукции антител, специфичных к поверхностным антигенам мерозоитов в плазме. E / S антигены инфицированных эритроцитов помогают уменьшить паразитемию в крови и защитить от инфекции в будущем. Генерация специфичных к паразитам IgG также важна для предотвращения репликации паразитов на стадии разрешения B.microti [48]. В частности, гуморальный ответ на острую инфекцию характеризуется продуцированием IgM с последующим продуцированием IgG, и иммунологическая память, вызванная этим ответом, может предотвратить или уменьшить продолжительность и тяжесть будущих инфекций [44].
На основании присутствия IL-2 и IFN-γ на протяжении инфекции B. microti в моделях мышей, вероятно, что на начальных стадиях инфицирования, установления и прогрессирования преобладает ответ Th2.IL-2 и IFN-γ присутствуют примерно через неделю после заражения и достигают пика примерно на 12 день во время стадии прогрессирования [49]. Цитокины Th3, IL-4 и IL-10, повышаются примерно через 2 недели после заражения и достигают пика через три недели после заражения во время стадии выздоровления [49]. Таким образом, на ранних стадиях инфекции ответ Th2, вероятно, необходим для начального контроля роста популяции паразитов, тогда как ответ Th3 преобладает на стадии разрешения инфекции, чтобы удалить из организма стареющих и поврежденных паразитов.Эту гипотезу поддерживает наблюдение, что неспособность генерировать и поддерживать сильный ответ Th2 на начальных стадиях инфицирования B. microti приводит к резкому увеличению скорости репликации паразитов [48]. Эти результаты могут быть экстраполированы на человеческие популяции, поскольку исследователи подробно охарактеризовали течение бабезиальной инфекции у человека. Еще в 1977 году было показано, что у людей наблюдалась слегка задержанная реакция на B. microti с появлением симптомов в течение двух недель [50].
5. Иммунологический ответ на коинфекцию
B. burgdorferi и B. microti
В то время как существует ограниченное количество исследований ответа хозяина на сопутствующую инфекцию клещевой бактерией B. burgdorferi и паразитом B. • microti , было высказано предположение, что коинфекция может приводить к измененному или подавленному иммунному ответу, когда присутствуют оба патогена. В поддержку этого Vinasco et al. наблюдали, что у коинфицированных мышей BALB / c и C3H количество макрофагов селезенки резко снижается, нарушая разрушение и клиренс паразитированных эритроцитов [51].Таким образом, такой нарушенный иммунный ответ хозяина может привести к усилению патогенеза и даже к развитию хронической инфекции, как предполагается в литературе [18, 52].
Для дальнейшего изучения этого будет проведен обзор четырех ключевых исследований, опубликованных с целью сделать окончательные выводы относительно иммунологических, патологических и физиологических эффектов, возникающих в результате коинфекции B. burgdorferi и B. microti (Таблица 1 ). Те факторы, которые привели к неопределенности в литературе относительно коинфекции, будут обсуждаться, включая вариации экспериментальной модели (люди по сравнению с мышами), стратегии инокуляции, штамма патогена и количественных показателей.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Степень тяжести симптомов оценивалась по самоотчету пациента. Степень тяжести симптома оценивается клиническим экзаменом с использованием критериев, установленных Совместным экзаменом Глоссария Американского колледжа ревматологии. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
6. Расхождения в экспериментальном дизайне
6.1. Человеческие субъекты и мышиные модели
Большая часть путаницы в литературе относительно коинфекции является прямым результатом очень больших различий в дизайне экспериментов, в частности, эпидемиологических исследований, проведенных на естественно инфицированных людях, по сравнению с исследованиями на мышах, подвергшихся искусственному заражению. В целом исследования на людях ставят множество проблем, одна из которых — выявление большой группы пациентов с острыми сопутствующими инфекциями.В то время как Krause et al. смогли найти 26 человек с признаками острой коинфекции, в исследовании Wang et al. было идентифицировано только 4 человека с острой коинфекцией [18, 22]. Эти небольшие размеры выборки ограничивают статистическую мощность полученных данных и в конечном итоге приводят к сомнительной точности исследований. Кроме того, большое разнообразие неконтролируемых, искажающих переменные в клинических исследованиях на людях, например изменчивость субъектов в отношении истории болезни, еще больше снижает точность и надежность результатов, полученных в результате таких исследований.Эпидемиологический анализ на людях представляет собой два из четырех основных исследований, которые предоставляют информацию о сопутствующей инфекции B. burgdorferi и B. microti . Однако выводы этих исследований противоречивы. Krause et al. обнаружили, что коинфекция с B. burgdorferi и B. microti приводит к увеличению патологической тяжести, в то время как Wang et al. определили, что коинфекция не повлияла на исход болезни или симптомов.
В то время как вышеупомянутые исследования расходятся во мнениях относительно патологического исхода коинфекции у людей, инфекции у людей, подвергшихся спленэктомии, позволяют предположить, что исходы заболевания действительно синергичны. Инфекция B. microti сама по себе обычно является самоограничивающимся заболеванием у здоровых, иммунокомпетентных людей, но у людей, подвергшихся спленэктомии, наблюдается характерная тяжелая патология с потенциально фатальными результатами. В тематическом исследовании 2008 года сообщалось, что у мужчины среднего возраста, прошедшего спленэктомию, были диагностированы как B.microti и B. burgdorferi проявили симптомы нейроборрелиоза всего через две недели после первоначального диагноза бабезиоза и не ответили на несколько антибиотиков. Двойная инфекция и связанные с ней симптомы разрешились только после полной заместительной трансфузии с внутривенным введением IgG (ВВИГ). Однако даже через пять лет у пациента все еще наблюдалась легкая сенсорная нейропатия в ногах [53].
Несмотря на то, что исследования с использованием моделей мышей позволили сформировать более крупные выборки, контролировать популяцию выборки для предыдущего воздействия патогенов и иммунологического анамнеза, регулировать время и механизм воздействия патогенов и стандартизировать измерения результатов, эти исследования, к сожалению, также дали противоречивые результаты. результаты относительно иммунологического и патофизиологического эффекта коинфекции.Некоторые объяснения продолжающегося несоответствия в литературе заключаются в том, что одни, разные линии мышей могут демонстрировать очень разные ответы на B. burgdorferi ; во-вторых, использованные стратегии искусственной инокуляции устранили важную переменную в действии молекул слюны клещей; и, наконец, хотя мышиные модели чрезвычайно важны в биомедицинских исследованиях, актуальность нечеловеческих моделей в сложных иммунных ответах на множественные патогены не ясна. Два исследования с использованием моделей на мышах, чтобы выяснить, усугублялась ли патология при наличии острой коинфекции с B.microti и B. burgdorferi дали противоречивые результаты [54, 55].
Некоторые противоречия между этими исследованиями можно объяснить физиологическими различиями в линиях мышей (таблица 2). Например, известно, что штамм мышей C3H чрезвычайно чувствителен к артриту, индуцированному Лаймом. В этом штамме тяжесть артрита не меняется у мышей с коинфекцией по сравнению с мышами, инфицированными отдельно B. burgdorferi , и, более того, масса селезенки также не изменилась [55].Однако коинфекция у мышей BALB / c, штамм, гораздо менее восприимчивый к артриту, связанному с Лаймом, действительно проявляется усилением артрита и снижением уровней IL-10 и IL-13 через месяц после заражения, что позволяет предположить, что дополнительное заражение B. воспалительный ответ Th2, ответственный за обострение артрита [54]. Отсутствие статистически значимого увеличения артрита у мышей C3H, вероятно, связано с тем фактом, что единичное инфицирование только одним B. burgdorferi уже вызывает преувеличенный ответ Th2, возможно, из-за генетических и иммуновоспалительных факторов, уникальных для мышей C3H; таким образом маскируется любое обострение из-за коинфекции.Интересно, что обе линии мышей демонстрировали одинаковый кардит как при одиночном, так и при одновременном заражении. Следует отметить, что в этих исследованиях использовались два разных субштамма мышей C3H, C3H / HeN и C3H / HeJ, что также могло привести к вариабельности экспериментальных результатов. Существует генетически обусловленное различие между двумя субштаммами в их ответе на бактериальный эндотоксин, который связан с белком Toll-подобного рецептора 4; в результате мыши C3H / HeN чувствительны к эндотоксинам, тогда как мыши C3H / HeJ устойчивы к эндотоксинам [56].
| ||||||||||||||
| Субштаммы мыши HeJ и HeN использовались в различных исследованиях.Разница между двумя субштаммами заключается в том, что штамм HeN чувствителен к эндотоксинам (нормальный ответ LPS), а штамм HeJ устойчив к эндотоксинам. | ||||||||||||||
6.2. Естественные и искусственные стратегии инокуляции
Помимо различий в экспериментальной модели, разные стратегии инокуляции привели к разным результатам в литературе относительно коинфекции B. burgdorferi и B. microti . Недавно было обнаружено, что слюна членистоногих содержит множество белковых факторов, которые повышают способность патогена вызывать первоначальную инфекцию в организме хозяина [57].Во многих случаях, например, в случае Plasmodium , оказывается, что слюна членистоногих полностью необходима для естественного заражения. Этот эффект может объяснить, почему для установления инфекции в лаборатории необходимы чрезвычайно большие дозы B. burgdorferi и B. microti .
В частности, было показано, что белки слюны I. scapularis обладают уникальными иммунорегуляторными эффектами, которые способствуют выживанию патогенов Rickettsia и B.burgdorferi не только за счет создания более благоприятной микросреды в месте инъекции, но и за счет непосредственной помощи в уклонении от иммунитета и выживании патогенов. Факторы слюны I. scapularis помогают формированию Rickettsia путем подавления воспалительных цитокинов и помогают B. burgdorferi уклоняться от антител хозяина за счет продукции Salp15, белка слюны [58–60]. Другой белок слюны, TSLPI (ингибитор лектинового пути слюны клещей), улучшает B.burgdorferi путем блокирования каскада лектинового комплемента, что приводит к нарушению фагоцитоза нейтрофилов, хемотаксиса и снижению лизиса патогенов [61]. Белок слюны Salp25, антиоксидант, снижает концентрацию АФК, присутствующих на границе раздела вектор-патоген-хозяин, за счет своего детоксицирующего действия, таким образом повышая шансы B. burgdorferi на выживание и успешное инфицирование. Salp25, Salp15, TSLPI и другие белки слюны членистоногих, которые еще предстоит выяснить, вероятно, играют жизненно важную роль в установлении начальной инфекции среди млекопитающих-хозяев.В результате своего действия во время первого контакта иммунной системы хозяина с патогеном, эти белки могут также вызывать долгосрочные иммуномодулирующие эффекты за счет изменения картины поляризации. Следовательно, отсутствие слюны членистоногих в исследованиях с использованием моделей на мышах, вероятно, объясняет некоторые несоответствующие результаты по сравнению с клиническими исследованиями.
Помимо отсутствия белков слюны, еще одна проблема с искусственной инокуляцией моделей мышей заключается в том, что пути инъекции анатомически не синонимичны пути естественного воздействия.В большинстве случаев мышам делают внутрибрюшинные, внутривенные или внутримышечные инъекции патогена, в то время как естественная инфекция может происходить в дерме или подкожной клетчатке. Изменение начального участка воздействия патогена-хозяина может привести к неожиданным изменениям иммунной поляризации и ответа, поскольку хорошо известны различия в иммунных ответах кожи и слизистых оболочек. В обоих исследованиях на мышах, обсуждаемых в этом обзоре, мышам внутрикожно вводили спирохет B. burgdorferi , таким образом приближаясь к картине естественной трансмиссивной инфекции; однако в обоих экспериментах B.microti паразитов вводили внутрибрюшинно.
6.3. Штамм патогена
Еще одним смешивающим элементом в исследованиях коинфекции B. burgdorferi и B. microti является использование различных штаммов патогена. В целом, в экспериментах использовались два разных штамма B. microti , один выделен из штамма P. leucopus , адаптирован к росту у лабораторных мышей и поддерживался пассажем крови у мышей C3H / HeN [55], и второй штамм, MN1, который был выделен от пациента-человека, инокулирован золотым сирийским хомякам для адаптации и затем подвергнут криоконсервации, а не поддержанию путем повторного взятия крови [62].Консервированная кровь впоследствии была восстановлена у хомяков для амплификации; кровь для исследований собирали, когда достигалась 80% паразитемии. Было высказано предположение, что штамм, адаптированный из P. leucopus , мог быть аттенуирован в результате повторного прохождения крови, таким образом давая разные результаты после заражения. B. burgdorferi Штамм N40 использовался во всех исследованиях, рассмотренных в этом обзоре.
6.4. Количественные измерения
Для оценки иммунологического прогрессирования и патологии коинфекции B.burgdorferi и B. microti из нескольких исследований, важно, чтобы сравнивались аналогичные показатели и результаты. Некоторые из наиболее часто измеряемых иммунопатологических исходов инфекции — это вариации уровня цитокинов, тяжести артрита и уровней патогенов в периферической крови. Однако отсутствие последовательности и стандартизации в оценке порождает противоречия в литературе. В таблице 3 сравниваются методы, использованные в четырех основных исследованиях коинфекции.Только одно исследование оценивало любые изменения уровня цитокинов, в то время как все исследования выполняли различные уровни гистопатологии и серологии.
| |||||||||||||||||||||||||||
В эпидемиологических исследованиях на людях патология определялась либо по самоотчету пациента, либо по сообщенным пациентом симптомам в сочетании с клиническим обследованием [18, 22].В то время как клиническое обследование, использованное Wang et al. было стандартизировано на основе критериев совместного экзамена Глоссария Американского колледжа ревматологии, это исследование не оценивало все параметры заболевания, то есть артрит, неврологические изменения и инфекционный статус. В целом Краузе и др. сообщили, что у лиц с коинфекцией было немного меньше артралгии, 27%, по сравнению с индивидуально инфицированной болезнью Лайма или бабезиозом, 36% и 40%, соответственно, хотя спленомегалия, конъюнктивит и множественная мигрирующая эритема были значительно выше у лиц с коинфекцией [18 ].Это исследование также подтвердило коинфекцию B. burgdorferi и B. microti по присутствию ДНК спирохет в образцах крови. ДНК спирохет чаще выявлялась у лиц с коинфекцией (27%) по сравнению с теми, кто инфицирован только B. burgdorferi (6%). Более того, ДНК спирохет также обнаруживалась в течение более длительного периода времени у коинфицированных индивидуумов по сравнению с индивидуально инфицированными, среднее значение = 91 день против 12 дней, соответственно. Wang et al. использовали только наличие антител либо к B.burgdorferi или B. microti в сочетании с острым клиническим диагнозом болезни Лайма или бабезиоза для подтверждения коинфекции. При таком подходе, вероятно, недооценивается количество пациентов с коинфекцией в настоящее время или ранее, поскольку прошлую коинфекцию невозможно подтвердить с уверенностью. Кроме того, на основе проведенных серологических анализов невозможно определить, существовала ли когда-либо фактическая одновременная коинфекция или воздействие происходило отдельно в разные моменты времени, возможно, даже с разницей в годы.Таким образом, большая часть данных, представленных Wang et al. нельзя толковать относительно вопроса об усилении тяжести заболевания. Однако у четырех пациентов, у которых, несомненно, была выявлена острая коинфекция как B. burgdorferi , так и B. microti на момент исследования, симптомы заболевания действительно длились дольше и были более серьезными, что даже привело к необходимости внутривенного лечения и в большинстве случаев длительная госпитализация [22].
К сожалению, исследования на мышах не дали более последовательных количественных результатов коинфекции [54, 55].В то время как артрит у мышей оценивается в зависимости от степени тяжести путем количественной оценки инфильтрации лейкоцитов, существуют вариации в шкале, которые находятся в диапазоне 0–3 по сравнению с 0–4. Такие вариации не только затрудняют объективное сравнение результатов, но также затрудняют воспроизведение и проверку результатов. Помимо использования различных шкал тяжести, временная оценка не согласуется между исследованиями. Моро и др. оценили тяжесть артрита через 15 и 30 дней, в то время как Coleman et al.использовал исключительно 21-дневную временную точку. Кроме того, Моро и др. также количественно определяли уровни цитокинов IL-4, IL-10, IL-13 и IFN-γ на протяжении всего инфекционного процесса, в то время как Coleman et al. измеряли только дисперсию веса селезенки, что затрудняло сравнение с их результатами. Ясно, что необходимы дополнительные исследования с использованием широкого спектра линий мышей, чтобы определить степень, в которой коинфекция преувеличивает патологию заболевания, прежде чем можно будет достичь консенсуса.
7.Выводы
В целом, из этого обзора очевидно, что в литературе до сих пор существует много путаницы в отношении патогенеза и иммунологического ответа на коинфекцию с B. burgdorferi и B. microti , в основном из-за несоответствий в дизайне экспериментов и вариабельности субъектов. . Несомненно, большое значение имеет использование естественно инфицированных людей в эпидемиологических исследованиях. В то время как мышиные модели предлагают больший контроль над потенциально смешивающими переменными, иммунный ответ мыши, особенно в случае сложной коинфекции, вероятно, будет сильно отличаться от такового у людей, что затрудняет сравнение.Однако противоречивые результаты, полученные в эпидемиологических исследованиях на людях, не могут быть разрешены до тех пор, пока показатели исходов для артрита, кардита, неврологических проявлений и иммунологических детерминант не будут стандартизированы в исследованиях. Эпидемиологические исследования на людях, рассмотренные в этой работе, были проведены более десяти лет назад, и с тех пор были достигнуты значительные технологические достижения, которые теперь могут улучшить как идентификацию и набор участников исследования, так и диагностическое тестирование и надежность.Если в будущих исследованиях будут стандартизированы параметры оценки, будут использоваться беспристрастные и объективные измерения, то есть количественная оценка цитокинов, и будут включены более крупные выборки, вполне вероятно, что можно будет сделать окончательный вывод относительно сопутствующей инфекции.
Понимание результатов коинфекции становится все более важным, поскольку болезнь Лайма и другие клещевые заболевания растут. Во время основополагающего исследования Краузе коинфекции с B. burgdorferi и B.microti , бабезиоз оказался основным подозреваемым в коинфекции. Однако с тех пор было обнаружено, что I. scapularis передает не только B. burgdorferi и B. microti , но также Anaplasma phagocytophilum , бактерию, ответственную за анаплазмоз, заболевание, которое стало регистрироваться на национальном уровне. в 1999 г. [58]. Следует отметить, что до таксономических изменений в 2001 г., которые идентифицировали A. phagocytophilum как принадлежащие к роду Anaplasma , эта бактерия в течение многих лет называлась Ehrlichia equi или Ehrlichia phagocytophilum , а Заболевание, вызываемое этой бактерией, часто называли гранулоцитарным эрлихиозом человека (ГГЭ) [63].Заболеваемость анаплазмозом неуклонно растет с 1994 г. и встречается в том же географическом районе, что и болезнь Лайма и бабезиоз.
Коинфекция B. burgdorferi и A. phagocytophilum , как было обнаружено, вызывает повышенное распространение спирохет у экспериментально инфицированных мышей C3H, что приводит к увеличению количества спирохет в тканях уха, сердца и кожи [64]. Коинфекция приводит к увеличению генерации матриксных металлопротеиназ (ММП) и повышенной проницаемости микрососудов головного мозга, что увеличивает способность спирохет легче преодолевать нарушенный барьер [65].Однако в 2013 году Horowitz et al. предположили, что коинфекция не увеличивает тяжесть симптомов заболевания [66]. Кроме того, в последние годы озабоченность по поводу коинфекции бактерией B. miyamotoi , возбудителя клещевого возвратного тифа, еще больше подтолкнула к исследованию области коинфекции [67, 68]. Наконец, за последнее десятилетие возросла не только озабоченность по поводу сопутствующего анаплазмоза, болезни Лайма, клещевого возвратного тифа и бабезиоза, но и страх перед клещевыми вирусами, такими как вирус Повассан или POWV.

 Для этой формы демодекоза характерно легкое течение практически без осложнений. У щенков и молодых собак в возрасте до 2 лет поражаются отдельные участки кожи, которые зудят и шелушатся. Почти всегда симптомы проходят быстро — важно пресекать попытки расчесов и обеспечить питание с достаточным количеством белка.
Для этой формы демодекоза характерно легкое течение практически без осложнений. У щенков и молодых собак в возрасте до 2 лет поражаются отдельные участки кожи, которые зудят и шелушатся. Почти всегда симптомы проходят быстро — важно пресекать попытки расчесов и обеспечить питание с достаточным количеством белка.

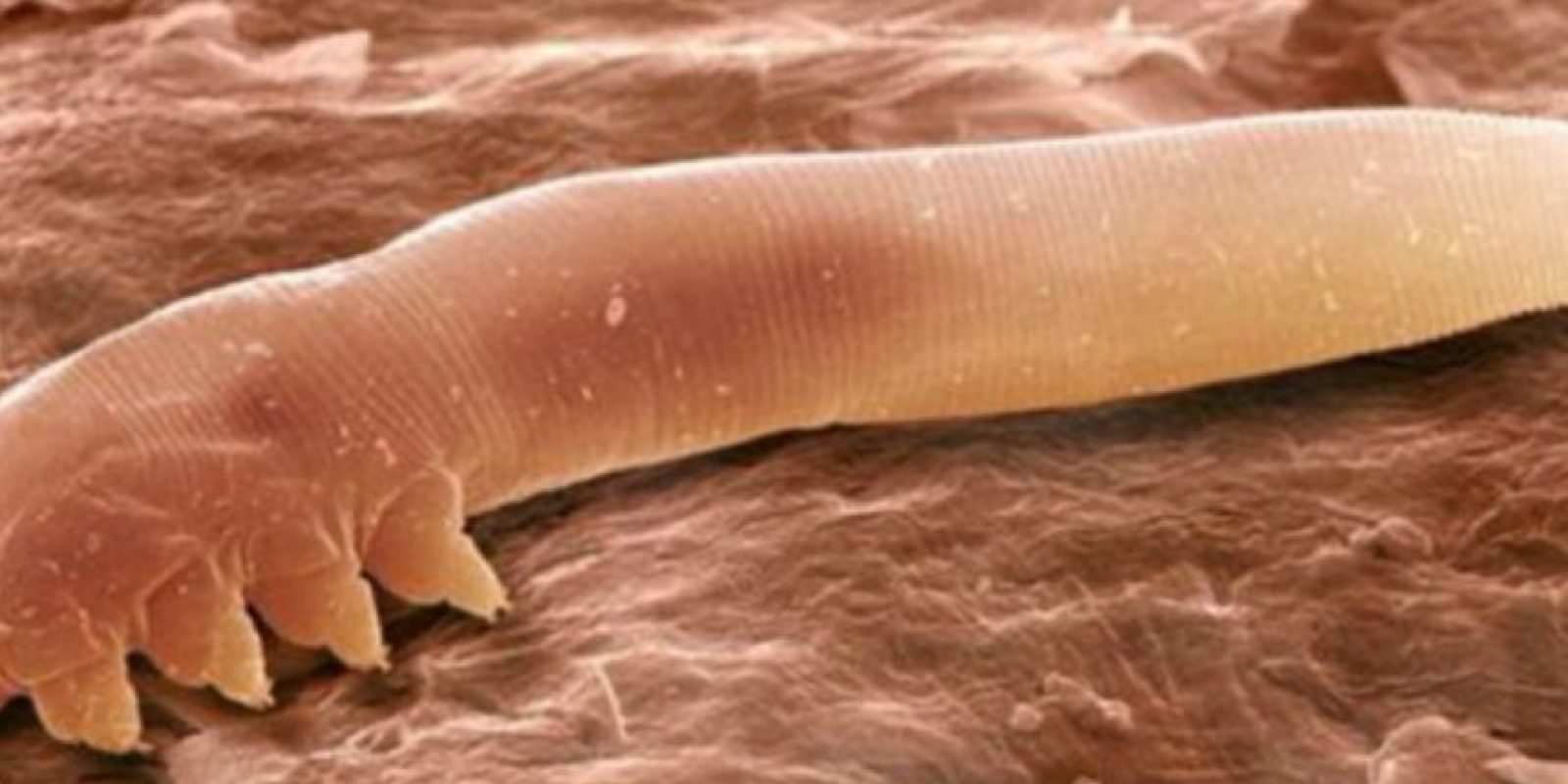 Способ приготовления такой же, как и с соцветиями липы. Отвар процеживается, после чего на его основе делают компрессы по несколько раз в день. При этом нужно чередовать холодные и горячие компрессы.
Способ приготовления такой же, как и с соцветиями липы. Отвар процеживается, после чего на его основе делают компрессы по несколько раз в день. При этом нужно чередовать холодные и горячие компрессы. В основу рациона должны входить кисломолочные продукты, свежие овощи и фрукты. От курения и от употребления алкоголя придется отказаться.
В основу рациона должны входить кисломолочные продукты, свежие овощи и фрукты. От курения и от употребления алкоголя придется отказаться.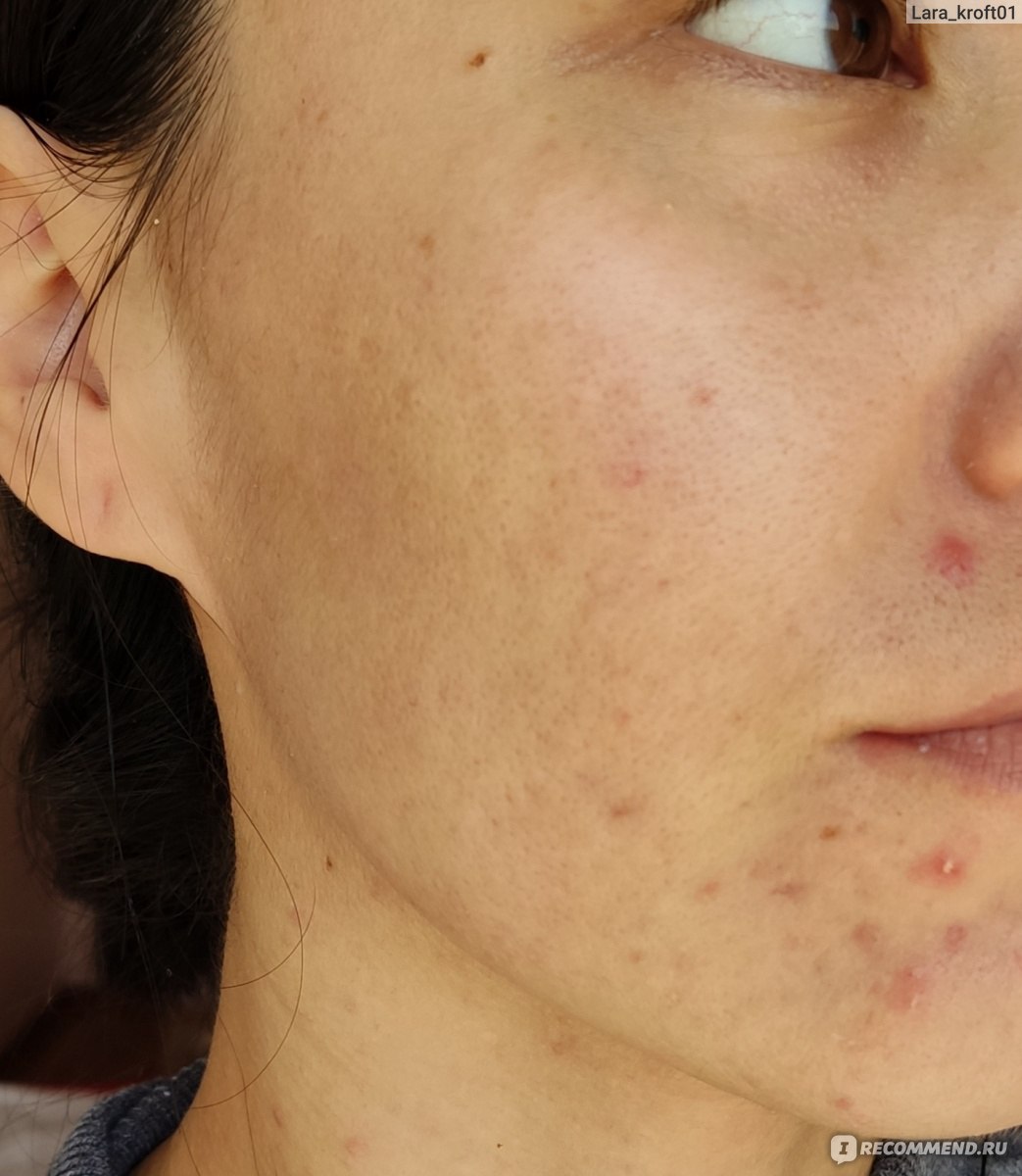 В зависимости от преобладающего типа сыпи, может быть: чешуйчатая, папулезная, пустулезная или смешанная форма. Очень важно своевременно оказать медицинскую помощь.
В зависимости от преобладающего типа сыпи, может быть: чешуйчатая, папулезная, пустулезная или смешанная форма. Очень важно своевременно оказать медицинскую помощь. Это заболевание (демодекоз) паразитарного характера, которое провоцирует подкожный клещ.
Это заболевание (демодекоз) паразитарного характера, которое провоцирует подкожный клещ.

