Операция на перегородку: Искривление перегородки носа
Искривление перегородки носа: нужна ли операция?
Носовая перегородка обеспечивает разделение воздуха, который вдыхается человеком на две равных части, поэтому воздушный поток равномерно согревает, увлажняет и очищает ткани дыхательной системы.
Если перегородка искривлена, нарушается воздухообмен, развиваются аллергия и воспалительные процессы в дыхательных путях, наблюдается дисбаланс в работе многих систем и органов.
Что называют носовой перегородкой?
Структура, которая делит полость внутри носа на два равнозначных отдела, называется перегородкой. У маленьких детей она состоит только из хрящей, которые постепенно окостеневают. Примерно в 10 лет у ребенка уже формируется носовая перегородка из костной и хрящевой ткани.
Причины искривления носовой перегородки
Специалисты выделяют следующие причины искривления перегородки носа:
Физиологические
К искривленной перегородке носа могут привести нарушения в развитии черепа и врожденные аномалии. Нормальное развитие костно-хрящевой структуры в таких случаях практически невозможно.
Нормальное развитие костно-хрящевой структуры в таких случаях практически невозможно.
Компенсаторные
Перегородка искривляется из-за различных новообразований в носу (опухоли, полипы, гипертрофия).
Травматические
Разнообразные травмы способствуют появлению искривления в перегородке. Особенно часто деформация наблюдается при переломах носа.
Симптоматика искривленной носовой перегородки
Патология характеризуется следующими симптомами:
- дыхание заметно нарушается;
- слизистая носа сухая;
- болевые ощущения затрагивают нос и лицо;
- слизистые выделения;
- частые кровотечения;
- постоянные неприятные ощущения в носу;
- пазухи регулярно воспаляются.
Кроме того, больной восприимчив к вирусным заболеваниям, поражающим дыхательные пути, тяжело дышит во сне, храпит, быстро утомляется и склонен к депрессии.
Искривленная носовая перегородка у ребенка
У детей с деформацией перегородки наблюдается неровное дыхание, постоянный насморк и кровотечения, которые происходят неожиданно. Дети, имеющие патологию, часто болеют респираторными инфекционными заболеваниями с осложнениями в виде гайморита или фронтита.
Дети, имеющие патологию, часто болеют респираторными инфекционными заболеваниями с осложнениями в виде гайморита или фронтита.
Также, деформация может привести к развитию заболеваний, поражающих слуховые трубы, риниту вазомоторного типа, бронхиальной астме. Кроме того, в мозг ребенка плохо поступает кислород, что характеризуется головными болями, плохим самочувствием и настроением, снижением внимания.
К чему приводит искривление носовой перегородки
Выравнивание носовой перегородки необходимо провести как можно быстрее, ведь патология сопровождается хроническими простудными болезнями, затрагивающими все отделы дыхательной системы, нарушениями в работе сердечно-сосудистой системы, снижением общего иммунитета, дисфункцией различных органов и систем организма. Лечат патологию с помощью септопластики – это хирургическая операция, в ходе которой изменяется форма носовой перегородки.
В каких случаях назначают операцию по выравниванию носовой перегородки
У подавляющего большинства людей можно диагностировать деформацию носовой перегородки. В случае небольшого дефекта, который не имеет негативного влияния на здоровье, врачебное вмешательство не требуется. Но, если искривление подрывает здоровье, ЛОР врачи рекомендуют сделать операцию как можно раньше, чтобы патология не вызвала различных осложнений.
В случае небольшого дефекта, который не имеет негативного влияния на здоровье, врачебное вмешательство не требуется. Но, если искривление подрывает здоровье, ЛОР врачи рекомендуют сделать операцию как можно раньше, чтобы патология не вызвала различных осложнений.
Оперативное вмешательство назначается при: постоянно обостряющихся синуситах, хронической отечности слизистой, других ЛОР заболеваниях, а также пациентам, страдающим от зуда или сухости в носу, головных болей и болевых ощущений, которые локализуются в области носа и лица.
▶ Септопластика Киев, цены ➡️ Операция по исправлению носовой перегородки в МЦ ADONIS
Искривление носовой перегородки является довольно распространенным явлением. Многие люди живут с этой проблемой годами и даже не подозревают о ее наличии. А она может существенно испортить самочувствие и значительно снизить качество жизни.
Частые риносинуситы, храп, потерю обоняния может спровоцировать именно искривление перегородки носа.
Такая деформация бывает как врожденная, так и приобретенная вследствие травмы или же появления полипов в носовой полости.
Чтобы исправить этот дефект, в ADONIS проводится операция по выравниванию перегородки.
Здесь есть высококвалифицированные лор-хирурги, а также все необходимое новейшее оборудование для проведения оперативного вмешательства.
На операцию на носовой перегородке цену можно посмотреть на сайте.
Септопластика – что это такое?
Септопластика – это оперативное вмешательство, цель которого выровнять носовую перегородку и переместить ее в нужное положение в полости носа.
Септопластика позволяет раскрыть просветы носа для восстановления нормального дыхания. Иногда септопластика носа может стать частью ринопластики: сначала выравниваются внутренние дефекты, затем – изменяются внешние недочеты.
Диагностика перед септопластикой
Прежде чем принимать решение об оперативном вмешательстве, нужно пройти комплексную диагностику.
На приеме врач-оториноларинголог соберет анамнез, проведет беседу, на основании которой определит необходимость дополнительных инструментальных исследований (КТ, рентген, эндоскопическое обследование).
Диагностика искривления носовой перегородки в клинике подразумевает:
- эндоскопическое обследование;
- риноскопию;
- компьютерную томографию черепа.
Своевременная диагностика позволяет выявить проблему на ранней стадии, тем самым избежав осложнений.
Есть проблемы с носовым дыханием – обращайтесь за консультацией к лору в клинику ADONIS.
Не откладывайте решение проблемы на потом – записывайтесь прямо сейчас.
Виды септопластики
Сегодня есть много различных методик проведения операций по исправлению носовой перегородки (цена на которые указана здесь).
Классическая септопластика носа. Открытая операция, во время которой хирург с помощью скальпеля корректирует форму перегородки.
Эндоскопическая септопластика носа. Оперативное вмешательство проводят с помощью эндоскопа. Устройство выводит изображение операционного поля на экран.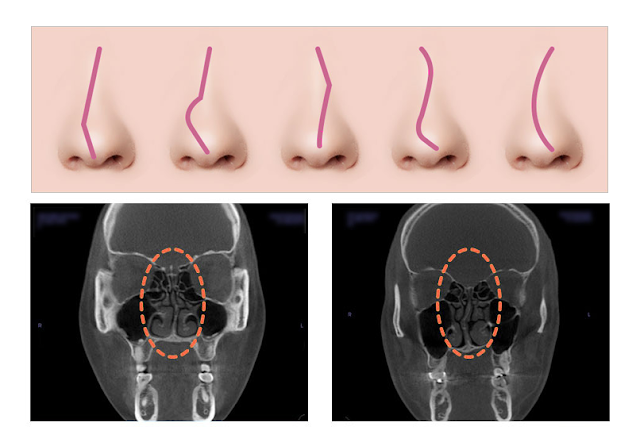 Это позволяет врачу максимально детально изучать зону вмешательства, и проводить операцию с исключительной точностью.
Это позволяет врачу максимально детально изучать зону вмешательства, и проводить операцию с исключительной точностью.
Все виды септопластики в Киеве проводят в клинике ADONIS лучшие хирурги-оториноларингологи:
- Ягельский Евгений Валентинович
- Олейников Валентин Борисович
- Болтоносов Василий Петрович
- Лузин Роман Сергеевич
Показания
Показанием к проведению операции является наличие таких симптомов:
- нарушение носового дыхания;
- храп;
- асимметричность носа;
- частые носовые кровотечения;
- сухость слизистой носа;
- постоянные риниты, гаймориты, синуситы;
- апноэ;
- головные боли;
- проблемы со слухом.
При наличии хотя бы нескольких из вышеперечисленных симптомов – это повод записаться на консультацию к оториноларингологу в ADONIS. Если на осмотре будет выявлено искривление носовой перегородки, операцию по доступной цене в Киеве проведут лучшие лор-хирурги в ADONIS.
Если на осмотре будет выявлено искривление носовой перегородки, операцию по доступной цене в Киеве проведут лучшие лор-хирурги в ADONIS.
Причины появления
Искривления носовой перегородки бывает трех типов:
Врожденное искривление перегородки носа появляются вследствие неправильно развития хрящевого и костного отделов перегородки носа. Эта причина наиболее распространенная.
Посттравматическое искривление перегородки возникает как следствие переломов, ушибов и других травм.
Компенсаторное искривление может быть спровоцировано попаданием инородного тела в полость носа, а также после развития полипов носу.
Если нужно выровнять носовую перегородку в Киеве по доступной цене можно в сети клиник ADONIS.
Противопоказания
Несмотря на все преимущества септопластики носа, имеет противопоказания к проведению:
- беременность;
- грудное вскармливание;
- нарушения свертываемости крови;
- сахарный диабет;
- онкология;
- туберкулез;
- обострения сердечно-сосудистых заболеваний,
- дыхательная недостаточность, болезни почек и печени;
- инфекционные заболевания;
- повышенная температура;
- недавно перенесенный инфаркт или инсульт.

Избавиться от искривления носовой перегородки с помощью операции по приемлемой стоимости в Киеве можно в отделениях клиники ADONIS:
- Инновационном хирургическом центре на Подоле по ул. Спасской, 39;
- Центре здоровья семьи ADONIS на Днепровской набережной, 26-К;
- Лечебно-диагностическом центре ADONIS по ул. Жилянской, 72.
Как проходит операция
В ADONIS созданы все условия для лечения любых, даже самых сложных форм искривления носовой перегородки. Об особенностях проведения септопластики носа и послеоперационного восстановления рассказывает ведущий специалист, врач-отоларинголог высшей категории, Ягельский Евгений Валентинович.
Комментарий врача
- Операция может проводиться как с использованием местной анестезии, так и под общим наркозом.
- Преимущества эндоскопической септопластики в том, что после операции нет видимых косметических дефектов (синяков, швов), так как все разрезы проводятся внутри носовой полости.

- Искривленные отделы носовой перегородки выравнивают и приводят в правильное положение. Сильно деформированные кости и хрящевые части удаляют минимально, чтобы перегородка носа сохранила свою опору.
- Очень важно во время операции использовать максимально щадящие методики, чтобы сохранить неповрежденной слизистую оболочку носа.
- После операции полость носа на 1-2 для закрывают эластичными тампонами и силиконовыми сплинтами. Чтобы сохранить пациенту носовое дыхание, в носовую полость устанавливают респираторные трубки.
Восстановление после операции
Септопластику носа пациенты переносят хорошо. В первые 2-3 дня после операции пациент может испытывать ощущения, как при легком гриппе (может наблюдаться незначительное повышение температуры, появиться ломота в теле, недомогание). В этих случаях рекомендован прием обезболивающих или противовоспалительных средств.
После извлечения тампонов,постепенно начинает восстанавливаться носовое дыхание. Полная нормализация наступает через 5-7 дней.
Полная нормализация наступает через 5-7 дней.
В течение трех-четырех недель после операции рекомендуется исключить физические нагрузки и посещать врача по ранее расписанному графику.
Возможные осложнения
Осложнения после исправления носовой перегородки (в Киеве в клинике ADONIS) бывают очень редко.
Среди возможных можно назвать:
- носовое кровотечение;
- перфорация (нарушение целостности) носовой перегородки;
- сращения носовой полости;
- деформация наружного носа.
Преимущества септопластики в ADONIS
Выравнивание носовой перегородки в Киеве в МЦ ADONIS имеет ряд преимуществ:
- Опытные врачи, члены международных ассоциаций
- Эндоскопическое выравнивание перегородки носа без разрезов и наружных швов
- Новейшее операционное и диагностическое оборудование
- Возможность пройти предоперационную диагностику и все лабораторные исследования в одном месте
- Короткий период реабилитации
- Послеоперационное пребывание в комфортном стационаре (1 сутки)
- Сопровождение операции опытными анестезиологами
- Доступные цены
Цены на септопластику
Эндоскопическая септопластика – 13000 грн.
Эндоскопическая септопластика (в комбинации с хирургическим лечением околоносовых пазух) – 7000 грн.
Подробнее о стоимости операции по исправлению носовой перегородку можно узнать здесь.
Как записаться на консультацию
Записаться на консультацию к отоларингологу в ADONIS, чтобы узнать нужна ли операция по выравниванию носовой перегородки и цены на нее, можно через форму онлайн-заявки или позвонив в контакт-центр:
0 800 707 707
Перегородка влагалища с вертикальной перегородкой — альтернатива кольпоклеизу | Гинекологическая хирургия
- Методы и инструменты
- Опубликовано:
- Сарита Какаткар 1
Гинекологическая хирургия
том 9 , страницы 53–58 (2012 г. )Процитировать эту статью
)Процитировать эту статью
1699 доступов
Сведения о показателях
Abstract
Целью данного исследования является разработка и внедрение эффективной методики устранения пролапса у сексуально неактивных пожилых пациентов, которая решает все сопутствующие послеоперационные проблемы. Исследуемой группе из 34 пациенток была выполнена вагинальная перегородка с вертикальной перегородкой (VPwVS). Всем 34 пациентам удалось успешно пройти VPwVS. Кровопотеря и продолжительность хирургического вмешательства были сопоставимы с традиционным кольпоклейзом (КК). После операции ни у одного пациента не было рецидива пролапса, возникновения de novo и/или рецидива мочевых или кишечных симптомов, и ни у одного пациента не развилась гематометра или пиометра. Возможен сбор мазка Папаниколау. Это исследование показывает, что VPwVS представляет собой целостное решение для лечения пролапса у сексуально неактивных пожилых пациентов, решает все связанные с этим проблемы и выглядит лучше, чем CC; однако может потребоваться более крупное многоцентровое исследование, чтобы статистически доказать его преимущество перед CC. Актуальность VPwVS становится очевидной с ростом гериатрической популяции.
Это исследование показывает, что VPwVS представляет собой целостное решение для лечения пролапса у сексуально неактивных пожилых пациентов, решает все связанные с этим проблемы и выглядит лучше, чем CC; однако может потребоваться более крупное многоцентровое исследование, чтобы статистически доказать его преимущество перед CC. Актуальность VPwVS становится очевидной с ростом гериатрической популяции.
История вопроса
Королевский колледж акушеров и гинекологов рекомендует CC [1] для пластики пролапса у гериатрических пациентов из групп высокого риска и сексуально неактивных. С момента его появления в 1876 или 1877 году (Neugebauer-Le Fort) было разработано множество модификаций [1, 2] кольпоклейза для улучшения хирургических результатов.
Методы основного кольпоклейза устраняют симптомы пролапса, но часто связаны с мочевыми симптомами, которые могут потребовать дополнительных операций [3, 4], варьирующихся от шва Келли, пликации лобково-шейной фасции до TVT или сетки, все с различной степенью успеха. Для улучшения результатов также предлагается местно-специфическое [5] восстановление цистоцеле и энтероцеле. Сообщалось о гематометре [2, 6] и пиометре [7] после кольпоклейза. Сбор мазка Папаниколау затруднен. Выпадение прямой кишки [8] и эвисцерация тонкой кишки [9] были зарегистрированы после кольпоклейза.
Для улучшения результатов также предлагается местно-специфическое [5] восстановление цистоцеле и энтероцеле. Сообщалось о гематометре [2, 6] и пиометре [7] после кольпоклейза. Сбор мазка Папаниколау затруднен. Выпадение прямой кишки [8] и эвисцерация тонкой кишки [9] были зарегистрированы после кольпоклейза.
Принимая во внимание вышеизложенное, цели лечения кольпоклейза можно резюмировать следующим образом:
- 1.
Для облегчения симптомов пролапса без рецидива [10–12]
- 2.
Для оптимизации функций мочевого пузыря и кишечника (отсутствие симптомов свежего мочеиспускания, энтероцеле или выпадения прямой кишки)
- 3.
Для обеспечения естественного оттока маточно-влагалищного секрета для предотвращения гематометры или пиометры
- 4.

Для разрешения мазка Папаниколау
Вышеупомянутые цели должны быть достигнуты без ухудшения состояния здоровья пациента, с минимальной кровопотерей и длительностью хирургического вмешательства.
Верхушка влагалища поддерживается фиброзно-мышечной тканью, простирающейся от одной сухожильной дуги до другой, чуть ниже вагинального эпителия [13], который не должен быть травмирован из-за хирургического вмешательства, что связано с риском, связанным с удалением слизистой оболочки влагалища. Создание вертикальной перегородки, напротив, не требует удаления вагинального эпителия, что предотвращает возможную травму фиброзно-мышечной опоры, отходящей от дуги. В таблице 1 показано сравнение СС с вагинальной перегородкой с вертикальной перегородкой (VPwVS). Он также содержит рис. 1 и 2.
Таблица 1 Сравнение CC с VPwVS
Полноразмерная таблица
Рис. 1
1
Поперечный срез влагалища в CC
Изображение в натуральную величину
Рис. 2
Изображение поперечного сечения влагалища 90 2w1VS 90 2w1VS 90 2w1VS 90 2w1VS
Введение
VPwVS, описанная в данном документе, представляет собой облитерирующую хирургическую процедуру для исправления пролапса, включающую отступление от современных учебников и тенденций. Данная работа носит качественный характер и относится к категории «методика и приборостроение». VPwVS – это облитерирующая процедура устранения пролапса, включающая разделение влагалища на двусторонние туннели диаметром около 1,5 см каждый (с гистерэктомией или без нее) с прочной и широкой вертикальной срединной перегородкой по всей длине влагалища, обеспечивающей равную поддержку как к передней, так и к задней структурам, а также восстанавливает длину влагалища.
Материал и метод
Это исследование является текущим проектом с 1995 года, проводимым в неклинических больницах, предпринятым как вариант современных версий учебников по облитерирующим процедурам пластики пролапса, и информированное согласие было получено от всех пациентов после подробное обсуждение. Это исследование включает в общей сложности 34 сексуально неактивных пациента в возрастной группе от 60 до 94 лет со средним возрастом 77 лет, жалующихся на пролапс. На рисунках 3 и 4 показана соответствующая информация. В то время как 31 пациент был подвергнут регионарной или общей анестезии, трем пациентам была назначена местная анестезия + седация. На рисунке 5 показан тип операции, проведенной в исследуемой группе.
Это исследование включает в общей сложности 34 сексуально неактивных пациента в возрастной группе от 60 до 94 лет со средним возрастом 77 лет, жалующихся на пролапс. На рисунках 3 и 4 показана соответствующая информация. В то время как 31 пациент был подвергнут регионарной или общей анестезии, трем пациентам была назначена местная анестезия + седация. На рисунке 5 показан тип операции, проведенной в исследуемой группе.
Рис. 3
Количество обследованных пациентов и критерии исключения
Полноразмерное изображение
Рис. 4
Состав исследуемой группы
Полноразмерное изображение
Рис. Изображение в полном размере
Хирургические этапы в VPwVS
Первым шагом в VPwVS является идентификация свода перед началом диссекции. Солевой раствор + адреналин (один на 100 000) вводится подслизисто. Аквадиссекция помогает уменьшить интраоперационную кровопотерю и возможность травмы близлежащих органов. Затем передняя стенка рассекается через центральный вертикальный разрез впереди свода. Рассечение должно составлять 2 см с каждой стороны от разреза, чтобы обеспечить наложение швов без натяжения (см. рис. 6).
Затем передняя стенка рассекается через центральный вертикальный разрез впереди свода. Рассечение должно составлять 2 см с каждой стороны от разреза, чтобы обеспечить наложение швов без натяжения (см. рис. 6).
Рис. 6
Рассечение передней стенки
Изображение полного размера
Заднюю стенку рассекают в два этапа. Отделение задней стенки выполняется на расстоянии не менее 2 см с каждой стороны от центрального вертикального разреза. Верхушку переднего разреза сближают с вершиной заднего разреза в центре свода отсроченными рассасывающимися швами. Стежок проходит исключительно через необработанную область, косвенно укрепляя опоры. Это формирует апикальную точку, как показано на рис. 7. Затягивая узел, следите за тем, чтобы апикальный стежок проталкивался как можно выше. Убедитесь, что длина шва одинакова с обеих сторон узла. Не разрезайте шовный материал. Этот же шовный материал используется для формирования перегородки.
Рис. 7
7
Апикальная точка
Изображение в полный размер
Для формирования перегородки накладывают непрерывные вертикальные матрацные швы, начиная с апикальной точки (точка e на рис. 8). Один конец нити используется для наложения швов на правой стороне, а другой конец используется для наложения швов на левой стороне. Для начала один конец нити проводят через точку на 1,5 см выше апикальной точки и у основания правой передней стенки (точка а). Игла вводится из области раны возле апикальной точки на блестящую слизистую влагалища. Чтобы завершить вертикальный матрацный шов, игла вводится в точку на 1,5 см выше точки «а» у основания правой передней стенки (точка b). Игла вводится со стороны слизистой оболочки влагалища в области раны. Тот же конец шовного материала используется для выполнения вертикального матрацного шва на правой задней стенке. Для начала иглу вводят в точке на 1,5 см ниже апикальной точки (точка c) у основания правой задней стенки от области раны до слизистой оболочки влагалища. Чтобы завершить вертикальный матрацный шов, игла снова вводится через точку на 1,5 см ниже точки «с» (точка d) у основания правой задней стенки. Шовный материал поступает со стороны слизистой оболочки влагалища в область раны. Аналогично проводят другой конец нити через левую переднюю и заднюю стенки влагалища.
Чтобы завершить вертикальный матрацный шов, игла снова вводится через точку на 1,5 см ниже точки «с» (точка d) у основания правой задней стенки. Шовный материал поступает со стороны слизистой оболочки влагалища в область раны. Аналогично проводят другой конец нити через левую переднюю и заднюю стенки влагалища.
Рис. 8
Наложение швов
Изображение в полный размер
После выполнения швов с обеих сторон их вытягивают, в результате чего края выворачиваются в просвет с каждой стороны. Затем узел крепко завязывают, продвигая вверх вершинную точку. Узлы находятся в центре, прикрытые необработанным рассеченным участком. Это помогает сделать вертикальную перегородку, разделяющую влагалище продольно на два узких туннеля. Рассеченные необработанные участки сшиваются между собой, образуя широкую и прочную перегородку. Аналогичные вертикальные матрацные швы накладывают по всей длине разреза передней стенки.
Поскольку задняя стенка всегда длиннее передней, часть задней стенки остается незанятой. Теперь клиновидная часть удаляется по обе стороны от срединного разреза, и после сближения мышцы, поднимающей задний проход, выполняется рутинная кольпоперинеорафия с последующим закрытием кожи промежности.
Теперь клиновидная часть удаляется по обе стороны от срединного разреза, и после сближения мышцы, поднимающей задний проход, выполняется рутинная кольпоперинеорафия с последующим закрытием кожи промежности.
Создается двойное влагалище (точки a и b на рис. 9) с центральной перегородкой (точка c), простирающейся от входа до апикальной точки, восстанавливая длину влагалища. Калибр каждой половины двойного влагалища составляет около 1,5 см.
Рис. 9
Конечный результат
Изображение в полный размер
Результаты
Средняя продолжительность хирургического вмешательства составила 45 минут, а средняя кровопотеря составила 35 миллилитров, при этом значение p равно нулю в обоих случаях. Оба сопоставимы в VPwVS и CC [14].
Первое последующее наблюдение (FU) было через 6 недель. Последующие наблюдения проводились каждые 3 месяца в течение 1 года, а затем ежегодно (см. рис. 10. Послеоперационное наблюдение: ЧЕРЕЗ ОДИН ГОД). Всех пациентов после операции обследовали на предмет рецидива пролапса, симптомов мочеиспускания и других жалоб, если таковые имелись. Ни у одного пациента не было рецидива пролапса, недержания мочи при напряжении или ректоцеле (по подсчетам p значение = 0).
Всех пациентов после операции обследовали на предмет рецидива пролапса, симптомов мочеиспускания и других жалоб, если таковые имелись. Ни у одного пациента не было рецидива пролапса, недержания мочи при напряжении или ректоцеле (по подсчетам p значение = 0).
Рис. 10
Послеоперационное наблюдение через 1 год
Изображение в натуральную величину
Продолжительность операции и кровопотеря при ВПВВС сравнимы с таковыми при РШМ [14]. Количество пациентов, потерянных из-за ФУ в этом исследовании (рис. 10), хотя и является значительным, по сравнению с CC [15], но ни у одного из пациентов в этом исследовании не было рецидива, симптомов со стороны мочевыводящих путей или ректального пролапса. Как показано в таблице 1, процедура VPwVS имеет преимущество перед CC из-за следующего:
Более анатомический и менее деформирующий
Независимо от степени или места пролапса
Не требует сопутствующего хирургического вмешательства, что позволяет сократить продолжительность хирургического вмешательства и снизить кровопотерю
Безопасность, простота и элегантность
Эффективен и обеспечивает длительный результат
VPwVS также осуществима в рамках данных ограничений, т. е. без ухудшения состояния здоровья пациента и с минимальной продолжительностью хирургического вмешательства и минимальной кровопотерей.
е. без ухудшения состояния здоровья пациента и с минимальной продолжительностью хирургического вмешательства и минимальной кровопотерей.
Заключение
Возрастает гериатрическая популяция, а вместе с ней и частота пролапса. Роль облитерирующей хирургии для устранения пролапса в настоящее время общепризнанна у гериатрических пациентов, не заинтересованных в половой жизни. Такие облитерирующие процедуры должны быть эффективными, с устойчивыми результатами, а также безопасными и простыми. VPwVS достигает всех целей кольпоклейза с хорошим показателем успеха, даже при длительном наблюдении; тем не менее, более крупное многоцентровое исследование может предоставить статистическое сравнение между VPwVS и CC. Будучи технически и функционально обоснованным, VPwVS является определенной альтернативой кольпоклейзису и заслуживает более широкого применения профессионалами.
Ссылки
RCOG/BSUG (Британское общество урогинекологов) (2007 г.
 ) Лечение пролапса свода влагалища после гистерэктомии: руководство №46 с зеленым верхом. http://www.rcog.uk/…../Руководство. Доступ с декабря 2009 г. по июнь 2010 г.
) Лечение пролапса свода влагалища после гистерэктомии: руководство №46 с зеленым верхом. http://www.rcog.uk/…../Руководство. Доступ с декабря 2009 г. по июнь 2010 г.Goldman J, Ovadia J, Felfberg D (1981) Операция Neugebauer-Le Fort: обзор 118 частичных кольпоклеизов. Eur J Obstet Gynecol Reprod Biol 12:31–35, http://www.jfponline.com/pagesasp?aid=7597.
Артикул
пабмед
КАСGoogle ученый
Хаббард Л. и др. (2005) Вагинэктомия у некоторых пациентов с пролапсом таза. www.findarticles.com/p/article/mi_mocyd/is_22_39/ai_n8568368. Доступ с декабря 2009 г. по июнь 2010 г.
Harmanli OH (2002) Крупнейшая серия случаев на сегодняшний день: кольпоклейзис считается эффективным при пролапсе у пожилых людей. Новости акушер-гинекологии 37(8):18, www.jfponline.com/pagesasp?aid=7597
Google ученый
«>Лазару Г., Гриореску Б.А. и др. (2010) Выпадение матки: лечение. www.emedcine.medscope.com/../obstetricsandgynecology. Доступ с декабря 2009 г. по июнь 2010 г.
Roth TM (2007) Пиометра и рецидивирующий пролапс после кольпоклейза Ле Фор. Intr Urogynecol J Pelvic Floor Dysfunct 18(6):687–688, www.springerlink.com/index/123p2311q40h8p8w.pdf
Артикул
Google ученый
Jelovsek JE, Paraiso MF Хирургические вмешательства при опущении тазовых органов. www.touchencronology.com/../surgicalprocedurepelvicorganprolapse. Доступ с декабря 2009 г. по июнь 2010 г.
Мур Р.Д., Миклосс Дж.Р. (2001) Восстановление вагинальной эвисцерации после кольпоклейза с использованием аллогенного кожного трансплантата.
 Int Eurogynecol J Pelvic Floor Dysfunct 12:215–217, www.miklosandmoore.com/white.pages/uploads/graft/graft_3.pdf (по состоянию на июнь 2005 г.)
Int Eurogynecol J Pelvic Floor Dysfunct 12:215–217, www.miklosandmoore.com/white.pages/uploads/graft/graft_3.pdf (по состоянию на июнь 2005 г.)Статья
КАСGoogle ученый
О’Лири А.Дж., Вьяс С.К. (2004) Частичный кольпоклеиз Ле Форта: обзор опыта одного хирурга. Гинекологическая хирургия 1(1):15–19
Статья
Google ученый
Fitsgerald MP, Richter HE et al (2006) Кольпоклейзис: обзор. Int Eurogynecol J Pelvic Floor Dysfunct 17(3):261–271, www.ncbi.nih.gov/pubmed/15983731
Артикул
Google ученый
Fitsgerald MP (2008) Эффективность кольпоклейза при пролапсе тазовых органов. www.findarticles.com/p/articles/mi_hb4365/is_2241/ai_n31151675. По состоянию на декабрь 2009 г. – июнь 2010 г.
«>Valaitis SR (2010) Облитерирующая вагинальная хирургия для лечения прогрессирующего пролапса таза. www.femalepatient.com/html/arc/../030_05_028.asp. По состоянию на декабрь 2009 г.до июня 2010 г.
Wheeler TL (2005) Сожаление, удовлетворение после частичного кольпоклейза. www.ncbi.nlm.nih.gov/pubmed/16325617. Доступ с декабря 2009 г. по июнь 2010 г.
Zimmerman CS (2005) Местный кольпоклейзис называется верхним подходом. www.findarticles.com/p/articles/mi_mocyd/is_1_40/ai/n8968471. Доступ с декабря 2009 г. по июнь 2010 г.
Biller D, Davila GW (2004) Выбор наилучшего метода лечения пролапса свода влагалища. J Fam Prac, том 16, вып. 12. www.jfponline.com/pages.asp?aid=3462. Доступ с декабря 2009 г. по июнь 2010 г.
Ссылки на скачивание
Благодарности
Доктор Тушар Панчнадикар, доктор медицинских наук (акушер-гинеколог), профессор Медицинского колледжа Бхарати Видьяпитх, Пуна; Доктор Анджали Радкар, доктор философии. (статистика), доцент Института экономики Гокхале, Пуна; и г-н Прадип Какаткар, FCA, Пуна.
Подробная информация об утверждении этики
Полностью соблюдаются рекомендации, изложенные в Руководстве по медицинской этике (2009 г. ) WMA.
) WMA.
Author information
Authors and Affiliations
Dr. Manohar Joshi Memorial Hospital (MJM Hospital), Janardan Sadan, 1194-23 Ghole Road, Pune, 411005, India
Sarita Kakatkar
Authors
- Sarita Kakatkar
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Академия
Автор, ответственный за переписку
Сарита Какаткар.
Права и разрешения. 35, No. 4
Ассоциированная перевязка печени и воротной вены для поэтапной гепатэктомии (ALPPS) расширила хирургический арсенал для пациентов с запущенными и двусторонними метастазами колоректального рака в печень. Однако энтузиазм медицинского сообщества по поводу ALPPS был омрачен высоким уровнем смертности и ранним и частым рецидивом опухоли. В то время как хирургическая безопасность улучшилась, в основном благодаря техническим усовершенствованиям и лучшему отбору пациентов, онкологическая ценность в условиях раннего рецидива опухоли остается неясной. Единственное рандомизированное контролируемое исследование ALPPS по сравнению с двухэтапной гепатэктомией (TSH) до сих пор подтвердило, что ALPPS приводит к более высокой резектабельности с сопоставимой частотой периоперационных осложнений, но онкологические результаты не оценивались. Надежные данные относительно долгосрочных результатов все еще отсутствуют. ТТГ и ALPPS могут быть дополнительными стратегиями резекции колоректальных метастазов печени (CRLM), при этом ALPPS зарезервирован для пациентов, у которых нет других вариантов хирургического вмешательства, то есть после неудачной эмболизации воротной вены или у пациентов с очень маленьким остатком печени в будущем. Другими словами, ALPPS можно рассматривать как дополнительный инструмент и последнее средство в руках хирурга печени, чтобы предложить резектабельность при нерезектабельном CRLM. В этих отдельных случаях, и всегда включенный в мультимодальное лечение, ALPPS может дать шанс на полное удаление опухоли и пролонгированное выживание и даже шанс на излечение.
Единственное рандомизированное контролируемое исследование ALPPS по сравнению с двухэтапной гепатэктомией (TSH) до сих пор подтвердило, что ALPPS приводит к более высокой резектабельности с сопоставимой частотой периоперационных осложнений, но онкологические результаты не оценивались. Надежные данные относительно долгосрочных результатов все еще отсутствуют. ТТГ и ALPPS могут быть дополнительными стратегиями резекции колоректальных метастазов печени (CRLM), при этом ALPPS зарезервирован для пациентов, у которых нет других вариантов хирургического вмешательства, то есть после неудачной эмболизации воротной вены или у пациентов с очень маленьким остатком печени в будущем. Другими словами, ALPPS можно рассматривать как дополнительный инструмент и последнее средство в руках хирурга печени, чтобы предложить резектабельность при нерезектабельном CRLM. В этих отдельных случаях, и всегда включенный в мультимодальное лечение, ALPPS может дать шанс на полное удаление опухоли и пролонгированное выживание и даже шанс на излечение.
Колоректальный рак является третьим наиболее распространенным видом рака в мире. Почти половина пациентов имеют либо метастазы в печени на момент постановки диагноза, либо в конечном итоге метастазы разовьются в ходе болезни. Резекция печени в настоящее время является методом выбора, если предполагается лечебный подход, обеспечивающий 5-летнюю выживаемость до 50–60% в зависимости от выбора пациента. Однако на момент постановки диагноза только 15–30% пациентов являются кандидатами на переднюю операцию на печени [1–4]. Чаще всего мультифокальное внутрипеченочное распространение опухоли в обе доли печени, обширная опухолевая масса или диффузные внепеченочные метастазы приводят либо к технической, либо к функциональной нерезектабельности, либо делают резекцию сомнительной с онкологической точки зрения. С другой стороны, хотя возможности химиотерапии неуклонно улучшаются, пациенты, не поддающиеся хирургическому вмешательству, вряд ли имеют шансы на долгосрочное выживание или даже на излечение. В случае нерезектабельных метастазов колоректального рака в печень (CRLM) медиана общей выживаемости колеблется от 18 до 28 месяцев в тщательно отобранных когортах пациентов в зависимости от нескольких факторов, таких как степень поражения печени, наличие дополнительной внепеченочной опухоли, стадии T и N и молекулярные особенности первичной опухоли, а также индивидуальный ответ на современную системную терапию, в том числе таргетную [5].
В случае нерезектабельных метастазов колоректального рака в печень (CRLM) медиана общей выживаемости колеблется от 18 до 28 месяцев в тщательно отобранных когортах пациентов в зависимости от нескольких факторов, таких как степень поражения печени, наличие дополнительной внепеченочной опухоли, стадии T и N и молекулярные особенности первичной опухоли, а также индивидуальный ответ на современную системную терапию, в том числе таргетную [5].
За последние 3 десятилетия терапевтические возможности CRLM неуклонно улучшались. Двумя наиболее значительными изменениями были разработка эффективных режимов химиотерапии и введение предоперационных методов модуляции объема печени. Таким образом, даже пациентам с обширной опухолью печени, ранее считавшейся нерезектабельной, теперь можно предложить хирургический подход и полное удаление опухоли с шансом на длительное выживание и даже излечение [3, 4, 6].
Разработано несколько стратегий повышения резектабельности печени. Двумя более ранними вехами были изобретение эмболизации воротной вены (PVE) для индуцирования гипертрофии будущего остатка печени (FLR) и введение химиотерапии с целью уменьшения размеров для достижения вторичной резектабельности у пациентов с метастазами, которые изначально считались нерезектабельными [1, 7]. ]. В 2000 г. была введена двухэтапная гепатэктомия (ТТГ), позволяющая выполнить полную резекцию двусторонних многоузловых метастазов в печени, не поддающихся резекции за одну процедуру, даже после эффективной уменьшающей химиотерапии [2]. Тем не менее, лечение двусторонних метастазов в условиях предполагаемого небольшого FLR оставалось большой проблемой. Чтобы справиться с этой проблемой, традиционный ТТГ был дополнительно модифицирован путем комбинирования удаления опухоли одной половины печени с одновременной перевязкой контралатеральной воротной вены (ПВЛ) или последующей ЭВВ для стимуляции роста ФЛР [8]. Частота гипертрофии, наблюдаемая через 4–12 недель после применения этого подхода, обычно колеблется от 20 до 40%, но может достигать почти 60–70% в узкоспециализированных центрах. Сообщаемые данные о выживаемости после ТТГ с и без ЭВК/ПВЛ сильно различаются в зависимости от критериев отбора пациентов [9]., 10]. Наилучшие результаты сопоставимы с данными об исходах после операции по поводу первично резектабельного CRLM, при этом 5-летняя выживаемость составляет около 30%, а лучший результат составляет 64%, если оба этапа выполнены [11].
]. В 2000 г. была введена двухэтапная гепатэктомия (ТТГ), позволяющая выполнить полную резекцию двусторонних многоузловых метастазов в печени, не поддающихся резекции за одну процедуру, даже после эффективной уменьшающей химиотерапии [2]. Тем не менее, лечение двусторонних метастазов в условиях предполагаемого небольшого FLR оставалось большой проблемой. Чтобы справиться с этой проблемой, традиционный ТТГ был дополнительно модифицирован путем комбинирования удаления опухоли одной половины печени с одновременной перевязкой контралатеральной воротной вены (ПВЛ) или последующей ЭВВ для стимуляции роста ФЛР [8]. Частота гипертрофии, наблюдаемая через 4–12 недель после применения этого подхода, обычно колеблется от 20 до 40%, но может достигать почти 60–70% в узкоспециализированных центрах. Сообщаемые данные о выживаемости после ТТГ с и без ЭВК/ПВЛ сильно различаются в зависимости от критериев отбора пациентов [9]., 10]. Наилучшие результаты сопоставимы с данными об исходах после операции по поводу первично резектабельного CRLM, при этом 5-летняя выживаемость составляет около 30%, а лучший результат составляет 64%, если оба этапа выполнены [11]. Однако риски, присущие этой стратегии, заключаются в неэффективной гипертрофии печени, с одной стороны, и вероятной стимуляции роста как FLR, так и опухоли, с другой стороны. Таким образом, время после 1-го этапа гепатэктомии и ПВЭ/ПВЛ, необходимое для достижения достаточной гипертрофии ВЛР, несет в себе риск прогрессирования опухоли. Это было показано в нескольких исследованиях, где до 25–38% пациентов не перешли к этапу 2, в основном из-за опухолевой прогрессии и реже из-за недостаточного прироста объема [11–17]. Пациенты, которым не удается завершить гепатэктомию на 2-м этапе, имеют плохую выживаемость, аналогичную или даже худшую, чем у пациентов, получавших только химиотерапию [11-16]. Эти данные подчеркивают важность завершения запланированной 2-этапной процедуры и необходимость полного удаления опухоли.
Однако риски, присущие этой стратегии, заключаются в неэффективной гипертрофии печени, с одной стороны, и вероятной стимуляции роста как FLR, так и опухоли, с другой стороны. Таким образом, время после 1-го этапа гепатэктомии и ПВЭ/ПВЛ, необходимое для достижения достаточной гипертрофии ВЛР, несет в себе риск прогрессирования опухоли. Это было показано в нескольких исследованиях, где до 25–38% пациентов не перешли к этапу 2, в основном из-за опухолевой прогрессии и реже из-за недостаточного прироста объема [11–17]. Пациенты, которым не удается завершить гепатэктомию на 2-м этапе, имеют плохую выживаемость, аналогичную или даже худшую, чем у пациентов, получавших только химиотерапию [11-16]. Эти данные подчеркивают важность завершения запланированной 2-этапной процедуры и необходимость полного удаления опухоли.
В 2007 г. профессор Ханс Дж. Шлитт [18] из Регенсбурга, Германия, выполнил, не обязательно специально, первую перевязку печеночной перегородки и воротной вены для процедуры поэтапной гепатэктомии (ALPPS) или, как она называлась и до сих пор называется в Германии «расщепленная резекция печени in situ» у пациента с внутригрудной холангиокарциномой. Эта инновационная концепция быстрой гипертрофии FLR была вскоре адаптирована многими хирургами по всей стране, но почти не получила признания за пределами Германии [18]. В 2012 г. был опубликован первый отчет о 25 случаях из 5 немецких центров, включая 14 пациентов с CRLM. Во вступительной статье быстрый рост FLR со средней скоростью гипертрофии 74% после 9дней и сообщалось о 100% резекции у пациентов с нерезектабельными опухолями [19]. Эта первая презентация ALPPS вызвала огромный международный интерес, и группы гепато-панкреато-билиарной (HPB) со всего мира начали работать в области ALPPS. Вскоре после этого дальнейшие отчеты подтвердили первоначальные многообещающие результаты и, кроме того, можно было показать, что ALPPS был эффективен даже после неудачи PVE [20-26]. В раннем ретроспективном анализе в 4 специализированных центрах HPB, сравнивающем данные ALPPS и расширенной гепатэктомии после PVE / PVL, полная резекция опухоли была значительно лучше при ALPPS с аналогичными показателями выживаемости.
Эта инновационная концепция быстрой гипертрофии FLR была вскоре адаптирована многими хирургами по всей стране, но почти не получила признания за пределами Германии [18]. В 2012 г. был опубликован первый отчет о 25 случаях из 5 немецких центров, включая 14 пациентов с CRLM. Во вступительной статье быстрый рост FLR со средней скоростью гипертрофии 74% после 9дней и сообщалось о 100% резекции у пациентов с нерезектабельными опухолями [19]. Эта первая презентация ALPPS вызвала огромный международный интерес, и группы гепато-панкреато-билиарной (HPB) со всего мира начали работать в области ALPPS. Вскоре после этого дальнейшие отчеты подтвердили первоначальные многообещающие результаты и, кроме того, можно было показать, что ALPPS был эффективен даже после неудачи PVE [20-26]. В раннем ретроспективном анализе в 4 специализированных центрах HPB, сравнивающем данные ALPPS и расширенной гепатэктомии после PVE / PVL, полная резекция опухоли была значительно лучше при ALPPS с аналогичными показателями выживаемости. Это было поразительно, так как ALPPS в основном применялся в случаях с более высокой опухолевой массой, не поддающейся традиционной резекции после PVL/PVE [27]. Несмотря на то, что это было достигнуто в несоответствующем сравнении, это открытие предполагает, по крайней мере, онкологическую не меньшую эффективность ALPPS по сравнению с расширенной гепатэктомией после PVE / PVL. Эти данные вызвали растущий интерес к ALPPS как к новому радикальному варианту хирургического лечения, в том числе у пациентов с обширной колоректальной опухолью печени. Медиана гипертрофии составляет 160% (диапазон 93–250%), в отдельных случаях даже допускается резекция всех сегментов печени, кроме одного, так называемая моносегментарная АЛППС [28, 29]. В 2015 году Шадде и соавт. [29] сообщили о 12 случаях «односегментарного ALPPS» без какой-либо послеоперационной летальности.
Это было поразительно, так как ALPPS в основном применялся в случаях с более высокой опухолевой массой, не поддающейся традиционной резекции после PVL/PVE [27]. Несмотря на то, что это было достигнуто в несоответствующем сравнении, это открытие предполагает, по крайней мере, онкологическую не меньшую эффективность ALPPS по сравнению с расширенной гепатэктомией после PVE / PVL. Эти данные вызвали растущий интерес к ALPPS как к новому радикальному варианту хирургического лечения, в том числе у пациентов с обширной колоректальной опухолью печени. Медиана гипертрофии составляет 160% (диапазон 93–250%), в отдельных случаях даже допускается резекция всех сегментов печени, кроме одного, так называемая моносегментарная АЛППС [28, 29]. В 2015 году Шадде и соавт. [29] сообщили о 12 случаях «односегментарного ALPPS» без какой-либо послеоперационной летальности.
Однако первоначальный энтузиазм по поводу ALPPS остыл, когда стала очевидной высокая смертность в 12% (3/25) в начальных исследованиях, и многие хирурги выразили обеспокоенность по поводу безопасности процедуры ALPPS [30-30]. 32]. Важно отметить, что в первоначальном отчете 3 пациента, на долю которых приходится послеоперационная смертность, были пациентами с CRLM, которые прошли предоперационную химиотерапию. Однако высокая частота осложнений объяснялась новизной процедуры и предполагалось, что она будет снижаться с течением времени по мере накопления опыта. Что касается показаний, последующие отчеты могли показать, что для CRLM, который на сегодняшний день является наиболее частым показанием для процедуры ALPPS, частота осложнений была ниже, чем для первичных гепатобилиарных злокачественных новообразований [33]. Тем не менее, частота осложнений после ALPPS для CRLM по-прежнему, по-видимому, выше, чем после обычной резекции печени, это, однако, без учета систематической ошибки отбора в группе ALPPS пациентов с более распространенным заболеванием, которые в противном случае лечились бы либо только паллиативной химиотерапией, либо расширенной гепатэктомией после ЭВЭ и ПВЛ [34].
32]. Важно отметить, что в первоначальном отчете 3 пациента, на долю которых приходится послеоперационная смертность, были пациентами с CRLM, которые прошли предоперационную химиотерапию. Однако высокая частота осложнений объяснялась новизной процедуры и предполагалось, что она будет снижаться с течением времени по мере накопления опыта. Что касается показаний, последующие отчеты могли показать, что для CRLM, который на сегодняшний день является наиболее частым показанием для процедуры ALPPS, частота осложнений была ниже, чем для первичных гепатобилиарных злокачественных новообразований [33]. Тем не менее, частота осложнений после ALPPS для CRLM по-прежнему, по-видимому, выше, чем после обычной резекции печени, это, однако, без учета систематической ошибки отбора в группе ALPPS пациентов с более распространенным заболеванием, которые в противном случае лечились бы либо только паллиативной химиотерапией, либо расширенной гепатэктомией после ЭВЭ и ПВЛ [34].
Как и в случае с любой новой хирургической процедурой с увеличением опыта, было внесено несколько модификаций для снижения осложнений и улучшения результатов. Улучшения были достигнуты за счет правильного отбора пациентов и, в частности, за счет усовершенствования хирургической техники, направленной главным образом на снижение заболеваемости после 1-й стадии [35-39]. Основные достижения были связаны с сохранением средней печеночной вены во время гепатэктомии первого этапа, что привело к концепции только частичной перерезки печени, называемой «частичной ALPPS». Наиболее важно то, что пересечение только 50-80% паренхимы печени связано со значительным снижением периоперационной заболеваемости, но, по-видимому, не влияет на степень индуцированной гипертрофии [39].-40]. Полное пересечение паренхимы печени на стадии 1 в настоящее время оставлено для тех ситуаций, когда необходимо избежать инвазии опухоли в FLR между стадиями. Другие модификации, такие как комбинация частичной ALPPS и PVE либо одновременно («Mini ALPPS»), либо последовательно, были направлены на дальнейшее ограничение послеоперационной заболеваемости путем исключения хирургических манипуляций на воротах печени [35, 41].
Улучшения были достигнуты за счет правильного отбора пациентов и, в частности, за счет усовершенствования хирургической техники, направленной главным образом на снижение заболеваемости после 1-й стадии [35-39]. Основные достижения были связаны с сохранением средней печеночной вены во время гепатэктомии первого этапа, что привело к концепции только частичной перерезки печени, называемой «частичной ALPPS». Наиболее важно то, что пересечение только 50-80% паренхимы печени связано со значительным снижением периоперационной заболеваемости, но, по-видимому, не влияет на степень индуцированной гипертрофии [39].-40]. Полное пересечение паренхимы печени на стадии 1 в настоящее время оставлено для тех ситуаций, когда необходимо избежать инвазии опухоли в FLR между стадиями. Другие модификации, такие как комбинация частичной ALPPS и PVE либо одновременно («Mini ALPPS»), либо последовательно, были направлены на дальнейшее ограничение послеоперационной заболеваемости путем исключения хирургических манипуляций на воротах печени [35, 41]. Совсем недавно было показано, что лапароскопический ALPPS еще больше снижает инвазивность обеих стадий [42].
Совсем недавно было показано, что лапароскопический ALPPS еще больше снижает инвазивность обеих стадий [42].
Все эти технические усовершенствования и улучшенный отбор пациентов привели к ступенчатому снижению частоты периоперационных осложнений ALPPS [34, 35, 43, 44]. Во второй крупной публикации из регистра ALPPS сообщалось о 5% смертности от CRLM после стадии 2, что близко к зарегистрированной смертности после обширной традиционной гепатэктомии [45]. Недавний одноцентровый анализ показал нулевую смертность через 90 дней в 17 случаях ALPPS, многие из которых были выполнены после обширной предоперационной химиотерапии. Данные подтверждают, что даже после химиотерапии возможен низкий уровень периоперационных осложнений и летальности при ALPPS [44]. В двух последних публикациях регистра ALPPS в 2016 и 2017 годах отмечается постоянное снижение ранней смертности и заболеваемости с поправкой на риск [46, 47]. В то время как метаанализ Moris et al. [48] по-прежнему учитывали более высокую заболеваемость и смертность при ALPPS, но без различий в данных о смертности, связанной с печенью, в первом и пока только рандомизированном контролируемом исследовании (РКИ), наиболее точном способе сравнения ALPPS с ТТГ/ЭВК. нет разницы в периоперационных осложнениях (класс III–IV по Clavien-Dindo) и 90-дневная смертность. Эти данные ясно указывают на то, что с улучшением технического опыта и отбора пациентов ALPPS больше не следует считать более рискованной операцией, чем ТТГ [48, 49].
нет разницы в периоперационных осложнениях (класс III–IV по Clavien-Dindo) и 90-дневная смертность. Эти данные ясно указывают на то, что с улучшением технического опыта и отбора пациентов ALPPS больше не следует считать более рискованной операцией, чем ТТГ [48, 49].
Второй основной проблемой ALPPS является его польза от онкологических заболеваний. Ранний энтузиазм по поводу увеличения резектабельности у пациентов даже с обширной опухолевой массой сопровождался сообщениями о раннем и быстром росте рецидива опухоли во многих случаях. Предполагаемым патологическим механизмом является одновременная массивная стимуляция гепатоцеллюлярной гипертрофии, а также рост остаточных опухолевых клеток в FLR. Однако клинические, а также экспериментальные данные противоречивы и требуют дальнейшего изучения. В то время как некоторые авторы описывали более ранний рецидив опухоли в, по общему признанию, очень небольших сериях, метаанализ, проведенный Moris et al. [48] показали сходную частоту рецидивов опухоли для ТТГ и ALPPS [50]. Однако, поскольку показания и выбор пациентов для ТТГ и ALPPS сильно различаются от центра к центру, наиболее вероятно, что сопоставимость данных ограничена. Единственное РКИ, сравнивающее ALPPS и ТТГ, не анализировало онкологический исход и, следовательно, не может помочь ответить на этот вопрос. Нам нужно дождаться дальнейших РКИ, чтобы оценить, связан ли ALPPS с более высокой или более быстрой скоростью рецидива опухоли.
Однако, поскольку показания и выбор пациентов для ТТГ и ALPPS сильно различаются от центра к центру, наиболее вероятно, что сопоставимость данных ограничена. Единственное РКИ, сравнивающее ALPPS и ТТГ, не анализировало онкологический исход и, следовательно, не может помочь ответить на этот вопрос. Нам нужно дождаться дальнейших РКИ, чтобы оценить, связан ли ALPPS с более высокой или более быстрой скоростью рецидива опухоли.
Одним из предполагаемых преимуществ ALPPS является быстрая регенерация печени по сравнению с PVL/PVE. Действительно, скорость кинетического роста, наблюдаемая при ALPPS (около 22–35 мл/день), почти в десять раз выше, чем при приеме ТТГ плюс PVE (около 3–5 мл/день) [51, 52]. Это различие все еще трудно объяснить, но оно может быть связано с системным ответом на дополнительное рассечение паренхимы. По-видимому, степень гипертрофии, наблюдаемая после этапа 1 ALPPS, по-видимому, не сдерживается предоперационной химиотерапией, но данные противоречивы [44, 53, 54]. Точно так же данные об индексах пролиферации (индекс Ki67) противоречивы в литературе. В то время как Фуками и соавт. [55] обнаружили увеличение Ki67 с 60 до 80% между этапами 1 и 2 в ALPPS, Joechle et al. [56]. не выявили разницы в Ki67 между ALPPS и обычной гепатэктомией
Точно так же данные об индексах пролиферации (индекс Ki67) противоречивы в литературе. В то время как Фуками и соавт. [55] обнаружили увеличение Ki67 с 60 до 80% между этапами 1 и 2 в ALPPS, Joechle et al. [56]. не выявили разницы в Ki67 между ALPPS и обычной гепатэктомией
До сих пор остается предметом споров, является ли усиленное восстановление печени проклятием или благословением. Следует отметить, что некоторые авторы утверждают, что более низкая скорость гипертрофии может быть полезной не только из-за предполагаемого меньшего стимула роста опухоли, но также из-за более длительного времени ожидания между этапами, позволяющего лучше оценить рост опухоли и, следовательно, лучший отбор пациентов. .
Действительно, после ПВЭ/ПВЛ по отдельности или в комбинации на фоне ТТГ – причем последний имеет еще больше шансов обнаружить и удалить небольшие опухолевые отложения и метастазы на этапе 1 – до 24–41% пациентов не подвергаются 2 этап гепатэктомии, в основном в связи с прогрессированием заболевания [12, 13, 16]. В анализе Narita 80 предполагаемых и 61 выполненных ТТГ (уровень отсева 24%), более 2 CRLM, обнаруженных в FLR во время первого шага, были отрицательным предиктором недостижения второго шага [16].
В анализе Narita 80 предполагаемых и 61 выполненных ТТГ (уровень отсева 24%), более 2 CRLM, обнаруженных в FLR во время первого шага, были отрицательным предиктором недостижения второго шага [16].
При ALPPS временной интервал между этапами 1 и 2 обычно составляет всего 7–14 дней, что намного короче, чем при ТТГ. Этот интервал слишком короток, чтобы обнаружить вновь развивающиеся опухоли в FLR. Таким образом, практически всем больным выполняются оба этапа и достигается высокий показатель формально полных резекций. Это было показано как в данных реестра ALPPS, так и в недавно опубликованном первом РКИ, сравнивающем ALPPS и ТТГ при FLR <30% (исследование LIGRO). Частота резекций была значительно выше при ALPPS по сравнению с ТТГ (92 против 57%, p <0,0001) с сопоставимыми хирургическими краями и периоперационной заболеваемостью и смертностью [49].
По сравнению с ТТГ, выявление опухолевой прогрессии после ALPPS сместилось от межстадийного периода к постстадийному периоду, а это означает, что значительное число пациентов подвержены риску стадии 2, но уже имеют микрометастазы в FLR. Это подтверждается метаанализом, сравнивающим ALPPS и ТТГ, где, несмотря на более высокую частоту резектабельности при ALPPS, безрецидивная выживаемость одинакова в обеих группах [48].
Это подтверждается метаанализом, сравнивающим ALPPS и ТТГ, где, несмотря на более высокую частоту резектабельности при ALPPS, безрецидивная выживаемость одинакова в обеих группах [48].
Долгосрочные онкологические данные почти отсутствуют. В первоначальном отчете ALPPS 1-летняя и 2-летняя ОВ составляла 76 и 63% для CRLM соответственно [33]. Однако эти данные о выживаемости необходимо рассматривать в свете высокой исходной периоперационной смертности в 9% и, что еще более важно, с учетом того, что пациенты с ALPPS могли иметь более обширное поражение печени по сравнению с пациентами, перенесшими другие процедуры. В недавней серии из 2 крупных центров сообщалось о 3-летней общей выживаемости 50% после 58 APPPS для CRLM. В другом, по общему признанию, небольшом одноцентровом анализе только с 7 случаями сообщалось о 3-летней выживаемости даже 64% [57, 58].
До сих пор появилось лишь несколько серий, сравнивающих данные ALPPS и ТТГ, показывающие, при перекрестном рассмотрении, отсутствие различий в выживаемости [12, 59-61]. В то время как Адам и др. [12] сообщили о значительной разнице в медиане выживаемости (ALPPS 20 месяцев, ТТГ 37 месяцев), Ratti et al. [60]. и Камбакамба и др. [61] обнаружили аналогичную 1-летнюю выживаемость (94 против 92%) и среднюю выживаемость (24,7 + 2,3 против 29,3 + 5,1 месяца) соответственно, а также отсутствие различий в 1-летней безрецидивной выживаемости в обеих сериях.
В то время как Адам и др. [12] сообщили о значительной разнице в медиане выживаемости (ALPPS 20 месяцев, ТТГ 37 месяцев), Ratti et al. [60]. и Камбакамба и др. [61] обнаружили аналогичную 1-летнюю выживаемость (94 против 92%) и среднюю выживаемость (24,7 + 2,3 против 29,3 + 5,1 месяца) соответственно, а также отсутствие различий в 1-летней безрецидивной выживаемости в обеих сериях.
Уникальным во всех публикациях является тот факт, что пациенты, перенесшие стадию 1, но не завершившие стадию 2, имеют наихудший прогноз, даже хуже, чем только КТ [11, 12]. Это, вероятно, связано с отсроченным началом химиотерапии и/или ухудшением физического состояния после операции 1 этапа у этой подгруппы пациентов. Имея в виду плохую выживаемость, если этап 2 не завершен, неудивительно, что возникает вопрос, действительно ли отсев после первого этапа ТТГ является преимуществом для лучшего отбора, а не потерей шанса для пациента [62]. В этом анализе пары совпадений Vigano et al. [62] сравнили результаты ТТГ и одноэтапной гепатэктомии под ультразвуковым контролем в 2 крупных центрах хирургии печени. Двумя основными выводами были значительно более высокая частота отсева при ТТГ, чем при ОСГ (38,1 против 0%), и завершение резекции было единственным независимым прогностическим фактором [62]. Соответственно, кривые выживаемости после OSH и завершенного TSH были сопоставимы. Эти данные могут свидетельствовать о том, что стимуляция гипертрофии при наличии опухоли, как при ТТГ, не приводит к ухудшению исхода, если впоследствии удается добиться полного удаления опухоли. С другой стороны, эти результаты вовсе не исключают того, что усиление гипертрофии способствует росту опухоли, о чем свидетельствуют экспериментальные данные, в которых не наблюдалось прогрессирования роста опухоли при ALPPS на мышиной модели [63]. Однако данные все еще противоречивы и требуют дальнейшего изучения.
Двумя основными выводами были значительно более высокая частота отсева при ТТГ, чем при ОСГ (38,1 против 0%), и завершение резекции было единственным независимым прогностическим фактором [62]. Соответственно, кривые выживаемости после OSH и завершенного TSH были сопоставимы. Эти данные могут свидетельствовать о том, что стимуляция гипертрофии при наличии опухоли, как при ТТГ, не приводит к ухудшению исхода, если впоследствии удается добиться полного удаления опухоли. С другой стороны, эти результаты вовсе не исключают того, что усиление гипертрофии способствует росту опухоли, о чем свидетельствуют экспериментальные данные, в которых не наблюдалось прогрессирования роста опухоли при ALPPS на мышиной модели [63]. Однако данные все еще противоречивы и требуют дальнейшего изучения.
Безусловно, нам необходимо тщательно изучить и сравнить данные этого исследования, в частности, в отношении очень низкой частоты R0-резекций: 19% при ОШ и всего 15,9% при ТТГ. Примечательно, что медиана количества узлов составила 7 в обеих группах, при этом почти у 30% пациентов было более 10 метастазов, что является правилом, когда диффузное внутрипеченочное распространение является правилом и маловероятно достижение высоких показателей безопухолевой выживаемости. независимо от применяемой хирургической стратегии. В этих условиях вряд ли имеет значение, что частота R0-резекций низка, и совсем не удивительно, что общая и безрецидивная выживаемость аналогичны для OSH и завершенного TSH. В последующих отчетах с большим числом пациентов Torzilli et al. [17] может подтвердить, что паренхиматозное сохранение безопаснее, чем обширная гепатэктомия, с тенденцией даже к лучшей выживаемости [64, 65].
независимо от применяемой хирургической стратегии. В этих условиях вряд ли имеет значение, что частота R0-резекций низка, и совсем не удивительно, что общая и безрецидивная выживаемость аналогичны для OSH и завершенного TSH. В последующих отчетах с большим числом пациентов Torzilli et al. [17] может подтвердить, что паренхиматозное сохранение безопаснее, чем обширная гепатэктомия, с тенденцией даже к лучшей выживаемости [64, 65].
Прелесть этого подхода заключается в том, что наряду с предотвращением осложнений при второй или (в случае ЭВК) третьей операции/вмешательства минимизируется паренхиматозная потеря, но за счет высокого риска неполной резекции опухоли. Таким образом, концепция OSH бросает вызов основным правилам хирургии CRLM. Хотя в последние годы была отмечена потенциальная польза R1-резекции, в частности, при многоочаговом CRLM с хорошим ответом на химиотерапию, R0-резекция по-прежнему является стандартной целью хирургии CRLM [66, 67]. Однако при ОШ при мультифокальном CRLM широко применяется R1-резекция, тем более что отслойка метастазов от крупных сосудистых структур (сосудистый край R1) почти эквивалентна R0-резекции [68, 69]. ].
].
В отличие от этого, целью ТТГ является достижение R0-резекции, как и при ALPPS. В недавнем анализе достижение резекции R0 по-прежнему было 1 прогностическим фактором. Важно отметить, что край >1 мм связан с улучшением общей выживаемости, а край >1 см даже связан с улучшением безрецидивной выживаемости [70]. Излишне говорить, что при многочисленных метастазах вряд ли можно достичь запаса прочности в 1 см. Напротив, при ограниченном количестве метастазов, даже если они обширны, возможен более широкий запас прочности. Лучший онкологический результат может даже оправдать потерю большого количества паренхимы. Самые последние данные MD Anderson, показывающие 5-летнюю выживаемость 35% после ТТГ по сравнению с 23% ОСГ в ретроспективном анализе, подтверждают этот подход [71].
Для достижения свободных от опухоли краев резекции (R0-резекция) при ТТГ и ALPPS полное удаление опухоли из FLR на этапе 1 имеет первостепенное значение. Таким образом, количество и размер метастазов в FLR, по-видимому, имеют большее значение для успеха этих процедур, чем общая опухолевая масса [72].
Точная и всесторонняя характеристика и документирование не только количества, размера и распределения поражений в печени и FLR, но и других факторов, таких как вид и интенсивность предлечения онкологических заболеваний, молекулярные характеристики и т. д., помогут улучшить сравнительные исследования наших данных. В предварительном сообщении показано, что мутации KRAS связаны с худшей выживаемостью после резекции CRLM, в частности, также при ALPPS [73, 74]. Такое открытие улучшит наши критерии отбора и поможет избежать, скорее всего, бесполезной и рискованной операции. Кроме того, эти данные составляют основу для будущих исследований по дальнейшему сравнению OSH, TSH и ALPPS при лечении двустороннего CRLM.
Чтобы выяснить роль ALPPS, стоит рассмотреть, как изменились терапевтические возможности для пациентов с CRLM [32, 75]. Наряду с усовершенствованием хирургических методов, разработка эффективной химиотерапии наряду с таргетной терапией привела к гораздо более высокой частоте ответа и уменьшению размера опухоли. В настоящее время конверсионная терапия является одним из краеугольных камней в лечении CRLM. Эффективное уменьшение размера не только приводит к более высоким показателям резектабельности, но также приводит к большему количеству паренхиматозных резекций вместо обширных гепатэктомий. Нет сомнений в том, что с достижениями в области химиотерапии и биологических препаратов потребность в обширных гепатэктомиях при CRLM значительно уменьшилась. В настоящее время нередки случаи, когда пациенты переносят многочисленные операции/вмешательства/аблации в течение многих лет в сочетании с химиотерапией или с последующими периодами химиотерапии. Важно отметить, что все эти вмешательства и процедуры могут быть выполнены с низким уровнем осложнений, и в настоящее время общая операционная летальность после операций по поводу CRLM не превышает 2% в большинстве специализированных гепатобилиарных центров. Следует отметить, что рандомизированное сравнение только с паллиативной химиотерапией пока недоступно, и, безусловно, его будет трудно осуществить.
В настоящее время конверсионная терапия является одним из краеугольных камней в лечении CRLM. Эффективное уменьшение размера не только приводит к более высоким показателям резектабельности, но также приводит к большему количеству паренхиматозных резекций вместо обширных гепатэктомий. Нет сомнений в том, что с достижениями в области химиотерапии и биологических препаратов потребность в обширных гепатэктомиях при CRLM значительно уменьшилась. В настоящее время нередки случаи, когда пациенты переносят многочисленные операции/вмешательства/аблации в течение многих лет в сочетании с химиотерапией или с последующими периодами химиотерапии. Важно отметить, что все эти вмешательства и процедуры могут быть выполнены с низким уровнем осложнений, и в настоящее время общая операционная летальность после операций по поводу CRLM не превышает 2% в большинстве специализированных гепатобилиарных центров. Следует отметить, что рандомизированное сравнение только с паллиативной химиотерапией пока недоступно, и, безусловно, его будет трудно осуществить. Недавнее исследование на основе сопоставления случаев из регистра ALPPS сравнило неоперабельных «пациентов с ALPPS» с историческим контролем, получавшим паллиативную химиотерапию, и пришло к выводу о не превосходстве в раннем онкологическом исходе в группе ALPPS [76]. Однако следует отметить, что при медиане поражения 7 сегментов печени и медиане 4 поражений в FLR заболевание в хирургической группе было далеко зашедшим, скорее всего, слишком распространенным для хирургического доступа. Невозможно перехитрить биологию опухоли, и поэтому эти данные следует рассматривать как неудачу отбора пациентов, а не концепции ALPPS.
Недавнее исследование на основе сопоставления случаев из регистра ALPPS сравнило неоперабельных «пациентов с ALPPS» с историческим контролем, получавшим паллиативную химиотерапию, и пришло к выводу о не превосходстве в раннем онкологическом исходе в группе ALPPS [76]. Однако следует отметить, что при медиане поражения 7 сегментов печени и медиане 4 поражений в FLR заболевание в хирургической группе было далеко зашедшим, скорее всего, слишком распространенным для хирургического доступа. Невозможно перехитрить биологию опухоли, и поэтому эти данные следует рассматривать как неудачу отбора пациентов, а не концепции ALPPS.
Это признаки, по которым следует измерять ALPPS, и именно в этом контексте следует рассматривать ALPPS. Ввиду этого не представляется целесообразным рассматривать ALPPS, когда уже «установленный» традиционный хирургический доступ возможно [18, 75, 77]. Таким образом, ALPPS является последним средством в конце спектра лечения CRLM, и здесь, когда у пациентов нет хирургической альтернативы ALPPS, его онкологические результаты необходимо сравнивать с современной паллиативной химиотерапией отдельно или в сочетании с локорегионарной терапией.
В нашем собственном учреждении с начала нашей программы ALPPS в 2009 году из почти 800 резекций печени по поводу CRLM (почти половина из них по поводу двусторонних метастазов, общая периоперационная 90-дневная смертность ниже 1%) мы выполнили 8 ALPPS. , что составляет около 1% всех резекций только по поводу CRLM. ALPPS была выполнена в среднем через 7 месяцев химиотерапии (диапазон 4–11 месяцев), и все выполненные резекции представляли собой исключительно правостороннюю трисекционэктомию с дополнительным иссечением сегмента I (9).0149 n = 4) и удаление 1–3 метастазов за пределы FLR ( n = 4).
В заключение, ALPPS, несомненно, расширил хирургический арсенал для пациентов с CLRM, когда-то считавшихся нерезектабельными из-за высокой опухолевой нагрузки и небольшого FLRV, как показано в первом и пока единственном РКИ по ALPPS по сравнению с ТТГ. Однако польза от такого агрессивного подхода до сих пор неясна. Как и всегда в онкологической хирургии, биология является ключевой и вряд ли может быть преодолена, в частности, только хирургическим путем. Это особенно справедливо при многоочаговом или диффузном внутрипеченочном заболевании. Чтобы поместить ALPPS в этот контекст, нам нужно взвесить, что может быть достигнуто и получено с помощью хирургии в мультимодальной обстановке. Первоначальные опасения по поводу безопасности этой новой процедуры вызвали огромные усилия по снижению заболеваемости и улучшению периоперационных результатов. Благодаря техническим усовершенствованиям, в основном направленным на снижение заболеваемости после 1-й стадии и лучший отбор пациентов, общая заболеваемость и смертность улучшились и теперь сопоставимы с большими традиционными резекциями печени. Онкологическое значение в условиях раннего рецидива опухоли у значительного числа пациентов остается неясным, а онкологический исход у пациентов с далеко зашедшими двусторонними метастазами в печени, перенесших ALPPS, не лучше, чем у пациентов после ТТГ. Достоверное сравнение с ТТГ/ПВЭ отсутствует, так как единственное РКИ ALPPS по сравнению с ТТГ не принимало во внимание онкологический исход.
Это особенно справедливо при многоочаговом или диффузном внутрипеченочном заболевании. Чтобы поместить ALPPS в этот контекст, нам нужно взвесить, что может быть достигнуто и получено с помощью хирургии в мультимодальной обстановке. Первоначальные опасения по поводу безопасности этой новой процедуры вызвали огромные усилия по снижению заболеваемости и улучшению периоперационных результатов. Благодаря техническим усовершенствованиям, в основном направленным на снижение заболеваемости после 1-й стадии и лучший отбор пациентов, общая заболеваемость и смертность улучшились и теперь сопоставимы с большими традиционными резекциями печени. Онкологическое значение в условиях раннего рецидива опухоли у значительного числа пациентов остается неясным, а онкологический исход у пациентов с далеко зашедшими двусторонними метастазами в печени, перенесших ALPPS, не лучше, чем у пациентов после ТТГ. Достоверное сравнение с ТТГ/ПВЭ отсутствует, так как единственное РКИ ALPPS по сравнению с ТТГ не принимало во внимание онкологический исход. Ясно, что ALPPS не заменяет другие хирургические методы, но, безусловно, ALPPS занимает свое место в арсенале опытных хирургов печени. До тех пор, пока отсутствуют надежные данные об онкологических исходах, предпочтительным может быть стандартный ТТГ или предоперационный ИВЛ. TSH и ALPPS могут быть дополнительными стратегиями для резекции CRLM, при этом ALPPS зарезервирован для пациентов, у которых нет других хирургических вариантов, то есть после неудачной PVE или у пациентов с чрезвычайно низким FLR. В этих индивидуальных ситуациях и всегда в сочетании с мультимодальным лечением ALPPS может по-прежнему давать шанс на полное удаление опухоли и, таким образом, продлевает выживаемость и даже шанс на излечение.
Ясно, что ALPPS не заменяет другие хирургические методы, но, безусловно, ALPPS занимает свое место в арсенале опытных хирургов печени. До тех пор, пока отсутствуют надежные данные об онкологических исходах, предпочтительным может быть стандартный ТТГ или предоперационный ИВЛ. TSH и ALPPS могут быть дополнительными стратегиями для резекции CRLM, при этом ALPPS зарезервирован для пациентов, у которых нет других хирургических вариантов, то есть после неудачной PVE или у пациентов с чрезвычайно низким FLR. В этих индивидуальных ситуациях и всегда в сочетании с мультимодальным лечением ALPPS может по-прежнему давать шанс на полное удаление опухоли и, таким образом, продлевает выживаемость и даже шанс на излечение.
«Биология — это король, выбор случаев — это королева, а технические детали хирургических процедур — это принцы и принцессы…». [78]. Мы должны иметь это в виду, когда пытаемся определить роль ALPPS в лечении CRLM.
Авторское право: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование или любую систему хранения и поиска информации, без письменного разрешения издателя. .
.
Дозировка препарата: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор препарата и дозировка, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации. Тем не менее, в связи с продолжающимися исследованиями, изменениями в правительственных постановлениях и постоянным потоком информации, касающейся лекарственной терапии и реакций на лекарства, читателю настоятельно рекомендуется проверять вкладыш в упаковке для каждого лекарства на предмет любых изменений в показаниях и дозировке, а также для дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендуемый агент является новым и/или редко используемым лекарственным средством.
Отказ от ответственности: заявления, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и участникам, а не издателям и редакторам. Появление рекламы и/или ссылок на продукты в публикации не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности.




 ) Лечение пролапса свода влагалища после гистерэктомии: руководство №46 с зеленым верхом. http://www.rcog.uk/…../Руководство. Доступ с декабря 2009 г. по июнь 2010 г.
) Лечение пролапса свода влагалища после гистерэктомии: руководство №46 с зеленым верхом. http://www.rcog.uk/…../Руководство. Доступ с декабря 2009 г. по июнь 2010 г. Int Eurogynecol J Pelvic Floor Dysfunct 12:215–217, www.miklosandmoore.com/white.pages/uploads/graft/graft_3.pdf (по состоянию на июнь 2005 г.)
Int Eurogynecol J Pelvic Floor Dysfunct 12:215–217, www.miklosandmoore.com/white.pages/uploads/graft/graft_3.pdf (по состоянию на июнь 2005 г.)