Метод окрашивания: Окрашивание бактерий по Граму | справочник Пестициды.ru
Методы окраски
ОКРАСКА
МИКРООРГАНИЗМОВ — комплекс методов и
приемов, применяемый для изучения
морфологических свойств микроорганизмов.
В нативном (естественном) состоянии
бактерии имеют такой же коэффициент
преломления, как и стекло, поэтому они
невидимы под микроскопом. Благодаря О.
м. можно изучать их морфол. особенности,
что необходимо при проведении
бактериологического исследования.
Окрашивание бактерий производится как
для обнаружения их в исследуемом
материале при бактериоскопической
диагностике, так и для их идентификации
после выделения чистой культуры из
исследуемого материала при бактериол.
исследовании.
Приготовление
окрашенного препарата состоит из
следующих этапов: приготовление мазка,
его высушивание, фиксация и окраска.
Для приготовления мазка на середину
чистого предметного стекла наносят
небольшую каплю воды и с помощью
бактериальной петли помещают в нее
исследуемый материал. Материал равномерно
распределяют на стекле таким образом,
чтобы образовался тонкий мазок круглой
или овальной формы размером 1-2 см2. Затем
Затем
препарат высушивают либо при комнатной
температуре на воздухе, либо в струе
теплого воздуха высоко над пламенем
горелки. Высушенный мазок подвергают
фиксации, вследствие чего он прикрепляется
к стеклу (фиксируется), микробы
инактивируются и становятся безопасными,
возрастает их восприимчивость к окраске.
Применяют различные способы фиксации.
Наиболее простым и самым распространенным
способом является фиксация жаром —
нагреванием на пламени горелки (препарат
несколько раз проводят через наиболее
горячую часть пламени горелки). В нек-рых
случаях прибегают к фиксации препарата
этиловым или метиловым спиртом, ацетоном,
смесью равных объемов этилового спирта
и эфира (по Никифорову). После фиксации
производят окраску мазка. Наиболее
пригодными для окраски микробов являются
основные и нейтральные анилиновые
красители. Окрашенный препарат промывают
водой и высушивают. На высушенный мазок
наносят каплю иммерсионного масла и
микроскопируют, пользуясь иммерсионной
системой микроскопа.
Существуют
простые и сложные способы окрашивания
микробов. При простой окраске, к-рая
При простой окраске, к-рая
позволяет быстро изучить морфол.
особенности микробов, обычно используют
только один краситель, чаще всего
красного цвета — фуксин (окраска
производится в течение 1-2 мин) или синего
цвета — метиленовый синий (время обработки
мазка краской 3-5 мин). При сложных методах
окраски применяют два или более
контрастных красителя, протравы,
дифференцирующие вещества и др. Среди
сложных методов окраски различают
дифференциальные методы и методы,
предназначенные для выявления отдельных
структур клетки. К дифференциальным
методам относятся методы Грама и
Циля-Нельсена, позволяющие различать
по цвету микроорганизмы, сходные по
морфол. свойствам.
Метод
окраски по Граму — наиболее распространенный
сложный способ окраски. Бактерии в
зависимости от того, подвергаются они
окраске по этому методу или нет, разделяют
на две группы: грамположительные
(красящиеся по Граму) и грамотрицательные
(не красящиеся) Различие в окраске
обусловлено разным строением клеточной
стенки грамположительных и грамотрицательных
бактерий.
Методика
окраски по Граму заключается в
последовательной обработке фиксированного
мазка: окраске генцианвиолетом через
фильтровальную бумагу (1-2 мин), обработке
р-ром Люголя (1 мин), обесцвечивании
спиртом (1/2-1 мин — до отхождения фиолетовых
струек краски), промывании водой,
окрашивании фуксином (1-2 мин). Сущность
метода состоит в том, что грамположительные
бактерии удерживают комплекс краситель
— йод и не обесцвечиваются спиртом,
грамотрицательные не обладают этим
свойством, т. е. обесцвечиваются спиртом
(дифференцирующим веществом) и
докрашиваются фуксином. В результате
грамположительные бактерии приобретают
фиолетовый цвет, грамотрицательные —
красный.
Метод
Циля-Нельсена предназначен для
дифференциации кислотоустойчивых
бактерий (возбудителей туберкулеза и
лепры) от некислотоустойчивых. При
окраске по этому методу используют
карболовый фуксин Циля, серную к-ту
(дифференцирующее вещество) и метиленовый
синий. Кислотоустойчивые бактерии
окрашиваются в красный цвет карболовым
фуксином Циля и не обесцвечиваются
к-той, некислотоустойчивые теряют
красную окраску при обработке к-той и
докрашиваются метиленовым синим.
При изучении
структуры микробной клетки используют
целый ряд сложных методов. Так, для
выявления капсулы у бактерий применяют
метод Гинса, для обнаружения спор
бактерий — метод Ауески, зерна волютина
можно окрасить с помощью метода Нейссера.
Для выявления жгутиков используют
методы «сверхокраски», при к-рых
клетки и отдельные их структуры
увеличиваются в размерах и становятся
видимыми под световым микроскопом. К
методам «сверхокраски» относится,
в частности, метод серебрения по Морозову.
Он также может быть использован для
окрашивания спирохет и даже наиболее
крупных вирусов — вирусов оспы.
Универсальным
методом О. м. является окраска по
Романовскому-Гимзе (смесью азура, эозина
и метиленового синего). При окрашивании
простейших их цитоплазма приобретает
голубой цвет, а ядра — красно-фиолетовый.
Этот метод используют также при
исследовании риккетсий, хламидий,
спирохет, форменных элементов крови.
Методы окрашивания микроорганизмов
Простой
метод окраски.
При данном методе используют только
один краситель. На фиксированный
препарат, помещенный на мостике над
сливной чашкой, наливают раствор
метиленовой сини (окрашивают 4-5 мин),
либо карболовый фуксин Пфейффера (1-2
мин), либо карболовый генцианвиолет
(1-2 мин). Краску смывают водой из бутыли,
препарат высушивают фильтровальной
бумагой и наносят каплю иммерсионного
масла. Готовый препарат помещают на
предметный столик и микроскопируют.
Сложные
(дифференцирующие) методы окраски.
Они отличаются от простых методов тем,
что препарат окрашивают несколькими
красками, а в отдельных случаях используют
еще специальные реактивы (раствор
Люголя, кислоты и др.). Сложные методы
позволяют выявить наличие (или отсутствие)
отдельных структурных элементов и
некоторых органических соединений
клетки, чем и определяют тинкториальные
свойства каждого вида микроба.
Метод
окраски по Граму. Фиксированный
препарат окрашивают карболовым
генцианвиолетом в течение 2-3 мин.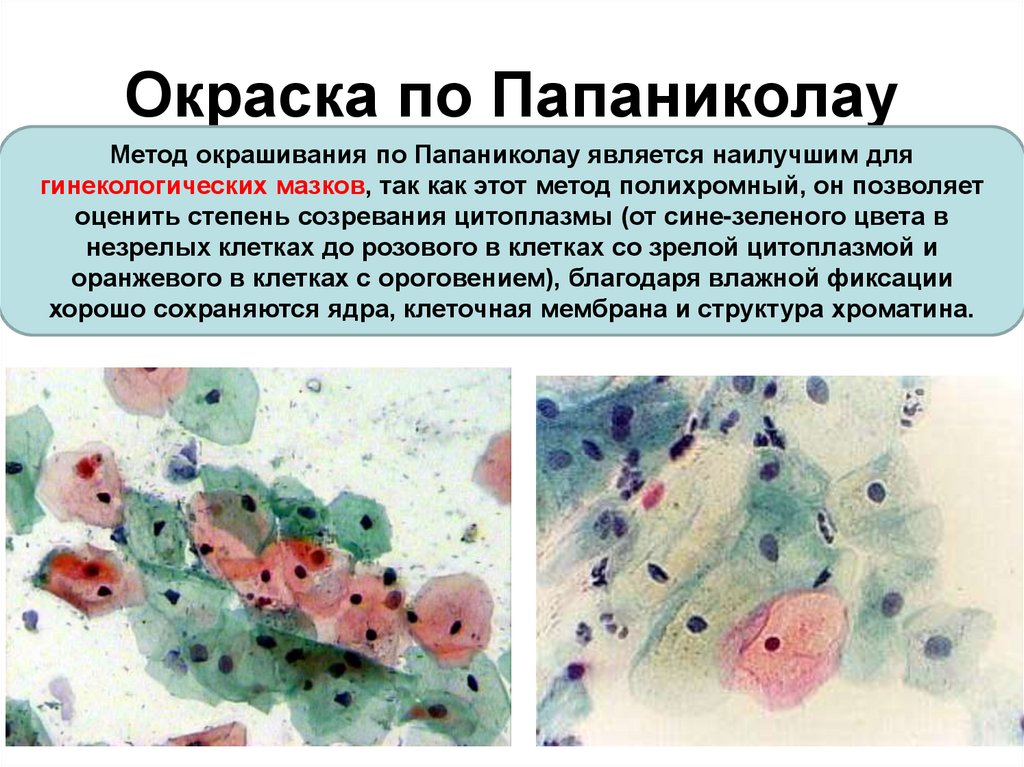 Не
Не
смывая водой, краску сливают и на 2-3 мин
на препарат наносят раствор Люголя
(йода кристаллического — 1 г; йодистого
калия как растворителя йода — 2 г;
дистиллированной воды — 300 мл). Раствор
Люголя сливают; препарат, не промывая
водой, обрабатывают 96% -ным спиртом в
течение 30 с, затем хорошо промывают
водой. После этого препарат дополнительно
окрашивают рабочим раствором фуксина
(до 1 мин), вновь промывают водой, сушат
фильтровальной бумагой и микроскопируют.
При
окраске по Граму одни виды бактерий не
обесцвечиваются спиртом после первичного
окрашивания и сохраняют фиолетовый
цвет; их называют грамположительными.
Другие
виды обесцвечиваются спиртом, а затем
воспринимают дополнительную окраску
фуксином и приобретают розово-красный
цвет; их называют грамотрицательными.
Окрашивание
по Граму обусловлено структурными
особенностями клеточной стенки у
грамположительных и грамотрицательных
групп микробов, длиной и формой ее пор,
неодинаковым химическим составом и
строением пептидогликанового слоя
клеточной стенки микроорганизмов.
Генцианвиолет (или кристаллвиолет) и
нуклеиновые кислоты цитоплазмы в
присутствии йода (раствор Люголя)
образуют прочный комплекс, нерастворимый
в воде и слаборастворимый в спирте.
Поэтому при действии спиртом в течение
30 с бактерии с многослойным пептидогликановым
каркасом (грамположительные) не
обесцвечиваются. У грамотрицательных
бактерий пептидогликановый слой имеет
более крупные поры, что облегчает
прохождение спирта; образовавшийся
комплекс разрушается, клетка
обесцвечивается.
Методы
окраски кислото-, спирто-, щелочеустойчивых
бактерий.
Микробы
данной группы (микобактерии туберкулеза,
паратуберкулезного энтерита крупного
рогатого скота, проказы человека и др.)
принадлежат к грамположительным
бактериям. Для их дифференциации
применяют специальные методы окрашивания,
основанные на различной химической
структуре цитоплазмы и клеточной
оболочки. В состав этих бактерий входит
значительное количество жиро-восковых
веществ, в частности стеариновых кислот
(в том числе фтионовой кислоты до 40%),
поэтому они трудно воспринимают краски.
Но если они окрасились при воздействии
протравителя, то трудно уже обесцвечиваются
кислотами, спиртами и щелочами.
Наиболее
распространенным методом окраски
бактерий данной группы является метод
Циля-Нильсена. На
фиксированный препарат кладут кусок
белой фильтровальной бумаги (для
предохранения от осадка), на него наливают
раствор карболового фуксина, снизу
препарат подогревают над пламенем до
появления паров и оставляют на «мостике»
(5-7 мин). Затем краску с бумажкой сливают
(не промывая) и обесцвечивают 3-5% -ным
раствором серной кислоты (5-7 с), хорошо
промывают водой и дополнительно
окрашивают метиленовой синью Леффлера
(4-5 мин). Далее препарат промывают водой
и высушивают фильтровальной бумагой.
Кислотоустойчивые (спирто-, щелочеустойчивые)
бактерии окрашиваются в красный цвет
(не обесцвечиваются кислотой), а
некислотоустойчивые — в синий, так как
легко окрасившись фуксином, они легко
обесцвечиваются кислотой и воспринимают
вторичную окраску синью.
Методы
окраски непостоянных элементов микробной
клетки. В
В
структуре микробной клетки различают
постоянные и непостоянные элементы.
Постоянные — это цитоплазма, оболочка,
ядерное вещество; непостоянные — спора,
капсула, жгутики, которые при определенных
условиях формируются лишь у бактерий
отдельных видов, поэтому служат видовым
признаком.
Окраска
спор.
Палочковидные микробы, образующие во
внешней среде (почве, воде, кормах, на
питательных средах) стойкую форму
существования — спору, называют
бациллами. При спорообразовании в клетке
происходят процессы, обусловливающие
сгущение цитоплазмы, уменьшение свободной
воды (до 40%). Цитоплазматическое содержимое
покрывается многослойными оболочками,
химический состав которых обеспечивает
высокую стойкость споры к нагреванию,
высушиванию, действию многих кислот,
щелочей, красителей. При законченном
спорообразовании спора лежит свободно,
без остатков вегетативной клетки; при
незаконченном процессе спора, в
зависимости от вида микроба, располагается
либо в центре клетки, либо на конце
(терминально), либо между концом и центром
клетки (субтерминально). При микроскопировании
При микроскопировании
препаратов, окрашенных простым методом
или по Граму, видна окрашенная вегетативная
часть клетки и неокрашенные, хорошо
преломляющие свет споры.
Метод
Ауески. Высушенный
на воздухе препарат, не фиксируя,
протравливают 0,5% -ной соляной кислотой
с подогреванием (2-3 мин), охлаждают,
промывают водой и фиксируют над пламенем.
Затем на препарат кладут кусочек
фильтровальной бумаги, наливают на него
карболовый фуксин Циля, окрашивают с
подогреванием до паров (7-8 мин), краску
сливают, препарат обрабатывают 5% -ным
раствором серной кислоты (5-7 с), хорошо
промывают водой. Дополнительно окрашивают
метиленовой синью (4-5 мин), опять промывают
водой и просушивают фильтровальной
бумагой. Микроскопируют под иммерсией:
вегетативная часть клетки — синяя,
споры — красные.
Метод
Меллера. Фиксированный
на пламени препарат протравливают 5%
-ной хромовой кислотой (2-3 мин), промывают
водой, просушивают фильтровальной
бумагой. Далее поступают, как в предыдущем
Далее поступают, как в предыдущем
методе. Результат окраски тот же:
вегетативная часть клетки — синяя,
споры — красные.
Метод
Златогорова. Процесс
окраски, как в предыдущих двух методах,
только без протравы. После окрашивания
вегетативная часть клетки — синяя,
споры — красные.
Метод
Пешкова. Мазок
фиксируют, красят метиленовой синью с
подогреванием до кипения, смывают.
Докрашивают 1%-ным водным раствором
нейтральрота (10 с), смывают, просушивают.
Споры окрашиваются в синий цвет,
вегетативные клетки — в красный.
Окраска
капсул. Капсула
— производное наружного слоя оболочки.
Представляет собой муциноподобное
вещество, высокомолекулярный полисахарид.
У патогенных капсулообразуюших бактерий
наличие капсулы наблюдают только в
инфицированном организме как защитное
приспособление против фагоцитоза (на
искусственных питательных средах
капсулы образуются лишь при добавлении
кровяной сыворотки или дефибринированной
крови). Капсулообразование отмечают у
Капсулообразование отмечают у
возбудителей сибирской язвы,
злокачественного отека, диплококковой
септицемии. Капсульное вещество плохо
окрашивается, поэтому для его выявления
применяют специальные методы окраски,
основанные на явлении метахромазии.
Метод
михина.
Фиксированный мазок из крови или препарат
отпечаток из ткани органа (печени,
селезенки, почки) окрашивают метиленовой
синью с подогреванием до появления
паров (5-7 мин). Краску сливают, быстро
промывают водой (можно не промывать),
просушивают фильтровальной бумагой.
Микробная клетка окрашивается в синий
цвет, капсула — в светло-розовый.
Метод
Романовского-Гимза. Фиксированный
препарат окрашивают, как было указано
выше: мазок-препарат помещают в чашку
Петри на стеклянные или деревянные
палочки отпечатком вниз, под препарат
подливают краску, окрашивают 40-50 мин.
Результат тот же, что и при окраске по
Михину: микробная клетка окрашивается
в синий цвет, капсула — в светло-розовый.
Метод
Ольта. Свежий
водный 2% -ный раствор сафранина наливают
на препарат и выдерживают 5-7 мин. Затем
слегка промывают водой и высушивают.
Вегетативная клетка — кирпично-красного
цвета, капсула — желто-оранжевого.
3.2B: Общие методы окрашивания — Биология LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 8820
- Безграничный
- Безграничный
Цели обучения
- Сравнить и сопоставить окрашивание in vitro и in vivo
Окрашивание — это метод, используемый в микроскопии для повышения контрастности микроскопического изображения. Пятна и красители часто используются для выделения структур микробов для просмотра, часто с помощью различных микроскопов. Окрашивание можно использовать для определения и исследования различных типов микробов, различных стадий клеточной жизни (например, митотического цикла) и даже органелл внутри отдельных клеток (например, митохондрий или хлоропластов).
Окрашивание можно использовать для определения и исследования различных типов микробов, различных стадий клеточной жизни (например, митотического цикла) и даже органелл внутри отдельных клеток (например, митохондрий или хлоропластов).
Окрашивание in-vivo — это процесс окрашивания живой ткани — in vivo означает «в жизни» (в отличие от окрашивания in-vitro ). Когда определенная клетка или структура приобретает контрастный цвет (цвета), ее форму (морфологию) или положение в клетке или ткани можно легко увидеть и изучить. Обычная цель состоит в том, чтобы выявить цитологические детали, которые в противном случае могли бы остаться незамеченными; однако окрашивание также может выявить, где в клетках происходят определенные химические вещества или конкретные химические реакции. Окрашивание In-vitro включает окрашивание клеток или структур, которые были удалены из их биологического контекста. Некоторые пятна часто комбинируются, чтобы выявить больше деталей и особенностей, чем одно пятно может выявить по отдельности, а контрастное окрашивание — это окрашивание, которое увеличивает видимость клеток или структур, когда основного окрашивания недостаточно. Ученые и врачи могут комбинировать окрашивание со специальными протоколами фиксации и подготовки образцов и могут использовать эти стандартные методы в качестве последовательных, воспроизводимых диагностических инструментов.
Ученые и врачи могут комбинировать окрашивание со специальными протоколами фиксации и подготовки образцов и могут использовать эти стандартные методы в качестве последовательных, воспроизводимых диагностических инструментов.
Существует невероятное количество красителей, которые можно использовать самыми разными способами. Ниже приведены некоторые общие аспекты процесса подготовки к окрашиванию in-vitro .
- Фиксация: Само по себе это может состоять из нескольких шагов. Фиксация направлена на то, чтобы максимально сохранить форму клеток (в данном случае микробов). Иногда используется тепловая фиксация, чтобы убить, склеить и изменить клетки, чтобы они принимали пятна. Большинство химических фиксаторов создают химические связи между белками и другими веществами в образце, увеличивая их жесткость. Обычные фиксаторы включают формальдегид, этанол, метанол и пикриновую кислоту.
- Пермеабилизация: включает обработку клеток (обычно) мягким поверхностно-активным веществом.
 Эта обработка растворяет клеточные мембраны, позволяя более крупным молекулам красителя проникать внутрь клетки.
Эта обработка растворяет клеточные мембраны, позволяя более крупным молекулам красителя проникать внутрь клетки. - Крепление: этот этап обычно включает в себя прикрепление образцов к предметному стеклу микроскопа для наблюдения и анализа. В некоторых случаях клетки можно выращивать прямо на предметном стекле. Образцы свободных клеток можно наносить непосредственно на предметное стекло.
В самом простом случае процесс окрашивания может включать погружение образца (до или после фиксации и заливки) в раствор красителя с последующим ополаскиванием и наблюдением. Однако многие красители требуют использования протравы — химического соединения, которое вступает в реакцию с пятном с образованием нерастворимого цветного осадка. Когда излишки раствора красителя смываются, протравное пятно остается. На этом этапе можно использовать невероятный набор красителей, от тех, которые окрашивают определенные типы микробов (см. рисунок ниже), до тех, которые выделяют субкомпартменты или органеллы клетки, такие как ядро или эндоплазматический ретикулум. В качестве альтернативы можно использовать негативное окрашивание. Это простой метод окрашивания бактерий, который заключается в нанесении клеток на предметное стекло с последующим нанесением нигрозина (черный синтетический краситель) или туши (водная суспензия углеродных частиц). После высыхания микроорганизмы можно рассматривать в светлопольной микроскопии, так как более светлые включения хорошо контрастируют с окружающей их темной средой
В качестве альтернативы можно использовать негативное окрашивание. Это простой метод окрашивания бактерий, который заключается в нанесении клеток на предметное стекло с последующим нанесением нигрозина (черный синтетический краситель) или туши (водная суспензия углеродных частиц). После высыхания микроорганизмы можно рассматривать в светлопольной микроскопии, так как более светлые включения хорошо контрастируют с окружающей их темной средой
Рисунок: Окраска хламидий : Клетки бактериального возбудителя хламидий (указаны стрелками) выделены окраской под названием «геймса. «
Живой, in-vivo Окрашивающая микроскопия во многом разделяет эти этапы, за исключением фиксации, которая неизменно убивает исследуемый микроб.
Ключевые моменты
- Окрашивание in vivo, которое визуализирует живые клетки, и окрашивание in vitro, которое визуализирует фиксированные клетки, имеют важное применение.
- Существует широкий спектр красителей, которые можно использовать для микробов, которые могут выделить почти любую характеристику клетки, даже органеллы внутри клетки.

- могут быть сложными, но в них есть несколько основных этапов: подготовка, фиксация, окрашивание и монтаж.
Протоколы окрашивания
Ключевые термины
- поверхностно-активное вещество : поверхностно-активный агент или смачивающий агент, способный снижать поверхностное натяжение жидкости; обычно органические соединения, имеющие гидрофильную «голову» и гидрофобный «хвост»
- органелла : специализированная структура, находящаяся внутри клеток, которая осуществляет определенный жизненный процесс (например, рибосомы, вакуоли)
ЛИЦЕНЗИИ И ПРАВА АВТОРСТВА
CC ЛИЦЕНЗИОННОЕ СОДЕРЖИМОЕ, КОНКРЕТНОЕ АВТОРСТВО
- Колледж OpenStax, биология. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44405/latest…ol11448/latest. Лицензия : CC BY: Attribution
- электрон.
 Предоставлено : Викисловарь. Расположен по адресу : en.wiktionary.org/wiki/electron. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Викисловарь. Расположен по адресу : en.wiktionary.org/wiki/electron. Лицензия : CC BY-SA: Attribution-ShareAlike - . Предоставлено : Викисловарь. Расположен по адресу : en.wiktionary.org/wiki/resolution. Лицензия : CC BY-SA: Attribution-ShareAlike
- Колледж OpenStax, изучение клеток. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44405/latest…1_01ab_new.jpg. Лицензия : CC BY: Attribution
- Окрашивание. Предоставлено : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Staining. Лицензия : CC BY-SA: Attribution-ShareAlike
- Окрашивание. Предоставлено : Википедия. Расположен по адресу : en.
 Wikipedia.org/wiki/Staining. Лицензия : CC BY-SA: Attribution-ShareAlike
Wikipedia.org/wiki/Staining. Лицензия : CC BY-SA: Attribution-ShareAlike - Окрашивание. Предоставлено : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Staining. Лицензия : CC BY-SA: Attribution-ShareAlike
- органелла. Предоставлено : Викисловарь. Расположен по адресу : en.wiktionary.org/wiki/organelle. Лицензия : CC BY-SA: Attribution-ShareAlike
- поверхностно-активное вещество. Предоставлено : Викисловарь. Расположен по адресу : en.wiktionary.org/wiki/surfactant. Лицензия : CC BY-SA: Attribution-ShareAlike
- Колледж OpenStax, изучение клеток. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44405/latest…1_01ab_new.
 jpg. Лицензия : CC BY: Attribution
jpg. Лицензия : CC BY: Attribution - Окрашивание хламидий Геймзы CDC. Предоставлено : Wikimedia. Расположен по адресу : commons.wikimedia.org/wiki/Fi…_Stain_CDC.jpg. Лицензия : Общественное достояние: Авторские права неизвестны
Разрешение
Эта страница под названием 3.2B: Общие методы окрашивания распространяется под лицензией CC BY-SA 4.0 и была создана, изменена и/или курирована компанией Boundless.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Безграничный
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать оглавление
- нет
- Теги
- Крепление
- Крепление
- Пермеабилизация
- окрашивание
Окрашивание по методу Гольджи-Кокса шаг за шагом
Введение
Изучение морфологии нейронов актуально как никогда, учитывая быструю идентификацию новых генетических заболеваний нервной системы с помощью подходов секвенирования следующего поколения и последующую необходимость понимания лежащих в их основе патомеханизмов. Обнаруженный еще Гольджи (1873 г.), неинвазивный метод окрашивания по Гольджи далеко не устарел и облегчает анализ морфологии нейронов с разветвлением аксонов и дендритов и шипами за счет визуализации лишь небольшого процента нейронов (1). –3%). Существуют три основных подтипа окрашивания по Гольджи: быстрое окрашивание Гольджи, Гольджи-Копша и Гольджи-Кокса (Koyama, 2013). Из них метод Гольджи-Кокса считается наиболее надежным для демонстрации разветвления дендритов на низком фоне (Buell, 19).82; Кояма, 2013). Было проведено множество модификаций этого метода, большинство из которых направлено на повышение его надежности (Angulo et al., 1996; Gibb and Kolb, 1998; Koyama and Tohyama, 2012), на сокращение необходимого времени (Ranjan and Mallick, 2010; Levine et al. al., 2013; Patro et al., 2013), а также для повышения селективности окрашивания нейронов по сравнению с глиальным окрашиванием или , наоборот, (Ranjan and Mallick, 2012; Gull et al., 2015). Кроме того, были разработаны коммерческие наборы для относительно быстрого постоянного окрашивания по Гольджи.
Обнаруженный еще Гольджи (1873 г.), неинвазивный метод окрашивания по Гольджи далеко не устарел и облегчает анализ морфологии нейронов с разветвлением аксонов и дендритов и шипами за счет визуализации лишь небольшого процента нейронов (1). –3%). Существуют три основных подтипа окрашивания по Гольджи: быстрое окрашивание Гольджи, Гольджи-Копша и Гольджи-Кокса (Koyama, 2013). Из них метод Гольджи-Кокса считается наиболее надежным для демонстрации разветвления дендритов на низком фоне (Buell, 19).82; Кояма, 2013). Было проведено множество модификаций этого метода, большинство из которых направлено на повышение его надежности (Angulo et al., 1996; Gibb and Kolb, 1998; Koyama and Tohyama, 2012), на сокращение необходимого времени (Ranjan and Mallick, 2010; Levine et al. al., 2013; Patro et al., 2013), а также для повышения селективности окрашивания нейронов по сравнению с глиальным окрашиванием или , наоборот, (Ranjan and Mallick, 2012; Gull et al., 2015). Кроме того, были разработаны коммерческие наборы для относительно быстрого постоянного окрашивания по Гольджи. Однако в большинстве описаний окрашивания по Гольджи отсутствуют точные детали отдельных этапов. Здесь мы подробно сообщаем обо всех этапах метода окрашивания Гольджи-Кокса на срезах вибратома мозга взрослых мышей, необходимых для надежного высококачественного окрашивания в приемлемые сроки и с хорошо сохранившимся качеством ткани. Используемые материалы доступны в большинстве нейробиологических лабораторий и достаточны для окрашивания по Гольджи-Коксу для многих образцов. Следование нашему протоколу шаг за шагом, скорее всего, сведет к минимуму часто возникающие проблемы и сократит время, необходимое для стандартизации этого метода.
Однако в большинстве описаний окрашивания по Гольджи отсутствуют точные детали отдельных этапов. Здесь мы подробно сообщаем обо всех этапах метода окрашивания Гольджи-Кокса на срезах вибратома мозга взрослых мышей, необходимых для надежного высококачественного окрашивания в приемлемые сроки и с хорошо сохранившимся качеством ткани. Используемые материалы доступны в большинстве нейробиологических лабораторий и достаточны для окрашивания по Гольджи-Коксу для многих образцов. Следование нашему протоколу шаг за шагом, скорее всего, сведет к минимуму часто возникающие проблемы и сократит время, необходимое для стандартизации этого метода.
Материалы, оборудование и поэтапные процедуры
Мыши
Взрослые 6-12-недельные мыши C57BL/6 были получены из виварии Charité—Universitätsmedizin Berlin, Germany. Все эксперименты проводились в соответствии с национальными этическими принципами (регистрационный № T0309.09).
Общие инструкции перед началом работы
1. Все стеклянные и пластиковые бутылки следует промыть свежей бидистиллированной водой (dd-H 2 ).О) перед использованием.
Все стеклянные и пластиковые бутылки следует промыть свежей бидистиллированной водой (dd-H 2 ).О) перед использованием.
2. Магнитные мешалки (стержни) с пластиковым покрытием могут использоваться для правильного растворения всех химических веществ в dd-H 2 O.
3. Следует избегать использования металлических инструментов на этапе пропитки.
4. Количество растворов и покрытых желатином предметных стекол должно быть приготовлено в соответствии с количеством образцов, указанным в каждом разделе.
5. Время инкубации, указанное для различных этапов в этом протоколе, представляет собой периоды, которые не оказывают существенного влияния на качество окрашивания. Таким образом, эти временные рамки обеспечивают некоторую гибкость при работе с протоколом.
6. Все растворы следует хранить в темном месте, накрывая алюминиевой фольгой большие флаконы или помещая маленькие флаконы в закрытый светонепроницаемый ящик.
7. Следует соблюдать осторожность со всеми растворами из-за токсичности и канцерогенеза: прямого контакта с кожей и вдыхания можно избежать, надев перчатки и проводя эксперименты под химическим колпаком соответственно.
Приготовление растворов
Раствор для пропитки образцов
Исходные растворы для пропитки готовят путем растворения 15 г следующих химических веществ в 300 мл dd-H 2 O (5% мас./об.) каждый:
1. Бихромат калия (K 2 Cr 2 O 7 ; 1.04862, Merck KGaA, Германия).
2. Хлорид ртути (HgCl 2 ; KK04.2, Carl Roth GmbH, Германия).
3. Хромат калия (K 2 CrO 4 ; HN33.2, Carl Roth GmbH, Германия).
Все три раствора, хранящиеся во флаконах при комнатной температуре в темноте, предназначены для длительного использования для приготовления раствора Гольджи-Кокса. Этих растворов достаточно для мозга 36 взрослых мышей. Раствор Гольджи-Кокса готовят для каждого эксперимента в новой бутылке с использованием трех исходных растворов, упомянутых выше, следующим образом (Rutledge et al., 19).69).
1. 50 мл раствора бихромата калия смешивают с 50 мл раствора сулемы.
2. Добавляют 40 мл раствора хромата калия.
3. Добавляется 100 мл dd-H 2 O.
После смешивания раствора бутылку необходимо накрыть алюминиевой фольгой и выдержать при комнатной температуре не менее 48 часов перед использованием, чтобы образовался осадок. Этого раствора достаточно для мозга шести взрослых мышей, и его можно использовать до 1 месяца.
Раствор для защиты тканей
Сначала готовят 0,1 М фосфатный буфер (pH 7,2) путем растворения следующих компонентов вместе в 500 мл dd-H 2 O:
1. 1,59 г моногидрата гидрофосфата натрия ( NaH 2 P0 4 ·H 2 0 (T878.3, Carl Roth GmbH, Германия).
2. 5,47 г безводного динатрийгидрофосфата (Na 2 HP0 4 ; P030.2, Carl Roth GmbH, Германия).
3. 9,0 г хлорида натрия (NaCl; 9265.1, Carl Roth GmbH, Германия).
Во-вторых, 1000 мл тканезащитного (криопротекторного) раствора (de Olmos et al., 1978; Watson et al. , 1986) готовят путем растворения в предшествующих 500 мл фосфатного буфера следующих компонентов:
, 1986) готовят путем растворения в предшествующих 500 мл фосфатного буфера следующих компонентов:
1. 300 г сахарозы (C 12 H 22 O 11 ; 1.07687, Merck KGaA, Германия).
2. 10 г поливинилпирролидона (PVP40, Sigma-Aldrich, Германия).
3. 300 мл этиленгликоля (C 2 H 6 О 2 ; E-9129, Sigma-Aldrich, Германия).
Затем окончательный объем доводят до 1000 мл с помощью dd-H 2 O. 500 мл раствора можно хранить в отдельной бутылке для заполнения камеры вибратома, а остатка достаточно для проведения этапа защиты тканей для 25 мозгов взрослых мышей. Этот раствор необходимо хранить при температуре 4 ° C в темноте для длительного хранения.
Растворы для этапа проявления
Для этапа проявления необходимо около 300 мл каждого из следующих растворов:
1. Серия 50, 70, 95 и 100% этанола (C 2 H 6 O; K928.4, Carl Roth GmbH, Германия).
2. Ксилол (C 8 H 10 ; 9713.3, Carl Roth GmbH, Германия).
Ксилол (C 8 H 10 ; 9713.3, Carl Roth GmbH, Германия).
3. Аммиак 3:1:dd-H 2 O получают путем смешивания 200 мл аммиака (NH 3 .H 2 O; 6774.2, Carl Roth GmbH, Германия) со 100 мл dd-H 2 O.
4. 5% тиосульфат натрия получают растворением 15 г тиосульфата натрия (Na 2 S 2 O 3 .5H 2 O; 2781895, Merck KGaA, Германия) в 300 мл dd-H 2 O.
Все растворы хранят при комнатной температуре, флакон с раствором тиосульфата натрия накрывают алюминиевой фольгой. Эти растворы можно использовать повторно, и их следует заменять, когда они становятся темными.
Растворы и материалы для покрытых желатином предметных стекол
Семьдесят пять простых предметных стекол (микропрепараты; 2406/1, Glaswarenfabrik Karl Hecht GmbH and Co KG) сначала помещают в три штатива для окрашивания (2285.1, Carl Roth GmbH, Германия), тщательно промывают dd-H 2 О и выдерживали для сушки в обеспыленном помещении (например, под химическим колпаком) в течение 2–3 ч. Тем временем готовят 3% желатин путем растворения 9 г желатина из свиной кожи (тип А; G2500, Sigma-Aldrich, Германия) в 300 мл dd-h3O при постоянном перемешивании и нагревании до 55°С. Затем раствор фильтруют через фильтровальную бумагу (240 мм; 4.303.240, Neolab, Германия) в чистый бокс для гистологического окрашивания (2285.1, Carl Roth GmbH, Германия). Штатив с очищенными предметными стеклами погружают в теплый раствор желатина на 10 мин, затем помещают на большое количество папиросной бумаги и оставляют на ночь при комнатной температуре в непыльном помещении. Желатин следует подогреть до 55°C, прежде чем погрузить в него еще одну подставку с предметными стеклами. Этих слайдов достаточно для срезов мозга толщиной 200 мкм, собранных из мозга шести взрослых мышей. Если требуется более трех штативов, необходимо приготовить больше 3% раствора желатина. Эти покрытые желатином предметные стекла необходимо хранить в закрытых коробках для гистологического окрашивания, и их лучше всего использовать в течение месяца после подготовки.
Тем временем готовят 3% желатин путем растворения 9 г желатина из свиной кожи (тип А; G2500, Sigma-Aldrich, Германия) в 300 мл dd-h3O при постоянном перемешивании и нагревании до 55°С. Затем раствор фильтруют через фильтровальную бумагу (240 мм; 4.303.240, Neolab, Германия) в чистый бокс для гистологического окрашивания (2285.1, Carl Roth GmbH, Германия). Штатив с очищенными предметными стеклами погружают в теплый раствор желатина на 10 мин, затем помещают на большое количество папиросной бумаги и оставляют на ночь при комнатной температуре в непыльном помещении. Желатин следует подогреть до 55°C, прежде чем погрузить в него еще одну подставку с предметными стеклами. Этих слайдов достаточно для срезов мозга толщиной 200 мкм, собранных из мозга шести взрослых мышей. Если требуется более трех штативов, необходимо приготовить больше 3% раствора желатина. Эти покрытые желатином предметные стекла необходимо хранить в закрытых коробках для гистологического окрашивания, и их лучше всего использовать в течение месяца после подготовки.
Стадия пропитки
Для каждого образца мозга одну маленькую бутылочку (многоцелевой контейнер с крышкой; 203170, Greiner bio-one, Германия) промывают dd-H 2 O. Алюминиевую фольгу осторожно удаляют из Флакон Гольджи-Кокса, не встряхивая, во избежание смешивания раствора с коричневатым осадком на дне флакона. Для каждого образца берут 10 мл из верхней прозрачной части раствора Гольджи-Кокса и разливают в каждую маленькую бутылочку.
После вывиха шейки мозга быстро, но осторожно рассекают мозг, промывают dd-H 2 O, и разрезать на две половинки для лучшей пропитки. Затем каждую половину переносят в отдельную бутылочку с раствором Гольджи-Кокса (рис. 1А) и хранят при комнатной температуре в темноте. Фиксации или перфузии 4% PFA мозга взрослых следует избегать, потому что это приводит к чрезмерному импрегнированию нейронов, что делает невозможным исследование нейрональной ветвления. Через 24 часа каждый образец мозга переносят в новую маленькую бутылочку с раствором Гольджи-Кокса с помощью пластиковых щипцов или, что предпочтительнее, путем заливки раствора и образца в гистологические кассеты (Rotilabo 9). кассеты для заливки 0454 ® ; K114.1, Carl Roth GmbH, Германия), как показано на рисунках 1B–E. Флаконы выдерживают при комнатной температуре в темноте в течение 7–10 дней.
кассеты для заливки 0454 ® ; K114.1, Carl Roth GmbH, Германия), как показано на рисунках 1B–E. Флаконы выдерживают при комнатной температуре в темноте в течение 7–10 дней.
Рис. 1. Этап пропитки. Образец мозга хранится в растворе Гольджи-Кокса при комнатной температуре в темноте (A) . Через 24 часа образец переносят в новую бутыль с раствором Гольджи с помощью гистологической кассеты, как показано на серийных фотографиях (B–E) , и оставляют отстаиваться при комнатной температуре в темноте в течение 7–10 дней. .
Этап защиты тканей
Для каждого образца мозга одну маленькую бутылочку, как описано выше, промывают dd-H 2 O и наполняют 10 мл раствора для защиты тканей. С помощью гистологических кассет, как описано выше, каждый образец мозга переносят из раствора Гольджи-Кокса в раствор для защиты тканей (рис. 2А, В) и хранят при 4°С в темноте. Через 24 часа каждый образец мозга переносят в новую маленькую бутылочку с 10 мл раствора для защиты тканей (рис. 2С). Бутылочки выдерживают при 4°С в темноте в течение 4–7 дней.
2С). Бутылочки выдерживают при 4°С в темноте в течение 4–7 дней.
Рисунок 2. Этап защиты тканей. Образец мозга переносят из раствора для пропитки Гольджи-Кокса в новую бутылку с раствором для защиты тканей и хранят при 4°C в темноте (A,B) . Через 24 часа раствор для защиты тканей заменяют свежим раствором в новой бутылке (C) .
Этап создания срезов
В ходе нашей процедуры вибратом (Microm; HM_650V, Thermo Fisher Scientific Inc., Германия) использовался для срезов тканей, как описано ниже и показано на рис. описано в протоколе коммерчески доступного красителя FD Rapid GolgiStain 9.0454™ Kit (FD Neurotechnologies, Inc., Мэриленд, США). Для срезов с помощью вибратома готовят 4% агарозу путем растворения 2 г агарозы с низкой температурой плавления (V2111, Promegain, WI, USA) в 50 мл dd-h3O, сначала перемешивая, а затем используя микроволновую печь до полного растворения. Затем образцы мозга аккуратно высушивают на папиросной бумаге с помощью гистологических кассет, как описано выше, и переносят в одноразовые пластиковые формы для заливки (18646A, Polysciences Inc. , PA, USA; рисунок 3A). Когда температура агарозы остынет до 47°С, ее разливают по формам до тех пор, пока образцы мозга не будут хорошо покрыты раствором. Ориентацию мозга необходимо отрегулировать с помощью наконечника пипетки, сохраняя медиальную сторону среза мозга в нижней части формы (рис. 3B). Если для срезов требуется самая медиальная часть образца мозга, на дно формы следует налить тонкий слой агарозы, а затем форму следует выдержать при температуре 4°C для затвердевания. Затем образец мозга может быть перенесен, как описано выше. После полного затвердевания агарозы края форм обрезаются с помощью лезвия бритвы, а излишки агарозы вокруг образца мозга обрезаются (рис. 3C-E).
, PA, USA; рисунок 3A). Когда температура агарозы остынет до 47°С, ее разливают по формам до тех пор, пока образцы мозга не будут хорошо покрыты раствором. Ориентацию мозга необходимо отрегулировать с помощью наконечника пипетки, сохраняя медиальную сторону среза мозга в нижней части формы (рис. 3B). Если для срезов требуется самая медиальная часть образца мозга, на дно формы следует налить тонкий слой агарозы, а затем форму следует выдержать при температуре 4°C для затвердевания. Затем образец мозга может быть перенесен, как описано выше. После полного затвердевания агарозы края форм обрезаются с помощью лезвия бритвы, а излишки агарозы вокруг образца мозга обрезаются (рис. 3C-E).
Рис. 3. Шаг разделения. Образец мозга помещают в 4% агарозу с низкой температурой плавления. После выливания раствора агарозы на головной мозг и, таким образом, в форму для заливки, необходимо отрегулировать положение головного мозга, удерживая срез на дне формы с помощью наконечника пипетки (A, B) . После полного затвердевания агарозы форму обрезают по краям, затем по бокам, а излишки агарозы вокруг образца дополнительно обрезают лезвием бритвы 9.0063 (C–E) . Обрезанный агарозный блок закрепляют на пластине вибратома (F, G) , а пластину помещают в камеру вибратома, которую затем наполняют раствором для защиты тканей до тех пор, пока блок агарозы не будет полностью покрыт (H, I ) . С помощью толстой щетки из камеры вибратома собирают срезы и переносят на предметные стекла, покрытые желатином (J–L) . Избыток тканезащитного раствора вокруг срезов удаляют салфеткой, а срезы наносят на предметные стекла, прикладывая прямое умеренное давление вниз ребром ладони (М–О) .
После полного затвердевания агарозы форму обрезают по краям, затем по бокам, а излишки агарозы вокруг образца дополнительно обрезают лезвием бритвы 9.0063 (C–E) . Обрезанный агарозный блок закрепляют на пластине вибратома (F, G) , а пластину помещают в камеру вибратома, которую затем наполняют раствором для защиты тканей до тех пор, пока блок агарозы не будет полностью покрыт (H, I ) . С помощью толстой щетки из камеры вибратома собирают срезы и переносят на предметные стекла, покрытые желатином (J–L) . Избыток тканезащитного раствора вокруг срезов удаляют салфеткой, а срезы наносят на предметные стекла, прикладывая прямое умеренное давление вниз ребром ладони (М–О) .
С помощью одной капли быстрого клея (Instant Adaptive; E10C589, Best-CA, Германия) образец мозга фиксируется на пластине вибратома (рис. 3F, G), и пластина помещается в камеру вибратома. Затем камеру вибратома заполняют раствором для защиты тканей и вставляют режущее лезвие (Sward Classic, 7000115z, Wilkinson GmbH, Германия) (рис. 3H, I). В наших руках лучше всего работает частота вибрации 60 Гц и скорость до 15 мм/с, но эти значения можно изменить в зависимости от качества резки. Оптимальная толщина среза составляет 200 мкм для исследований разветвления дендритов и 100 мкм для исследований дендритных шипов. При разрезании срезы собирают толстой щеткой и переносят на предметные стекла, покрытые желатином (рис. 3J–L). Как только все срезы были загружены на предметные стекла, излишки тканезащитного раствора вокруг срезов удаляются абсорбирующей бумагой (рис. 3М). Затем срезы промокают, прижимая к предметным стеклам впитывающую бумагу, смоченную раствором для защиты тканей. Наилучший способ, как было описано ранее, заключается в прямом умеренном надавливании вниз основанием ладони (Gibb and Kolb, 19).98; Фигуры 3Н,О). Если срезы прилипают к впитывающей бумаге, вероятно, бумага недостаточно пропитана раствором для защиты тканей. Предметные стекла со срезами перекладывают на штативы и выдерживают для сушки в темноте в течение 2–3 сут.
3H, I). В наших руках лучше всего работает частота вибрации 60 Гц и скорость до 15 мм/с, но эти значения можно изменить в зависимости от качества резки. Оптимальная толщина среза составляет 200 мкм для исследований разветвления дендритов и 100 мкм для исследований дендритных шипов. При разрезании срезы собирают толстой щеткой и переносят на предметные стекла, покрытые желатином (рис. 3J–L). Как только все срезы были загружены на предметные стекла, излишки тканезащитного раствора вокруг срезов удаляются абсорбирующей бумагой (рис. 3М). Затем срезы промокают, прижимая к предметным стеклам впитывающую бумагу, смоченную раствором для защиты тканей. Наилучший способ, как было описано ранее, заключается в прямом умеренном надавливании вниз основанием ладони (Gibb and Kolb, 19).98; Фигуры 3Н,О). Если срезы прилипают к впитывающей бумаге, вероятно, бумага недостаточно пропитана раствором для защиты тканей. Предметные стекла со срезами перекладывают на штативы и выдерживают для сушки в темноте в течение 2–3 сут.
После завершения срезов всех образцов раствор тканезащиты в камере вибратома можно отфильтровать через фильтровальную бумагу (240 мм; 4.303.240, Neolab, Германия) во флакон, хранить при 4°С в темноте и на открытом воздухе. -использовалась несколько раз. Однако этот отфильтрованный раствор для защиты тканей следует использовать только для заполнения камеры вибратома, а не для этапа защиты тканей.
Стадия проявки
С помощью обычных боксов для гистологического окрашивания штативы с предметными стеклами обезвоживают и проявляют следующим образом (рис. 4):
1. Дистиллированная вода дважды по 5 мин.
2. 50% этанол в течение 5 мин.
3. Раствор аммиака 3:1 на 8 мин.
4. Дистиллированная вода дважды по 5 мин.
5. 5% тиосульфат натрия на 10 мин в темноте.
6. Дистиллированная вода дважды по 1 мин.
7. При желании срезы можно инкубировать в 1% растворе крезилвиолета (в качестве контрастного красителя) в течение 5 мин.
8. 70, 95 и 100% этанол по 6 мин.
9. Ксилол на 6 мин, и срезы могут оставаться в ксилоле дольше до этапа монтажа.
Рис. 4. Этап проявления. После сушки срезы переносят на штативы для окрашивания (A,B) и проявляют, как описано в тексте рукописи (C) .
Мы обнаружили, что этих шагов достаточно для получения хороших результатов; однако последние два этапа (дегидратация этанолом и очистка ксилолом) могут быть продублированы для дальнейшего улучшения качества.
Этап монтажа
Для монтажа из коробки с ксилолом берут только два предметных стекла на каждый этап и выдерживают около 1 мин, пока они не станут полусухими. В зависимости от толщины срезов добавляют от 5 (для срезов толщиной 100 мкм) до 10 (для срезов толщиной 200 мкм) капель Eukitt (быстротвердеющая монтажная среда; 03989, Fluka Analytical, Германия). Затем предметные стекла накрывают покровным стеклом и удаляют пузырьки воздуха, применяя легкое давление. После завершения монтажа всех образцов предметные стекла запечатываются лаком для ногтей. Затем слайды выдерживают в горизонтальном положении для сушки в темноте в течение 48 ч перед визуализацией. Впоследствии срезы можно хранить в ящиках для предметных стекол в темноте при комнатной температуре для длительного использования.
После завершения монтажа всех образцов предметные стекла запечатываются лаком для ногтей. Затем слайды выдерживают в горизонтальном положении для сушки в темноте в течение 48 ч перед визуализацией. Впоследствии срезы можно хранить в ящиках для предметных стекол в темноте при комнатной температуре для длительного использования.
Визуализация
В нашей лаборатории изображения в светлом поле Z-stack с интервалом 1 мкм для изучения ветвления дендритов являются оптимальными в наших руках и получены с помощью микроскопа Olympus IX81, оснащенного камерой F View II (sw) (Soft Imaging System). GmbH, Мюнстер, Германия). Изображения в светлом поле дендритных шипов получены с помощью микроскопа Olympus BX60 с камерой Axiocam MRc Zeiss и программным обеспечением Axiovision 4.8 (Zeiss, Геттинген, Германия). Все изображения обрабатываются с помощью Adobe Photoshop CS6 версии 13.0×64 и программного обеспечения ImageJ. Увеличение и качество изображений позвоночника можно повысить с помощью подключаемого модуля Transform J Scale, доступного для программного обеспечения ImageJ.
Результаты и обсуждение
Мы подробно описываем протокол окрашивания по методу Гольджи-Кокса, начиная с приготовления растворов, переноса ткани головного мозга, создания срезов ткани и проявления до монтажа окрашенных срезов. Используя этот протокол, мы обнаружили, что дендритное дерево и дендритные шипы нейронов равномерно и постоянно окрашиваются во всех областях мозга (рис. 5). Кроме того, в то время как большинство исследований, основанных на Гольджи, сообщают об использовании коронарных срезов, мы обнаружили, что разветвление нейронов лучше всего сохраняется и визуализируется, когда мозг разрезается в сагиттальной плоскости, как также отмечает Вальверде (19).98). Мы также обнаружили, что раствор тканезащитного (криопротекторного) средства (de Olmos et al., 1978; Watson et al., 1986) очень полезен для сохранения качества ткани, уменьшения фона окрашивания и улучшения прикрепления срезов к желатину. слайды с покрытием. В наш протокол можно добавить небольшие дополнительные шаги, чтобы изменить его для более молодых мышей (Koyama and Tohyama, 2012) или увеличить окрашивание клеток глии в большей степени, чем нейронов (Ranjan and Mallick, 2012; Gull et al. , 2015). Используя наш протокол, мы обнаружили, что первоначальная краткая фиксация образцов мозга 4% PFA в течение 1 ч с последующей dd-H 2 O промывание улучшает окрашивание у более молодых мышей (рис. 6). Как только все химические вещества и материалы будут доступны в лаборатории, окрашивание по Гольджи можно будет проводить для большого количества образцов мозга, что снижает общую стоимость, необходимую для выполнения этого окрашивания.
, 2015). Используя наш протокол, мы обнаружили, что первоначальная краткая фиксация образцов мозга 4% PFA в течение 1 ч с последующей dd-H 2 O промывание улучшает окрашивание у более молодых мышей (рис. 6). Как только все химические вещества и материалы будут доступны в лаборатории, окрашивание по Гольджи можно будет проводить для большого количества образцов мозга, что снижает общую стоимость, необходимую для выполнения этого окрашивания.
Рис. 5. Окрашивание по Гольджи-Коксу мозга взрослых мышей. Нейроны во всех областях мозга равномерно и надежно окрашиваются с помощью описанного здесь протокола Гольджи-Кокса (A) . Увеличенные изображения коры головного мозга (B,C) , гиппокамп (D) и кора мозжечка (E) . Дендритные шипы также можно визуализировать при гораздо большем увеличении (F) . (Окрашивание по Гольджи, изображения ДИК, масштабные линейки 500 мкм в (A, B) , 50 мкм в (E) и 5 мкм в (F) ).
Рис. 6. Окрашивание по Гольджи-Коксу развивающегося мозга мыши. Импрегнирование нейронов развивающегося мозга мыши может быть улучшено после кратковременной фиксации 4% PFA, как показано для P0 (A) , P5 (B) , P7 (C) и P10 (D) . (окрашивание по Гольджи, изображения ДИК, масштабная линейка 50 мкм).
Заключение
Применение этого протокола делает окрашивание по Гольджи легко выполнимым для всех лабораторий, работающих над проектами в области неврологии.
Вклад авторов
SZ провел эксперименты. СЗ и АМК отвечали за концепцию проекта и написали, а также утвердили окончательный вариант рукописи.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Работа выполнена при поддержке Немецкого исследовательского фонда (DFG, SFB665), Ассоциации Гельмгольца Берлинского института здравоохранения (BIH), Немецкой службы академических обменов (DAAD) и Charité – Universitätsmedizin Berlin. Мы благодарим Ютту Шулер из нашего института за консультацию по микроскопии и Эмму Перес-Костас (кафедра психологии и кафедра педиатрии; Алабамский университет в Бирмингеме) за техническую консультацию.
Мы благодарим Ютту Шулер из нашего института за консультацию по микроскопии и Эмму Перес-Костас (кафедра психологии и кафедра педиатрии; Алабамский университет в Бирмингеме) за техническую консультацию.
Ссылки
Ангуло А., Фернандес Э., Мерчан Дж. А. и Молина М. (1996). Надежный метод окрашивания по Гольджи срезов сетчатки и головного мозга. J. Neurosci. Методы 66, 55–59. doi: 10.1016/0165-0270(95)00160-3
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Buell, SJ (1982). Методы Гольджи-Кокса и экспресс-методы Гольджи применительно к аутопсии ткани головного мозга человека: результаты сильно различаются. Дж. Невропатол. Эксп. Нейрол. 41, 500–507. дои: 10.1097/00005072-198209000-00003
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
де Олмос Дж., Харди Х. и Хеймер Л. (1978). Афферентные связи основных и добавочных образований обонятельных луковиц у крыс: экспериментальное ПХ-исследование. J. Комп. Нейрол. 81, 213–244. doi: 10.1002/cne.0202
J. Комп. Нейрол. 81, 213–244. doi: 10.1002/cne.0202
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Гибб Р. и Колб Б. (1998). Метод вибратомного среза окрашенного по Гольджи-Коксу целого головного мозга крысы. J. Neurosci. Методы 79, 1–4. doi: 10.1016/s0165-0270(97)00163-5
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Гольджи, К. (1873 г.). Sulla struttura della sostanza grigia della cervello. Газз. Мед. итал. Ломбардия. 6, 244–246.
Гулл С., Ингриш И., Тауш С., Витте О.В. и Шмидт С. (2015). Стабильное и воспроизводимое окрашивание глии модифицированным методом Гольджи-Кокса. J. Neurosci. Методы 256, 141–150. doi: 10.1016/j.jneumeth.2015.08.029
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Кояма Ю. (2013). Бесконечное увлечение методом Гольджи. О.А. Анатомия 1:24. doi: 10.13172/2052-7829-1-3-848
CrossRef Full Text
Koyama, Y. , and Tohyama, M. (2012). Модифицированный и высокочувствительный метод Гольджи-Кокса, обеспечивающий полную и стабильную импрегнацию эмбриональных нейронов. J. Neurosci. Методы 209, 58–61. doi: 10.1016/j.jneumeth.2012.06.007
, and Tohyama, M. (2012). Модифицированный и высокочувствительный метод Гольджи-Кокса, обеспечивающий полную и стабильную импрегнацию эмбриональных нейронов. J. Neurosci. Методы 209, 58–61. doi: 10.1016/j.jneumeth.2012.06.007
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Левин, Н. Д., Радемахер, Д. Дж., Коллиер, Т. Дж., О’Мэлли, Дж. А., Келлс, А. П., Сан-Себастьян, В., и др. (2013). Достижения в области импрегнации тонких тканей методом Гольджи-Кокса: быстрые и надежные методы мультианализа мозга грызунов и приматов. J. Neurosci. Методы 213, 214–227. doi: 10.1016/j.jneumeth.2012.12.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Патро Н., Кумар К. и Патро И. (2013). Быстрый метод Гольджи: изменен для большей четкости и лучшей анатомии нейронов. Индийский Дж. Эксп. биол. 51, 685–693. doi: 10.13172/2052-7829-1-3-848
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ранджан А.

 Эта обработка растворяет клеточные мембраны, позволяя более крупным молекулам красителя проникать внутрь клетки.
Эта обработка растворяет клеточные мембраны, позволяя более крупным молекулам красителя проникать внутрь клетки.
 Предоставлено : Викисловарь. Расположен по адресу : en.wiktionary.org/wiki/electron. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Викисловарь. Расположен по адресу : en.wiktionary.org/wiki/electron. Лицензия : CC BY-SA: Attribution-ShareAlike  Wikipedia.org/wiki/Staining. Лицензия : CC BY-SA: Attribution-ShareAlike
Wikipedia.org/wiki/Staining. Лицензия : CC BY-SA: Attribution-ShareAlike  jpg. Лицензия : CC BY: Attribution
jpg. Лицензия : CC BY: Attribution