Кератинизация кожи: Кератин и кератинизация, этапы процесса, причины нарушения.
Кератин и кератинизация, этапы процесса, причины нарушения.
Кератин — семейство фибриллярных белков, обладающих механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину в составе которого есть самые маленькие аминокислоты – глицин и аланин, обладающие хорошей проникающей способностью.
Кератинизация – это процесс отмирания и ороговения клеток в эпидермальном слое кожи. Кератин и жиры, которые выталкиваются на поверхность кожи в роговой слой, придают ей прочность, эластичность и способность защититься от внешней агрессивной среды, механических и химических повреждений.
Рассмотрим цикл кератизации кожи поэтапно.
На первом этапе в базальном слое эпидермиса происходит рождение клеток. По мере старения, клетки эпидермиса переходят в верхние слои, происходит постепенное исчезновение их функциональных элементов (ядра и органелл), и заполнение всего пространства клетки, ограниченного мембраной, кератином. Слой эпидермиса, в который переходят кератиноциты после базального, называется шиповатый из-за увеличения количества структурных элементов, связывающих клетки друг с другом. Для удержания кератиноцитов между собой, гранулами, образовавшимися в клетках, в межклеточное пространство выделяется особый межклеточный «цемент». При переходе ороговевающих клеток в зернистый слой, в них окончательно гибнут ядро и органеллы, а мембрана утолщается. В зернистом слое кератин теряет водорастворимость и уплотняется из-за присутствия в этом слое специфического белка филагрина. В роговом, последнем слое эпидермиса клетки приобретают плоскую форму и плотно прилегают друг к другу. Филагрин распадается на аминокислоты, выполнив свои функции, что очень важно для поддержания поверхностного тургора кожи, ее естественной увлажненности и защиты от свободных радикалов, которые образуются под воздействием УФ излучения.
Слой эпидермиса, в который переходят кератиноциты после базального, называется шиповатый из-за увеличения количества структурных элементов, связывающих клетки друг с другом. Для удержания кератиноцитов между собой, гранулами, образовавшимися в клетках, в межклеточное пространство выделяется особый межклеточный «цемент». При переходе ороговевающих клеток в зернистый слой, в них окончательно гибнут ядро и органеллы, а мембрана утолщается. В зернистом слое кератин теряет водорастворимость и уплотняется из-за присутствия в этом слое специфического белка филагрина. В роговом, последнем слое эпидермиса клетки приобретают плоскую форму и плотно прилегают друг к другу. Филагрин распадается на аминокислоты, выполнив свои функции, что очень важно для поддержания поверхностного тургора кожи, ее естественной увлажненности и защиты от свободных радикалов, которые образуются под воздействием УФ излучения.
Таким образом, кератинизация – это последовательный, послойный процесс в эпидермисе, протекающий с образованием веществ, защищающих кожу от воздействия неблагоприятных внешних факторов.
С возрастом, при условии плохой наследственности, приема определенных препаратов, наличия хронических болезней, или негативного воздействия внешней среды — может быть нарушен процесс кератинизиции кожи. Например, может увеличиться выработка кожного сала, который забивает поры. В таких условиях будет меняться кислотность кожи — pH, что в свою очередь, может повышать риск появления на поверхности кожи бактерий и различных заболеваний (кератозы, дерматозы, ихтиозы). Кожа может стать сухой, шелушиться и давать неприяные ощущения, например зуд. Это происходит за счет склейки кератиноцитов — клеток, которые вырабатывают кератин. В данном случае области кожи даже могут давать трещины и болеть, что еще больше повышает риск появления инфекций.
Из-за разного вида провоцирующих факторов могут образовываться кератомы — доброкачественные образования. Оно чаще всего появляется при уплотнении и при последующей керанитизации рогового слоя эпидермиса. Её можно увидеть чаще всего у людей старше сорока лет. Её пик приходится на возраст 50-65 лет.
Её пик приходится на возраст 50-65 лет.
Обращение в клинику по обследованию таких новообразований будет правильным решением. Для определения опасности кератомы врачу придется провести гистологическое исследование, которое чаще всего представляет операцию по её удалению.
Для избежания вышеописанных нарушений цикла кератизации кожи кроме соблюдения правил здорового образа жизни, избегания приема препаратов, правильного питания и гигиены — существует также специализированная косметика для устранения проблем с кератинизацией на лице и теле. В зависимости от проблемы — могут применяться как увлажняющие кремы, так и средства для отшелушивания. В состав почти всех косметических препаратов, направленных на борьбу с негативными последствиями нарушения кератинизации кожи, входит гликолевая кислота. Перед использованием таких средств необходимо обязательно проконсультироваться с врачом.
По вопросам обучения: Людмила; +79219015105; электронная почта: kurs@vsenitishop. ru.
ru.
Консультация по препаратам: Оксана, +79119952960; электронная почта: [email protected].
Будем рады видеть Вас по адресу: Ординарная улица, 21, Санкт-Петербург.
Источники: https://cosmetology-info.ru/, https://mene-moy.ru/, https://purelove.me/
Гиперкератоз: причины, лечение и профилактика
Гиперкератоз — это утолщение рогового слоя эпидермиса. Данное заболевание не является самостоятельным. Интенсивное деление клеток происходит при эритродермиях, лишаях, ихтиозе. В основе нарушения — аномальное количество кератина. Это белок, который защищает клетки эпидермиса от повреждений. Лечение гиперкератоза зависит от причины заболевания. Как восстановить кожный покров и предотвратить утолщение рогового слоя? Об этом читайте далее.
Ороговение кожи — адаптационный физиологический процесс, при котором осуществляется укрепление эпидермальной устойчивости. Типичные проявления «рефлекторной» реакции возникают при частых прогулках босиком (на стопах) или при напряженном ручном труде (на ладонях). В результате защитного эффекта кожа меняет свою структуру, становится грубой, обезвоженной, на ней появляются трещины.
В результате защитного эффекта кожа меняет свою структуру, становится грубой, обезвоженной, на ней появляются трещины.
- экзогенные. Утолщение рогового слоя эпидермиса происходит в результате интенсивного и продолжительного давления на покров. К этому приводит неудобная обувь, тесная, грубая одежда. Утолщение эпидермиса в этих случаях происходит на теле;
- эндогенные. Гиперкератоз возникает из-за системных заболеваний и хронических патологий. Одна из наиболее распространенных причин — сахарный диабет. Нарушение обменных процессов способствует изменению чувствительности, появлению сухости, проблемам с питанием покрова. Нарушения могут проявляться на теле или лице.
Наследственный фактор также может быть причиной гиперкератоза. К изменениям регенерационных процессов приводят: нарушение кровообращения, дефицит витаминов, жесткая вода, несоблюдение правил личной гигиены и низкие температуры, воздействующие на кожный покров.
Гиперкератоз проявляется по-разному в зависимости от его вида.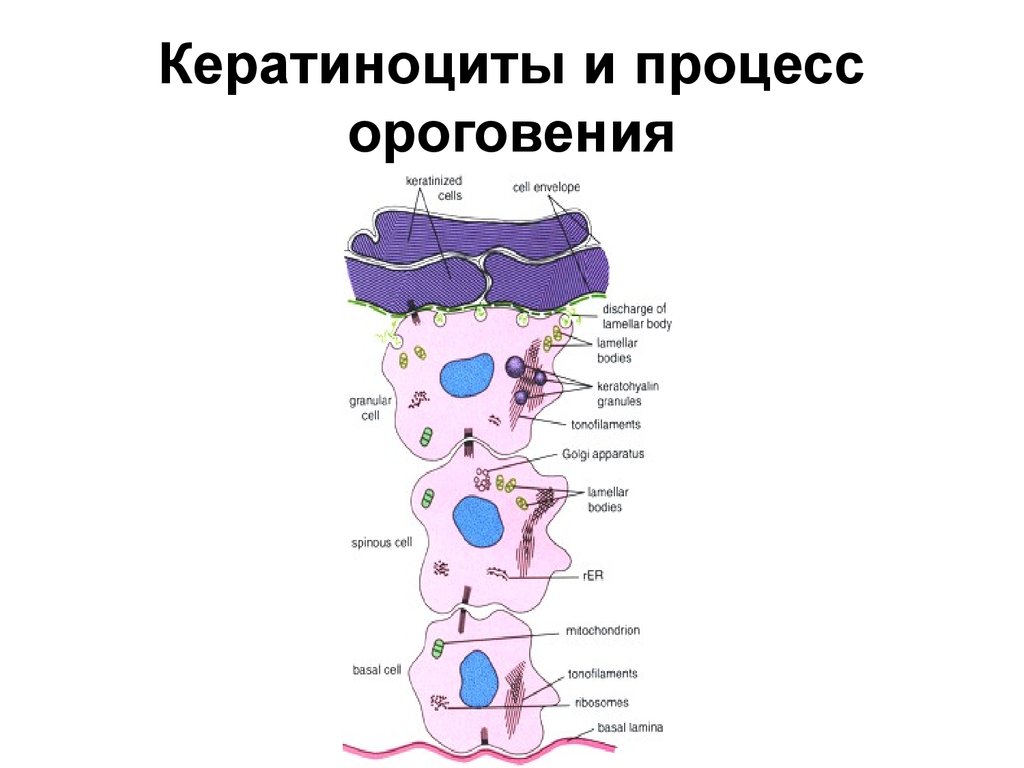 Различают несколько форм заболевания. Фолликулярный кератоз может быть самостоятельным симптомом или следствием дерматологического заболевания. Он представляет собой закупорку протока фолликула кожными чешуйками. Это происходит из-за нарушений в отслоении верхних слоев и интенсивного ороговения.
Различают несколько форм заболевания. Фолликулярный кератоз может быть самостоятельным симптомом или следствием дерматологического заболевания. Он представляет собой закупорку протока фолликула кожными чешуйками. Это происходит из-за нарушений в отслоении верхних слоев и интенсивного ороговения.
В основе диссеминированной и лентикулярной формы лежит генетический дефект. Данные виды заболевания возникают из-за интенсивного синтеза кератина. Диссеминированный гиперкератоз сопровождается образованием полиморфных элементов (короткие, изолированно расположенные волосы). Лентикулярный вид характеризуется появлением папул. Он поражает туловище (руки, ноги, стопы) и ушные раковины. Папулы могут иметь коричневый, желтый, розовый цвет. Данная форма болезни имеет преимущественно хронический характер.
Подошвенный гиперкератоз — косметический дефект, который поражает стопы. Данная форма может достигать нескольких сантиметров. Сухая дерма склонна к образованию трещин, которые могут доставлять неприятные ощущения и кровоточить. Повреждение слоя приводит к инфицированию. Нарушение регуляции синтеза кератина на стопах вызывают неудобная обувь, избыточная масса тела, врожденные и приобретенные патологии опорно-двигательного аппарата.
Повреждение слоя приводит к инфицированию. Нарушение регуляции синтеза кератина на стопах вызывают неудобная обувь, избыточная масса тела, врожденные и приобретенные патологии опорно-двигательного аппарата.
Гиперкератоз лица или тела требует консультации разных специалистов. Диагноз ставится на основании визуального осмотра, сбора анамнеза, изучения истории сопутствующих заболеваний. Дополнительно могут быть назначены:
общий и биохимический анализ крови;
- УЗИ;
- эндоскопия;
- рентгенография;
- допплерография.
Для постановки диагноза требуется консультация не только дерматолога. В некоторых случаях пациенту необходимо посетить эндокринолога и других специалистов.
Способ лечения подбирается с учетом вида и причины заболевания. При фолликулярном гиперкератозе противопоказано использование жестких скрабов и пемзы. Лечение направлено на регуляцию функций внутренних органов. Назначаются смягчающие мази. Используются препараты для местной обработки, содержащие в составе молочные и фруктовые кислоты. Такие средства обеспечивают эффект лифтинга, эффективно отшелушивают ороговевший слой кожи и нормализуют регенерацию клеток. Быстрее достичь положительного результата поможет витаминотерапия.
Такие средства обеспечивают эффект лифтинга, эффективно отшелушивают ороговевший слой кожи и нормализуют регенерацию клеток. Быстрее достичь положительного результата поможет витаминотерапия.
При лентикулярном и диссеминированном гиперкератозе назначаются мази с глюкокортикостероидами и ретиноидами. Дополнительно проводится курс химических пилингов, программ, направленных на увлажнение и смягчение кожного покрова.
При подошвенной форме заболевания необходимо устранить его первоначальную причину. Чтобы устранить гиперкератоз, следует снизить нагрузку и давление на стопы, подобрать удобную обувь. При появлении трещин нужно использовать мази и растворы ретинола для обработки пораженных участков.
Зная, что такое гиперкератоз и какие факторы способствуют его развитию, можно минимизировать вероятность появления. Важно носить удобную обувь и одежду, которая не доставляет дискомфорта, поддерживать тело в форме и заниматься спортом. Сбалансированное питание, продукты, богатые витаминами, способствуют нормализации обменных процессов, что также является профилактикой гиперкератоза.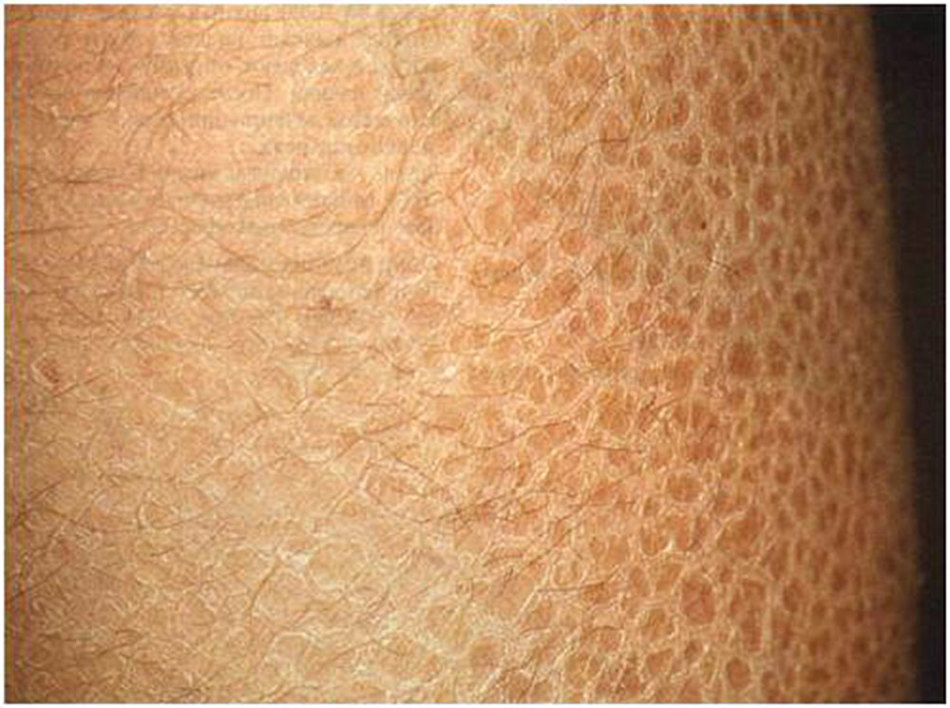
Следите за состоянием кожи, особенно склонной к раздражению и акне. Дерма нуждается в тщательном очищении и регулярном удалении ороговевшего слоя клеток. Для этого используются скрабы и пилинги. Рекомендуется обратиться к косметологу, чтобы подобрать средства, направленные на очищение, питание и увлажнение покрова, подходящие для вашего типа кожи.
Кератинизация: Обзор | Косметика и туалетные принадлежности
Примечание редактора: Кератинизация является важным аспектом здоровья и внешнего вида кожи, поэтому в последние годы разработчики исходных материалов разработали ингредиенты, влияющие на ее основные механизмы. Ниже приводится выдержка из книги «Физиология кожи», третье издание , в которой исследуется процесс кератинизации.
Процесс ороговения в коже человека необходим для образования панцирного неживого защитного покрытия на теле. Когда кератиноциты мигрируют к внешнему слою кожи, то есть к роговому слою (SC), они претерпевают множество изменений, пока, наконец, оставшаяся белковая оболочка не сможет сформировать кожный барьер. Общий восстановительный процесс миграции из базального слоя клеток в СК занимает около 28 дней. Чтобы лучше понять этот процесс, сначала важно рассмотреть вовлеченные в него организации.
Общий восстановительный процесс миграции из базального слоя клеток в СК занимает около 28 дней. Чтобы лучше понять этот процесс, сначала важно рассмотреть вовлеченные в него организации.
Роговой слой: Волокнистые белки и липиды составляют корнеоциты рогового слоя. Каждый корнеоцит развивается как отдельная клетка, интегрированная в роговой слой. На лице и тыльной стороне кистей толщина рогового слоя менее 20 микрон. На рисунке 1 показаны размеры рогового слоя в сравнении с другими слоями кожи.
Формирование этих корнеоцитов представляет собой сложный процесс, и на каждом этапе требуется один или несколько ферментов. Хотя многие детали известны, весь процесс неизвестен; таким образом, детали были сокращены, чтобы представить как можно более ясную картину образования простого корнеоцита.
Базальные клетки: Базальные клетки образуют нижний или самый внутренний слой эпидермиса. Эти клетки прикреплены к волокнам дермы, называемым плотной пластинкой, с помощью структур, называемых полудесмосомами, от греческих слов десмос, означающих «полоса»; сома означает «тело»; а геми означает «половина». Гемидесмосомы состоят из плотной бляшки на плазматической мембране, содержащей молекулы интегрина, которые проходят в плотную пластинку и прикрепляются к волокнам фибронектина. Внутри клетки молекулы интегрина прикреплены к цитоскелатным промежуточным филаментам.
Гемидесмосомы состоят из плотной бляшки на плазматической мембране, содержащей молекулы интегрина, которые проходят в плотную пластинку и прикрепляются к волокнам фибронектина. Внутри клетки молекулы интегрина прикреплены к цитоскелатным промежуточным филаментам.
Интегрины представляют собой специализированные рецепторы внеклеточного матрикса в клеточной мембране. Эти гликопротеины связываются с внеклеточными адгезивными белками, такими как фибронектин, в дерме (см. , рис. 2, ). Промежуточные филаменты представляют собой межклеточные белки, которые связываются с волокнистыми компонентами клетки и цитоскелета и связываются с гемидесмосомной бляшкой. Наконец, ламинин является адгезивным белком, который прикрепляет клеточную поверхность к базальной пластинке, часто через интегрины.
Этапы обновления кожи
Этап 1. Формирование шиповатого слоя: В процессе обновления кожи базальная клетка сначала должна разорвать прикрепление к дерме, округлиться, пройти митотическое деление ядра и разделить на две новые клетки. В то время как материнская клетка способна многократно делиться, дочерняя клетка запрограммирована на то, чтобы стать корнеоцитом и умереть, т. е. она не может получать или отправлять сообщения нижним клеткам эпидермиса. После образования дочерняя клетка прикрепляется к базальной клетке с помощью структуры, похожей на полудесмосому, известной как десмосома, поскольку она соединяется с двумя клетками через тонкие, похожие на усы выступы в клетки.
В то время как материнская клетка способна многократно делиться, дочерняя клетка запрограммирована на то, чтобы стать корнеоцитом и умереть, т. е. она не может получать или отправлять сообщения нижним клеткам эпидермиса. После образования дочерняя клетка прикрепляется к базальной клетке с помощью структуры, похожей на полудесмосому, известной как десмосома, поскольку она соединяется с двумя клетками через тонкие, похожие на усы выступы в клетки.
Этап 2, Дифференцировка в корнеоцит: Затем дочерняя клетка отделяется от базальной клетки и становится частично дифференцированной клеткой, которая не может вернуться в базальную клетку. Серьезные изменения произошли в ядре дочери, которое было запрограммировано на превращение в корнеоцит. Базальная клетка толкает дочернюю клетку вверх в эпидермис, чтобы сформировать второй слой кожи, известный как шиповатый слой или шиповатый слой.
Эти шипы являются фактическими проекциями волокнистых белков в десомосомах — структурах, соединяющих клетки эпидермиса. Шиповидные клетки сцеплены между собой десмосомами вверху, по бокам и внизу, которые соединяют их не только с базальными клетками, но и с соседними клетками; как уже отмечалось, десмосомы подобны полудесмосомам, за исключением того, что они соединяют клетки с другими клетками, а не с плотной пластинкой или базальной мембраной.
Шиповидные клетки сцеплены между собой десмосомами вверху, по бокам и внизу, которые соединяют их не только с базальными клетками, но и с соседними клетками; как уже отмечалось, десмосомы подобны полудесмосомам, за исключением того, что они соединяют клетки с другими клетками, а не с плотной пластинкой или базальной мембраной.
Полный набор органелл, таких как ядро, аппарат Гогли и митохондрии, остается в шипиковой клетке, хотя каждый из них начинает претерпевать изменения. Гранулы мембранного покрытия и ламеллярные тела начинают формироваться и могут быть видны в цитоплазме. Большая часть активности ферментов связана с созданием липидов и белков, в то время как другие ферменты начинают разрушать внутреннюю часть клетки, готовясь к следующему шагу.
Шаг 3, зернистый слой: Зернистый слой, также известный как зернистый слой, представляет собой слой, в котором быстро происходят заметные изменения кератиноцитов. В частности, клетки уплощены, но все еще жизнеспособны, а в верхней части цитоплазмы в клетках наблюдаются пластинчатые тельца. Эти пластинчатые тела содержат стопки уплощенных липидных пузырьков. По мере того, как клетка медленно распадается и формируются новые структуры, происходят кардинальные изменения.
Эти пластинчатые тела содержат стопки уплощенных липидных пузырьков. По мере того, как клетка медленно распадается и формируются новые структуры, происходят кардинальные изменения.
Этап 4, блестящий слой: Резкий переход зернистых клеток в блестящий слой заканчивается на последних стадиях дифференцировки и приводит к ороговению клеток. Блестящий слой часто трудно увидеть с помощью светового микроскопа, так как клетки еще более уплощены и довольно тонкие. Протеазы и нуклеазы разрушают клеточные органеллы, оставляя во внутриклеточном матриксе только кератиновые филаменты, состоящие из расщепленных кератогиалиновых гранул.
Гранулы мембранного покрытия сливаются с клеточной мембраной и высвобождают свое содержимое в межклеточное пространство, образуя межклеточные липиды, которые организованы в мультиламеллярный домен. Эти липиды включают холестерин, церамиды и жирные кислоты. Завершающим этапом является добавление белковой оболочки, называемой инволюкрином, к клеточной мембране, которая формирует ороговевшую клетку и придает ей большую прочность.
Этап 5, формирование корнеоцитов: Наконец, последний этап – формирование корнеоцитов. Как уже отмечалось, внешняя оболочка состоит из белка инволюкрина, и именно под этой оболочкой формируется липидная оболочка, называемая липидной оболочкой корнеоцита; под этим слоем находятся белки кератинового матрикса (см.0012 Рисунок 3 ).
Заключение
Кератинизация является важным аспектом здоровья и внешнего вида кожи. Чтобы лучше понять этот процесс, прочтите Physiology of the Skin, Third Edition .
Отказ от ответственности:
Вышеупомянутый платный контент был создан и размещен от имени Спонсора. Предоставленный контент создается исключительно Спонсором или его аффилированными лицами, и Спонсор несет ответственность за точность, полноту и достоверность всей включенной информации. Косметика и туалетные принадлежности предпринимает шаги, чтобы гарантировать, что вы не перепутаете спонсируемый контент с контентом, созданным Косметика и туалетные принадлежности и регулируемым его редакционной политикой.
Аутовоспалительные заболевания с ороговением (AiKD): расширение списка заболеваний, которые необходимо включить
Воспаление, вызванное гиперактивацией врожденного иммунитета из-за генетических факторов, иногда приводит к воспалительным заболеваниям с ороговением кожи. Такие воспалительные заболевания ороговения с генетическими аутовоспалительными патомеханизмами называются «аутовоспалительными заболеваниями ороговения» (АиКЗ) (1). AiKD также включают расстройства с комбинированными патологическими механизмами аутоиммунитета и аутовоспаления. AiKD обладают первичными генетическими причинами, связанными с аутовоспалением, главным образом в эпидермисе и поверхностной дерме. Аутовоспаление в этих областях приводит к гиперкератозу кожи, что приводит к другим кожным воспалительным симптомам AiKD (1, 2). Клинические фенотипы AiKD вариабельны, и каждое заболевание имеет уникальные характерные проявления, хотя общими клиническими признаками являются гиперкератотические поражения с воспалением (таблица 1). Большинство пациентов с AiKD имеют рецидивирующие и стойкие кожные поражения.
Большинство пациентов с AiKD имеют рецидивирующие и стойкие кожные поражения.
Таблица 1 . Воспалительные заболевания кератинизации, классифицируемые на сегодняшний день как AiKD [заимствовано и изменено из Akiyama et al. (1, 2)].
Первоначально AiKD включали генерализованный пустулезный псориаз (GPP), красный волосяной лишай (PRP) и семейный хронический лихеноидный кератоз (KLC) (1, 2). Остается спорным вопрос о том, следует ли считать GPP AiKD. Сообщалось, что у многих пациентов с GPP, континуальным акродерматитом или герпетиформным импетиго мутации IL36RN (3–9). GPP показывает массивную нейтрофильную инфильтрацию, приводящую к пустулезу и иногда к эрозии кожи. Уровень гиперкератоза варьирует в зависимости от сроков, поражений и случаев. Однако считается, что дифференцировка и пролиферация кератиноцитов часто затрагиваются в пораженном эпидермисе при ГПП, и ГПП считается заболеванием, при котором нарушается кератинизация, хотя гиперкератоз в некоторых случаях не проявляется. В связи с этим ГПП целесообразно рассматривать как болезнь ороговения. У некоторых пациентов с ГПП редкие мутации обоих IL36RN и CARD14 были идентифицированы (8). Это наблюдение указывает на то, что ГПП не вызывается моногенными факторами ни CARD14 , ни IL36RN , но эти два гена являются достаточно сильными факторами риска возникновения ГПП. Вместе с сильной ассоциацией HLA-класса II с GPP, GPP, по-видимому, является полигенным заболеванием с сильными эффектами от мутаций IL36RN . Результаты моделирования на мышах также подтверждают эту точку зрения: у мышей Il36rn -null болезнь никогда не проявляется спонтанно, но им нужен имихимод в качестве потенциального триггера для проявления GPP-подобных фенотипов (10). 9Мутации 0093 IL36RN иногда обнаруживаются у пациентов с GPP с псориазом, хотя у пациентов с GPP без псориаза, по-видимому, чаще встречаются мутации IL36RN (4, 9). Кроме того, Аракава и соавт. (11) сообщили, что индуцированные уровни IL36RN ниже как у пациентов с GPP с мутациями IL36RN , так и без них, и предложили «недостаточность IL36RN » при GPP.
В связи с этим ГПП целесообразно рассматривать как болезнь ороговения. У некоторых пациентов с ГПП редкие мутации обоих IL36RN и CARD14 были идентифицированы (8). Это наблюдение указывает на то, что ГПП не вызывается моногенными факторами ни CARD14 , ни IL36RN , но эти два гена являются достаточно сильными факторами риска возникновения ГПП. Вместе с сильной ассоциацией HLA-класса II с GPP, GPP, по-видимому, является полигенным заболеванием с сильными эффектами от мутаций IL36RN . Результаты моделирования на мышах также подтверждают эту точку зрения: у мышей Il36rn -null болезнь никогда не проявляется спонтанно, но им нужен имихимод в качестве потенциального триггера для проявления GPP-подобных фенотипов (10). 9Мутации 0093 IL36RN иногда обнаруживаются у пациентов с GPP с псориазом, хотя у пациентов с GPP без псориаза, по-видимому, чаще встречаются мутации IL36RN (4, 9). Кроме того, Аракава и соавт. (11) сообщили, что индуцированные уровни IL36RN ниже как у пациентов с GPP с мутациями IL36RN , так и без них, и предложили «недостаточность IL36RN » при GPP. Последовательно, пациентов с ГПП можно успешно лечить с помощью блокады сигнала IL36 независимо от того, 9Присутствуют 0093 мутации IL36RN (12). В целом кажется, что у большинства пациентов с GPP наблюдается гиперактивация передачи сигналов IL36. С другой стороны, доказательства аутоиммунитета при GPP достаточно убедительны (13). Антиген-специфическая активация Т-клеток CD4 + была обнаружена для определенных аллелей HLA-класса II (11). Фактически, лечение, направленное на Т-клетки, эффективно против GPP. Однако в нашем первоначальном определении AiKD мы определили концепцию AiKD как охватывающую заболевания со смешанными патомеханизмами аутовоспаления и аутоиммунитета (1). В случаях ГПП значительную роль играет аутовоспаление, хотя аутоиммунитет также важен. Таким образом, GPP считается включенным в AiKD.
Последовательно, пациентов с ГПП можно успешно лечить с помощью блокады сигнала IL36 независимо от того, 9Присутствуют 0093 мутации IL36RN (12). В целом кажется, что у большинства пациентов с GPP наблюдается гиперактивация передачи сигналов IL36. С другой стороны, доказательства аутоиммунитета при GPP достаточно убедительны (13). Антиген-специфическая активация Т-клеток CD4 + была обнаружена для определенных аллелей HLA-класса II (11). Фактически, лечение, направленное на Т-клетки, эффективно против GPP. Однако в нашем первоначальном определении AiKD мы определили концепцию AiKD как охватывающую заболевания со смешанными патомеханизмами аутовоспаления и аутоиммунитета (1). В случаях ГПП значительную роль играет аутовоспаление, хотя аутоиммунитет также важен. Таким образом, GPP считается включенным в AiKD.
Кроме того, как путь CARD14 , так и путь IL36RN связаны не только с GPP, но также и с вульгарным псориазом. Считается, что GPP и вульгарный псориаз относятся к одному и тому же заболеванию в спектре. Действительно, мутации CARD14 связаны как с вульгарным псориазом, так и с GPP, при этом наиболее сильная активность CARD14 вызывает GPP (14, 15). Исследования ассоциации всего генома псориаза показывают, что CARD14 является геном риска псориаза (16), а это означает, что CARD14-опосредованный путь может работать у пациентов с псориазом без CARD14 мутации. С другой стороны, антиген-специфическая активация Т-клеток CD8 + происходит как при вульгарном псориазе, так и при GPP (11). Вместе с идентифицированными аутоантигенами, которые активируют CD8 + Т-клеток при псориазе (17, 18), эта активация CD8 + Т-клеток может представлять собой общий путь псориаза, который также наблюдается при GPP. Таким образом, вульгарный псориаз также имеет как аутовоспалительный, так и аутоиммунный патогенез, поэтому он вполне может быть включен в AiKD, поскольку, согласно его первоначальному определению, AiKD охватывают заболевания со смешанными патомеханизмами аутовоспаления и аутоиммунитета (1).
Действительно, мутации CARD14 связаны как с вульгарным псориазом, так и с GPP, при этом наиболее сильная активность CARD14 вызывает GPP (14, 15). Исследования ассоциации всего генома псориаза показывают, что CARD14 является геном риска псориаза (16), а это означает, что CARD14-опосредованный путь может работать у пациентов с псориазом без CARD14 мутации. С другой стороны, антиген-специфическая активация Т-клеток CD8 + происходит как при вульгарном псориазе, так и при GPP (11). Вместе с идентифицированными аутоантигенами, которые активируют CD8 + Т-клеток при псориазе (17, 18), эта активация CD8 + Т-клеток может представлять собой общий путь псориаза, который также наблюдается при GPP. Таким образом, вульгарный псориаз также имеет как аутовоспалительный, так и аутоиммунный патогенез, поэтому он вполне может быть включен в AiKD, поскольку, согласно его первоначальному определению, AiKD охватывают заболевания со смешанными патомеханизмами аутовоспаления и аутоиммунитета (1).
Большинство пациентов с PRP типа V имеют мутации CARD14 (19) и классифицируются как имеющие AiKD, а небольшое количество случаев PRP других типов имеют варианта CARD14 и также включены в AiKD. Крейглоу и др. (20) предложили термин «CARD14-ассоциированная папулосквамозная сыпь» для обозначения пациентов с псориазом и пациентов с PRP типа V, несущих мутации CARD14 , и они предположили, что пациенты с псориазом/PRP типа V с мутациями CARD14 имеют характерные признаки раннего начала, преобладающие кожные симптомы на лице и хороший ответ на лечение устекинумабом. Такие пациенты с псориазом/PRP типа V с 9Мутации 0093 CARD14 считаются типичными случаями AiKD. Кроме того, некоторые случаи пустулезного псориаза могут быть связаны с мутациями в AP1S3 , кодирующем связанный с адаптером белковый комплекс 1, сигма-3 субъединицу (AP1S3) (21). Молекула AP1S3 участвует в образовании аутофагосом, особенно в кератиноцитах. Считается, что потеря функции AP1S3 приводит к дефектной аутофагии и аномальному накоплению p62. Известно, что p62 опосредует активацию NFκB. Таким образом, считается, что накопление p62 приводит к гиперактивации NFκB, усилению передачи сигналов IL-1 и сверхэкспрессии IL-36 (21). В этом контексте пустулезный псориаз, связанный с AP1S3, включая случаи с GPP, континуальным акродерматитом и ладонно-подошвенным пустулезом, признается AikD.
Известно, что p62 опосредует активацию NFκB. Таким образом, считается, что накопление p62 приводит к гиперактивации NFκB, усилению передачи сигналов IL-1 и сверхэкспрессии IL-36 (21). В этом контексте пустулезный псориаз, связанный с AP1S3, включая случаи с GPP, континуальным акродерматитом и ладонно-подошвенным пустулезом, признается AikD.
Недавно было предложено включить гнойный гидраденит (HS), особенно семейные случаи, в AiKD. Мутации в генах комплекса γ-секретазы были выявлены у пациентов и семей с HS (22). Пациенты с HS, несущие мутации в NCSTN, PSENEN и PSEN1 , кодирующих комплекс γ-секретазы, демонстрируют гиперкератотический эпителий волосяных фолликулов в воронкообразной области, что приводит к окклюзии волосяных фолликулов. Такая окклюзия считается важной частью патогенетического механизма HS (22). Закупорка эпидермиса ороговевшими материалами также является характерной находкой при кожных поражениях PRP, типичного AiKD (19).). Кроме того, сообщалось, что тканевые уровни TNF, каспазы-1, IL-1 и IL-17 высоки в пораженной коже пациентов с HS (23, 24). Было бы разумно считать, что HS, по крайней мере, HS с мутациями гена γ-секретазы, является клинической единицей, включенной в AiKD, потому что считается, что первичным этапом в патогенезе HS является гиперкератоз фолликулярного эпителия в инфундибулярной области из-за аберрантная активация врожденного иммунитета. Действительно, иногда HS наблюдается у пациентов с аутовоспалительными заболеваниями, включая гангренозную пиодермию и гнойный стерильный артрит, в виде аутовоспалительных синдромов, таких как гангренозная пиодермия, синдром акне и гнойного артрита (PAPA), гангренозная пиодермия, синдром акне и HS (PASH) и синдром Маджида. синдром (25–29). HS и эти аутовоспалительные синдромы с HS могут иметь общие патогенетические механизмы гиперактивации врожденного иммунитета, приводящие к усиленной продукции цитокинов семейства IL-1 и нейтрофильной инфильтрации в коже (26, 27). При рассмотрении патогенеза СГ имеет смысл признать СГ как АиКЗ, инициированную гиперактивацией врожденного иммунитета в эпителии фолликулярной воронки.
Было бы разумно считать, что HS, по крайней мере, HS с мутациями гена γ-секретазы, является клинической единицей, включенной в AiKD, потому что считается, что первичным этапом в патогенезе HS является гиперкератоз фолликулярного эпителия в инфундибулярной области из-за аберрантная активация врожденного иммунитета. Действительно, иногда HS наблюдается у пациентов с аутовоспалительными заболеваниями, включая гангренозную пиодермию и гнойный стерильный артрит, в виде аутовоспалительных синдромов, таких как гангренозная пиодермия, синдром акне и гнойного артрита (PAPA), гангренозная пиодермия, синдром акне и HS (PASH) и синдром Маджида. синдром (25–29). HS и эти аутовоспалительные синдромы с HS могут иметь общие патогенетические механизмы гиперактивации врожденного иммунитета, приводящие к усиленной продукции цитокинов семейства IL-1 и нейтрофильной инфильтрации в коже (26, 27). При рассмотрении патогенеза СГ имеет смысл признать СГ как АиКЗ, инициированную гиперактивацией врожденного иммунитета в эпителии фолликулярной воронки. Гетерозиготные мутации в одном из трех генов ( NCSTN, PSENEN и PSEN1 ), кодирующие комплекс γ-секретазы, описаны в HS (22). γ-secretase представляет собой связанный с мембраной аспартилпротеазный комплекс, который участвует во внутримембранном протеолизе различных мембранных белков, включая Notch (28). Notch является мембранным рецептором, и связывание лигандов с внеклеточной частью Notch запускает расщепление внутриклеточной части Notch с помощью γ-секретазы, при этом расщепленный внутриклеточный домен Notch перемещается в ядро и регулирует экспрессию различных генов (29).). В коже дифференцировка и пролиферация эпидермальных клеток, а также дифференцировка и поддержание эпителия волосяных фолликулов и сальных желез регулируются с помощью передачи сигналов Notch (22). Таким образом, считается, что снижение ферментативной активности комплекса γ-secretase из-за мутаций в NCSTN, PSENEN и PSEN1 подавляет передачу сигналов Notch, что приводит к аберрантной дифференцировке и пролиферации эпидермиса и эпителия волосяных фолликулов при HS.
Гетерозиготные мутации в одном из трех генов ( NCSTN, PSENEN и PSEN1 ), кодирующие комплекс γ-секретазы, описаны в HS (22). γ-secretase представляет собой связанный с мембраной аспартилпротеазный комплекс, который участвует во внутримембранном протеолизе различных мембранных белков, включая Notch (28). Notch является мембранным рецептором, и связывание лигандов с внеклеточной частью Notch запускает расщепление внутриклеточной части Notch с помощью γ-секретазы, при этом расщепленный внутриклеточный домен Notch перемещается в ядро и регулирует экспрессию различных генов (29).). В коже дифференцировка и пролиферация эпидермальных клеток, а также дифференцировка и поддержание эпителия волосяных фолликулов и сальных желез регулируются с помощью передачи сигналов Notch (22). Таким образом, считается, что снижение ферментативной активности комплекса γ-secretase из-за мутаций в NCSTN, PSENEN и PSEN1 подавляет передачу сигналов Notch, что приводит к аберрантной дифференцировке и пролиферации эпидермиса и эпителия волосяных фолликулов при HS. Было обнаружено, что нарушение работы γ-secretase приводит к аномальной дифференцировке эпителия в волосяных фолликулах посредством подавления сигналов Notch в исследованиях на модельных мышах (22).
Было обнаружено, что нарушение работы γ-secretase приводит к аномальной дифференцировке эпителия в волосяных фолликулах посредством подавления сигналов Notch в исследованиях на модельных мышах (22).
Порокератоз охватывает разнообразные гиперкератотические поражения, состоящие из одиночных или множественных атрофических пятен или бляшек, ограниченных гиперкератотическими гребнями. Вертикальные столбцы паракератотических клеток, называемые «пластинками роговицы», являются гистологическими находками, характерными для порокератоза (30). Порокератоз, очевидно, является заболеванием кератинизации, а также рассматривается как воспалительное заболевание кожи (30). Фактически, значительное воспаление наблюдается при эруптивном зудящем папулезном порокератозе, а кожные воспалительные заболевания, включая локализованный кожный амилоидоз, являются осложнениями случаев порокератоза (30). Мы предложили классифицировать порокератоз как AiKD. В 2012 году мутации в MVK , один из генов мевалонатного пути, был обнаружен как причина диссеминированного поверхностного актинического порокератоза (31). На сегодняшний день четыре гена мевалонатного пути ( MVK, MVD, PMVK и FDPS ) идентифицированы как возбудители порокератоза (30). Известно, что мевалонатный путь продуцирует предшественники изопреноидов (30). Изопреноиды являются предшественниками различных важных молекул, таких как гем А, холестерин и изопренилированные белки (30). Изопренилированные белки, в том числе RAS и ламин B, регулируют рост и дифференцировку клеток (30). Было продемонстрировано, что дефицит геранилгеранилпирофосфата, нестеролового изопреноида в продуктах мевалонатного пути, вызывает активацию инфламмасом посредством аномальной функции Rac1 (32). Мы предполагаем, что сбои в пути мевалоната могут приводить к аномальному росту и дифференцировке эпидермальных кератиноцитов и аутовоспалению в очагах порокератоза. В этом контексте порокератоз был бы AiKD, и иногда он является наследственным (30). Действительно, один из генов мевалонатного пути, вызывающего порокератоз, MVK , также является причиной гипериммуноглобулинемии D и синдрома периодической лихорадки, установленного аутовоспалительного синдрома (33).
На сегодняшний день четыре гена мевалонатного пути ( MVK, MVD, PMVK и FDPS ) идентифицированы как возбудители порокератоза (30). Известно, что мевалонатный путь продуцирует предшественники изопреноидов (30). Изопреноиды являются предшественниками различных важных молекул, таких как гем А, холестерин и изопренилированные белки (30). Изопренилированные белки, в том числе RAS и ламин B, регулируют рост и дифференцировку клеток (30). Было продемонстрировано, что дефицит геранилгеранилпирофосфата, нестеролового изопреноида в продуктах мевалонатного пути, вызывает активацию инфламмасом посредством аномальной функции Rac1 (32). Мы предполагаем, что сбои в пути мевалоната могут приводить к аномальному росту и дифференцировке эпидермальных кератиноцитов и аутовоспалению в очагах порокератоза. В этом контексте порокератоз был бы AiKD, и иногда он является наследственным (30). Действительно, один из генов мевалонатного пути, вызывающего порокератоз, MVK , также является причиной гипериммуноглобулинемии D и синдрома периодической лихорадки, установленного аутовоспалительного синдрома (33). Биаллельные мутации в MVK вызывают более тяжелое системное заболевание, гипериммуноглобулинемию D и синдром периодической лихорадки, а гетерозиготные мутации в MVK приводят к порокератозу (31).
Биаллельные мутации в MVK вызывают более тяжелое системное заболевание, гипериммуноглобулинемию D и синдром периодической лихорадки, а гетерозиготные мутации в MVK приводят к порокератозу (31).
Пациенты с порокератозом, вызывающие мутации гена мевалонатного пути, имеют мутации в виде гетерозиготных мутаций зародышевой линии. В кожных поражениях порокератоза экспрессия мутантных аллелей выше, чем у аллелей дикого типа, и преобладающая экспрессия мутантных аллелей считается пусковым механизмом для образования порокератотических поражений (30). В качестве причинного механизма преимущественной экспрессии мутантных аллелей и потери функции аллелей дикого типа при порокератотических поражениях в большинстве случаев предполагается невыясненный независимый от метилирования ДНК эпигенетический процесс (30) и, кроме того, геномная рекомбинация, которая в других случаях сообщалось о гомозиготности мутантных аллелей (30). Также сообщалось об аберрантном редактировании РНК в пораженной ткани в одном случае порокератоза (30).
Что касается лечения AiKD, основанного на аутовоспалительных патогенных механизмах, упомянутых выше, ожидается, что терапевтические стратегии, нацеленные на молекулы, работающие в аутовоспалительных каскадах патомеханизмов при AiKD, такие как цитокины, их рецепторы и сигнальные молекулы, принесут многообещающие инновационные методы лечения различных заболеваний. включены в АиКД. Действительно, различные методы лечения патогенных механизмов достаточно эффективны для ряда АИК.
Успешное лечение аферезом гранулоцитарной и моноцитарной адсорбции (34), анакинрой (антагонист рецептора IL-1) (35), канакинумабом (моноклональное антитело к IL-1β) (36), инфликсимабом (моноклональное антитело к TNF человека) -α) (37), адалимумаб (моноклональное антитело против TNF-α) (38), устекинумаб (моноклональное антитело против человеческого IL-12/IL-23 p40) (39), секукинумаб (моноклональное антитело к IL-17) (40) и иксекизумаб (моноклональное антитело к IL-17A) (41) были описаны для GPP как AiKD. Устекинумаб также достаточно эффективен против PRP с мутациями CARD14 (42). Что касается лечения AiKD, вызванного мутациями NLRP1 , сообщалось, что антагонист рецептора IL-1 анакинра эффективен в случаях NLRP1 -ассоциированного аутовоспаления с артритом и дискератозом (43). Что касается лечения HS, рекомендуются адалимумаб, инфликсимаб, анакинра и устекинумаб (23).
Устекинумаб также достаточно эффективен против PRP с мутациями CARD14 (42). Что касается лечения AiKD, вызванного мутациями NLRP1 , сообщалось, что антагонист рецептора IL-1 анакинра эффективен в случаях NLRP1 -ассоциированного аутовоспаления с артритом и дискератозом (43). Что касается лечения HS, рекомендуются адалимумаб, инфликсимаб, анакинра и устекинумаб (23).
Концепция AiKD открыла новую эру в лечении воспалительных заболеваний кератинизации. Мы предполагаем, что в ближайшем будущем растущее число воспалительных заболеваний кератинизации может быть признано AiKD, наряду с передовыми знаниями о новых патомеханизмах, работающих при воспалительных нарушениях кератинизации. Признание врожденных причинных/предрасполагающих проблем и точная оценка их роли в этиологии заболевания с точки зрения AiKD обещают принести инновации, которые обеспечат более точную, целенаправленную причинную терапию для различных AiKD.
Вклад авторов
Автор подтверждает, что является единственным автором этой работы и одобрил ее публикацию.
Финансирование
MA было поддержано финансированием Программы перспективных исследований и разработок для медицинских инноваций (AMED-CREST) 19gm0910002h0105 Японского агентства медицинских исследований и разработок (AMED), Гранта в помощь для научных исследований (B ) 18H02832 от Японского общества содействия науке (JSPS), за счет гранта Министерства здравоохранения, труда и социального обеспечения Японии (гранты на исследования в области здравоохранения и труда; исследования трудноизлечимых заболеваний: h39-029) и Мемориальным фондом Уэхары.
Конфликт интересов
Автор заявляет, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Ссылки
1. Акияма М., Такеичи Т., МакГрат Дж.А., Сугиура К. Аутовоспалительные кератинизирующие заболевания. J Allergy Clin Immunol. (2017) 140:1545–7. doi: 10.1016/j.jaci.2017.05.019
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
2. Akiyama M, Takeichi T, McGrath JA, Sugiura K. Аутовоспалительные заболевания, связанные с кератинизацией: новая концепция, охватывающая различные воспалительные нарушения кератинизации кожи. J Dermatol Sci. (2018) 90:105–11. doi: 10.1016/j.jdermsci.2018.01.012
Akiyama M, Takeichi T, McGrath JA, Sugiura K. Аутовоспалительные заболевания, связанные с кератинизацией: новая концепция, охватывающая различные воспалительные нарушения кератинизации кожи. J Dermatol Sci. (2018) 90:105–11. doi: 10.1016/j.jdermsci.2018.01.012
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
3. Marrakchi S, Guigue P, Renshaw BR, Puel A, Pei XY, Fraitag S, et al. Дефицит антагониста рецептора интерлейкина-36 и генерализованный пустулезный псориаз. N Engl J Med. (2011) 365:620–8. doi: 10.1056/NEJMoa1013068
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
4. Sugiura K, Takemoto A, Yamaguchi M, Takahashi H, Shoda Y, Mitsuma T, et al. Большинство случаев генерализованного пустулезного псориаза без вульгарного псориаза обусловлено дефицитом антагониста рецептора интерлейкина-36. J Инвест Дерматол. (2013) 133:2514–21. doi: 10.1038/jid.2013.230
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
5. Setta-Kaffetzi N, Navarini AA, Patel VM, Pullabhatla V, Pink AE, Choon SE, et al. Редкие патогенные варианты IL36RN лежат в основе спектра пустулезных фенотипов, ассоциированных с псориазом. J Инвест Дерматол. (2013) 133:1366–9. doi: 10.1038/jid.2012.490
Setta-Kaffetzi N, Navarini AA, Patel VM, Pullabhatla V, Pink AE, Choon SE, et al. Редкие патогенные варианты IL36RN лежат в основе спектра пустулезных фенотипов, ассоциированных с псориазом. J Инвест Дерматол. (2013) 133:1366–9. doi: 10.1038/jid.2012.490
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
6. Abbas O, Itani S, Ghosn S, Kibbi AG, Fidawi G, Farooq M, et al. Континуальный акродерматит Аллопо является клиническим фенотипом DITRA: доказательство того, что это вариант пустулезного псориаза. Дерматология . (2013) 226:28–31. doi: 10.1159/000346572
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
7. Sugiura K, Oiso N, Iinuma S, Matsuda H, Minami-Hori M, Ishida-Yamamoto A, et al. Мутации IL36RN лежат в основе герпетиформного импетиго. J Инвест Дерматол. (2014) 134:2472–4. doi: 10.1038/jid.2014.177
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
8. Mössner R, Wilsmann-Theis D, Oji V, Gkogkolou P, Löhr S, Schulz P, et al. Генетическая основа для большинства пациентов с гнойничковым заболеванием кожи остается неясной. Бр Ж Дерматол. (2018) 178:740–8. doi: 10.1111/bjd.15867
Mössner R, Wilsmann-Theis D, Oji V, Gkogkolou P, Löhr S, Schulz P, et al. Генетическая основа для большинства пациентов с гнойничковым заболеванием кожи остается неясной. Бр Ж Дерматол. (2018) 178:740–8. doi: 10.1111/bjd.15867
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
9. Twelves S, Mostafa A, Dand N, Burri E, Farkas K, Wilson R, et al. Клинические и генетические различия между подтипами пустулезного псориаза. J Allergy Clin Immunol. (2019) 143:1021–6. doi: 10.1016/j.jaci.2018.06.038
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
10. Shibata A, Sugiura K, Furuta Y, Mukumoto Y, Kaminuma O, Akiyama M. Антагонист толл-подобного рецептора 4 TAK-242 ингибирует аутовоспалительные симптомы при DITRA. J Аутоиммунный . (2017) 80:28–38. doi: 10.1016/j.jaut.2017.01.007
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
11. Аракава А., Фоллмер С., Бесген П. , Галински А., Саммер Б., Каваками Ю. и др. Непротиворечивая активность IL-36 способствует клональным CD4 + Т-клеточным ответам с продукцией IL-17A при генерализованном пустулезном псориазе. Дж Инвест Дерматол . (2018) 138:1338–47. doi: 10.1016/j.jid.2017.12.024
, Галински А., Саммер Б., Каваками Ю. и др. Непротиворечивая активность IL-36 способствует клональным CD4 + Т-клеточным ответам с продукцией IL-17A при генерализованном пустулезном псориазе. Дж Инвест Дерматол . (2018) 138:1338–47. doi: 10.1016/j.jid.2017.12.024
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
12. Bachelez H, Choon SE, Marrakchi S, Burden AD, Tsai TF, Morita A, et al. Ингибирование пути интерлейкина-36 для лечения генерализованного пустулезного псориаза. N Английский J Med . (2019) 380:981–3. doi: 10.1056/NEJMc1811317
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
13. Наварини А.А., Смит С.Х., Баркер Дж.Н., Капон Ф. Ответ на письмо «Ранний генерализованный пустулезный псориаз является представителем аутовоспалительных кератинизирующих заболеваний». J Allergy Clin Immunol . (2019) 143:810–1. doi: 10.1016/j.jaci.2018.11.010
CrossRef Full Text
14. Jordan CT, Cao L, Roberson ED, Pierson KC, Yang CF, Joyce CE, et al. PSORS2 возникает из-за мутаций в CARD14. Am J Hum Genet . (2012) 90:784–95. doi: 10.1016/j.ajhg.2012.03.012
Jordan CT, Cao L, Roberson ED, Pierson KC, Yang CF, Joyce CE, et al. PSORS2 возникает из-за мутаций в CARD14. Am J Hum Genet . (2012) 90:784–95. doi: 10.1016/j.ajhg.2012.03.012
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
15. Jordan CT, Cao L, Roberson ED, Duan S, Helms CA, Nair RP, et al. Редкие и распространенные варианты CARD14, кодирующего эпидермальный регулятор NF-κB, при псориазе. Am J Hum Genet . (2012) 90:796–808. doi: 10.1016/j.ajhg.2012.03.013
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
16. Tsoi LC, Spain SL, Knight J, Ellinghaus E, Stuart PE, Capon F, et al. Идентификация 15 новых локусов предрасположенности к псориазу подчеркивает роль врожденного иммунитета. Нат Жене. (2012) 44:1341–8. doi: 10.1038/ng.2467
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
17. Lande R, Botti E, Jandus C, Dojcinovic D, Fanelli G, Conrad C, et al. Антимикробный пептид LL37 является аутоантигеном Т-клеток при псориазе. Нац Коммуна . (2014) 5:5621. doi: 10.1038/ncomms6621
Нац Коммуна . (2014) 5:5621. doi: 10.1038/ncomms6621
PubMed Abstract | CrossRef Full Text
18. Arakawa A, Siewert K, Stöhr J, Besgen P, Kim SM, Rühl G, et al. Меланоцитарный антиген вызывает аутоиммунитет при псориазе человека. J Exp Med. (2015) 212:2203–12. doi: 10.1084/jem.20151093
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
19. Такеичи Т., Сугиура К., Номура Т., Сакамото Т., Огава Й., Ойсо Н. и др. Pityriasis rubra pilaris типа V как аутовоспалительное заболевание с мутациями CARD14. ДЖАМА Дерматол. (2017) 153:66–70. doi: 10.1001/jamadermatol.2016.3601
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
20. Craiglow BG, Boyden LM, Hu R, Virtanen M, Su J, Rodriguez G, et al. Папулосквамозная сыпь, связанная с CARD14: спектр, включающий признаки псориаза и красного волосяного питириаза. J Am Acad Дерматол. (2018) 79: 487–94. doi: 10.1016/j.jaad.2018.02.034
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
21. Mahil SK, Twelves S, Farkas K, Setta-Kaffetzi N, Burden AD, Gach JE, et al. Мутации AP1S3 вызывают аутовоспаление кожи, нарушая аутофагию кератиноцитов и повышая продукцию IL-36. J Инвест Дерматол. (2016) 136:2251–9. doi: 10.1016/j.jid.2016.06.618
Mahil SK, Twelves S, Farkas K, Setta-Kaffetzi N, Burden AD, Gach JE, et al. Мутации AP1S3 вызывают аутовоспаление кожи, нарушая аутофагию кератиноцитов и повышая продукцию IL-36. J Инвест Дерматол. (2016) 136:2251–9. doi: 10.1016/j.jid.2016.06.618
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
22. Пинк А.Е., Симпсон М.А., Десаи Н., Трембат Р.С., Баркер Дж.Н.В. Мутации γ-секретазы при гнойном гидрадените: новый взгляд на патогенез заболевания. J Инвест Дерматол. (2013) 133:601–7. doi: 10.1038/jid.2012.372
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
23. Saunte DML, Jemec GBE. Гнойный гидраденит: достижения в диагностике и лечении. ЯМА. (2017) 318:2019–32. doi: 10.1001/jama.2017.16691
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
24. Моран Б., Суини С.М., Хьюз Р., Малара А., Кирти С., Тобин А.М. и другие. Гнойный гидраденит характеризуется нарушением регуляции оси клеток Th27:Treg, которое корректируется терапией анти-ФНО. J Инвест Дерматол. (2017) 137:2389–95. doi: 10.1016/j.jid.2017.05.033
J Инвест Дерматол. (2017) 137:2389–95. doi: 10.1016/j.jid.2017.05.033
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
25. Гаспарич Дж., Теут Риис П., Джемек Г.Б. Распознавание синдромального гнойного гидраденита: обзор литературы. J Eur Acad Dermatol Venereol. (2017) 31:1809–16. doi: 10.1111/jdv.14464
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
26. Винкель С., Томсен С.Ф. Аутовоспалительные синдромы, связанные с гнойным гидраденитом и/или акне. Int J Дерматол. (2017) 56:811–8. doi: 10.1111/ijd.13603
Полный текст CrossRef | Google Scholar
27. Де Вита В., МакГонагл Д. Гнойный гидраденит как аутовоспалительное заболевание кератинизации. J Allergy Clin Immunol. (2018) 141:1953. doi: 10.1016/j.jaci.2018.01.010
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
28. Li T, Wen H, Brayton C, Das P, Smithson LA, Fauq A, et al. Рецептор эпидермального фактора роста и пути Notch участвуют в супрессорной функции γ-секретазы. J Биол. Хим. (2007) 282:32264–73. doi: 10.1074/jbc.M703649200
J Биол. Хим. (2007) 282:32264–73. doi: 10.1074/jbc.M703649200
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
29. Oswald F, Täuber B, Dobner T, Bourteele S, Kostezka U, Adler G, et al. p300 действует как коактиватор транскрипции Notch-1 млекопитающих. Мол клеточный биол. (2001) 21:7761–74. doi: 10.1128/MCB.21.22.7761-7774.2001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
30. Zhang Z, Li C, Wu F, Ma R, Luan J, Yang F, et al. Геномные вариации мевалонатного пути при порокератозе. Элайф. (2015) 4:e06322. doi: 10.7554/eLife.06322.021
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
31. Zhang SQ, Jiang T, Li M, Zhang X, Ren YQ, Wei SC, et al. Секвенирование экзома идентифицирует мутации MVK при диссеминированном поверхностном актиническом порокератозе. Нат Жене. (2012) 44:1156–60. doi: 10.1038/ng.2409
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
32. van der Burgh R, Ter Haar NM, Boes ML, Frenkel J. Дефицит мевалонаткиназы, метаболическое аутовоспалительное заболевание. Клин Иммунол. (2013) 147:197–206. doi: 10.1016/j.clim.2012.09.011
van der Burgh R, Ter Haar NM, Boes ML, Frenkel J. Дефицит мевалонаткиназы, метаболическое аутовоспалительное заболевание. Клин Иммунол. (2013) 147:197–206. doi: 10.1016/j.clim.2012.09.011
Полный текст CrossRef | Google Scholar
33. Houten SM, Kuis W, Duran M, de Koning TJ, van Royen-Kerkhof A, Romeijn GJ, et al. Мутации в MVK, кодирующем мевалонаткиназу, вызывают гипериммуноглобулинемию D и синдром периодической лихорадки. Нат Жене. (1999) 22:175–7. doi: 10.1038/9691
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
34. Sugiura K, Haruna K, Suga Y, Akiyama M. Генерализованный пустулезный псориаз, вызванный дефицитом антагониста рецептора интерлейкина-36, успешно вылечен аферезом адсорбции гранулоцитов и моноцитов. J Eur Acad Dermatol Venereol. (2014) 28:1835–6. doi: 10.1111/jdv.12383
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
35. Hüffmeier U, Wätzold M, Mohr J, Schön MP, Mössner R. Успешная терапия анакинрой у пациента с генерализованным пустулезным псориазом, несущего мутации IL36RN . Бр Ж Дерматол. (2014) 170:202–4. doi: 10.1111/bjd.12548
Успешная терапия анакинрой у пациента с генерализованным пустулезным псориазом, несущего мутации IL36RN . Бр Ж Дерматол. (2014) 170:202–4. doi: 10.1111/bjd.12548
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
36. Gómez-García F, Sanz-Cabanillas JL, Viguera-Guerra I, Isla-Tejera B, Nieto AV, Ruano J. Предварительный обзор использования препаратов, нацеленных на путь интерлейкина 1 в DIRA и DITRA. Дерматол Тер . (2018) 8: 539–56. doi: 10.1007/s13555-018-0269-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
37. Sugiura K, Endo K, Akasaka T, Akiyama M. Успешное лечение инфликсимабом случаев генерализованного пустулезного псориаза братьев и сестер, вызванного дефицитом антагониста рецептора интерлейкина-36. J Eur Acad Dermatol Venereol. (2015) 29:2054–6. doi: 10.1111/jdv.12590
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
38. Hospach T, Glowatzki F, Blankenburg F, Conzelmann D, Stirnkorb C, Müllerschön CS, et al. Предварительный обзор биологического лечения дефицита антагониста рецептора интерлейкина-36 (DITRA) у детей и подростков. Pediatr Rheumatol Online J . (2019) 17:37. doi: 10.1186/s12969-019-0338-1
Предварительный обзор биологического лечения дефицита антагониста рецептора интерлейкина-36 (DITRA) у детей и подростков. Pediatr Rheumatol Online J . (2019) 17:37. doi: 10.1186/s12969-019-0338-1
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
39. Аракава А., Ружичка Т., Принц Дж. К. Терапевтическая эффективность блокады интерлейкина 12/интерлейкина 23 при генерализованном пустулезном псориазе независимо от статуса мутации IL36RN. ДЖАМА Дерматол. (2016) 152:825–8. doi: 10.1001/jamadermatol.2016.0751
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
40. Cordoro KM, Ucmak D, Hitraya-Low M, Rosenblum MD, Liao W. Ответ на ингибирование интерлейкина (IL)-17 у подростка с тяжелыми проявлениями дефицита антагониста рецептора IL-36 (DITRA). JAMA Дерматол. (2017) 153:106–8. doi: 10.1001/jamadermatol.2016.3490
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
41.
