Каково практическое значение коагуляции: Роль процессов коагуляции в промышленности, медицине, биологии
Роль процессов коагуляции в промышленности, медицине, биологии
Коагуляционные
процессы часто происходят в природе,
например, в местах впадения рек в моря.
В речной воде всегда содержатся коллоидные
частицы ила, глины, песка или почвы.
При смешивании
речной воды с соленой морской (содержащей
бóльшее количество электролитов)
начинается коагуляция этих частиц, а
уменьшение скорости течения воды
способствует оседанию их в устье рек,
в результате чего образуются мели и
острова.
Коагуляцию широко
используют при очистке воды, поступающей
в водопроводную сеть. Для этого в нее
добавляют сульфаты алюминия и железа(III),
которые, являясь хорошими коагулянтами,
кроме того, гидролизуются с образованием
золей гидроксидов металлов. Частицы
этих золей обычно имеют заряд,
противоположный знаку заряда гранул,
присутствующих в воде. В результате
происходит взаимная коагуляция золей
и их осаждение.
Коллоидные растворы
содержатся в сточных водах многих
производств: например, устойчивые
эмульсии нефтепродуктов, различных
других органических жидкостей. Их
Их
разрушают обработкой сточных вод солями
щелочноземельных металлов.
В сахарной
промышленности коагуляционные процессы
используются при очистке сока сахарной
свеклы. В состав его, помимо сахарозы и
воды, входят несахаристые вещества,
часто в коллоидно-дисперсном состоянии.
Для их удаления в сок добавляют Са(ОН)2.
Его массовая доля при этом обычно не
превышает 2,5%. Примеси, находящиеся в
коллоидном состоянии, коагулируют и
оседают. Для удаления из сока избытка
Са(ОН)2через него пропускают
углекислый газ. В результате образуется
осадок СаСО3, который увлекает за
собой из раствора многие растворимые
примеси.
Процессы коагуляции
играют существенную роль в живом
организме, т.к. биологические жидкости
содержат в своем составе коллоидно-дисперсные
частицы, находящиеся в соприкосновении
с растворенными электролитами. В норме
данные системы обычно находятся в
состоянии равновесия и коагуляционные
процессы в них не протекают. Но это
Но это
равновесие можно легко нарушить при
внесении извне дополнительного количества
электролита. Причем, вводя его в организм,
надо учитывать не только его концентрацию
в биологической жидкости, но и заряд
ионов. Так, изотонический раствор NaClнельзя заменить изотоническим растворомMgCl2, поскольку в
этой соли, в отличие отNaCl,
содержатся двухзарядные ионыMg2+,
обладающие более высокой коагулирующей
способностью, чем ионыNa+.
При введении в
кровяное русло смеси солей следует
предварительно убедиться, что эта смесь
не обладает синергическим действием,
во избежание вредной для организма
коагуляции.
Решение многих
проблем в медицине: протезирование
кровеносных сосудов, клапанов сердца
и т.д. – зависит от процессов свертывания
крови. Их можно рассматривать как
коагуляцию эритроцитов. В хирургии во
время операций в кровь вводят антикоагулянты
(гепарин, модифицированный декстран,
полиглюкин). После операций и в случае
внутренних кровотечений, наоборот, –
электролиты, способствующие протеканию
коагуляции: капроновую кислоту,
протамин-сульфат.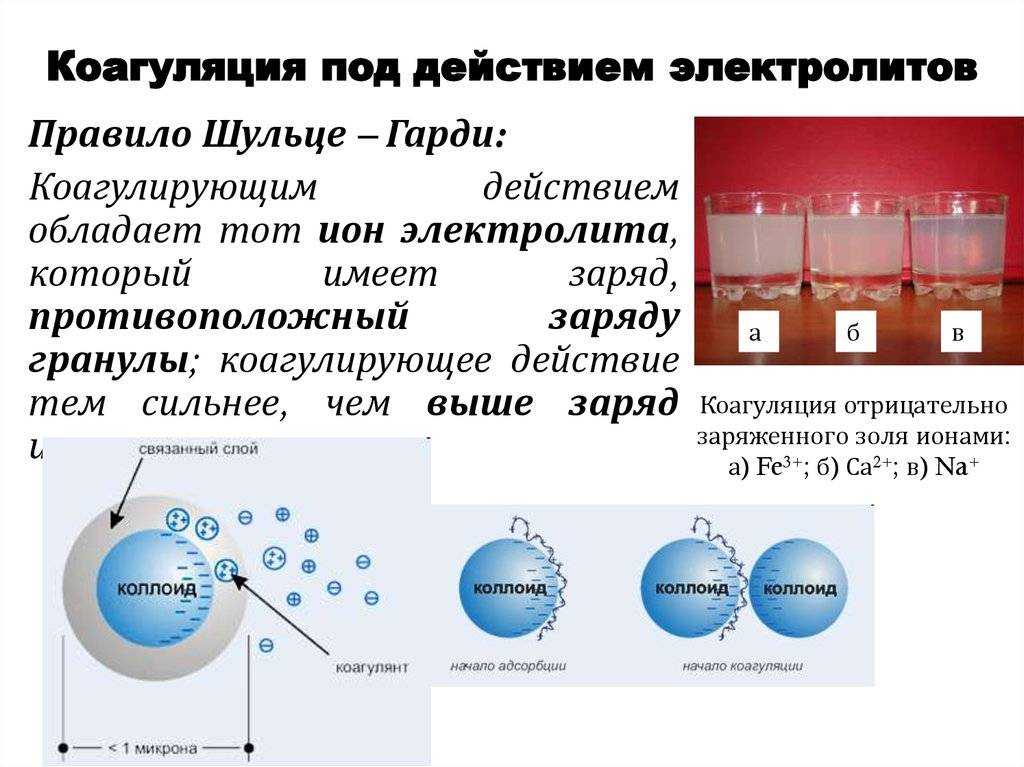
Для диагностики
многих заболеваний в клинических
лабораториях определяют скорость
оседания эритроцитов (СОЭ). При различных
патологиях по ряду причин коагуляция
эритроцитов усиливается, и скорость их
оседания становится большей, по сравнению
с нормой.
Образование
желчных, мочевых и других камней в
организме также связано с усилением
при патологических состояниях коагуляции
холестерина, билирубина, солей мочевой
кислоты вследствие ослабления
естественного защитного действия.
Изучение механизма этих процессов
крайне важно для выработки путей лечения
данных заболеваний.
ФГБОУ ВО ПГФА Минздрава России
Пермская государственная
фармацевтическая академия
Для слабовидящих
Осторожно, грипп!!!
…
Правила здоровья
. ..
..
еще …
Наши новости
ПГФА открывает прием на обучение в Королевстве Марокко
03 февраля 2023
В академии прошла встреча Секции по Международной деятельности Совета ректоров вузов Пермского края
28 января 2023
еще …
Наши события
Снова на лыжах
30 января 2023
ПГФА и группа российских университетов «РАКУС» наградили иностранных студентов-активистов
30 декабря 2022
еще …
Конференции, олимпиады, форумы…
Приглашение к участию в Международном литературном конкурсе «Живая латынь»
09 января 2023
I международная научно-практическая Олимпиада по философии для студентов медвузов
15 декабря 2022
Награждение победителей Олимпиады РКИ
15 декабря 2022
еще . ..
..
Новости спорта
На «Лыжне России»
13 февраля 2023
Матчи в рамках Чемпионата Пермского края среди женских команд по футболу
04 февраля 2023
Медийная команда Перми
03 февраля 2023
еще …
Button
Коммерческое предложение ПК 2023
Ученый совет
Научный полк
Обращение советов ректоров вызов Пермского края
Мисс Фармация-2019
День открытых дверей
Информация об аккредитации специалистов
Галерея новостей
Видеообзор — введение в профессию
Ректор ПГФА Алексей Юрьевич Турышев рассказывает о перспективах специальности и приёме в 2019 году
В ПГФА имеется 200 бюджетных мест для абитуриентов. Трудоустройство выпускников ПГФА почти 100 %. ПГФА обеспечивает половину кадровой потребности отрасли. Провизоры — аналитики, технологи, организаторы. Обеспечивается полный цикл обучения от создания молекулы до разработки лекарственной формы. Эфир 26 февраля 2019 года
Трудоустройство выпускников ПГФА почти 100 %. ПГФА обеспечивает половину кадровой потребности отрасли. Провизоры — аналитики, технологи, организаторы. Обеспечивается полный цикл обучения от создания молекулы до разработки лекарственной формы. Эфир 26 февраля 2019 года
Смотреть все видеообзоры о професии
Условия проживания студентов в общежитии № 2 (более новое первое общежитие не показано). Съёмка 2016 года.
Имеющиеся у ПГФА два общежития неизменно входят в десятку лучших общежитий образовательных учреждений города Перми. В общежитиях имеются столовая, кухни на каждом этаже, библиотека, спортзал, бытовая, душевая и постирочная комнаты (общежитие № 1 новее).
Первокурсники на лабораторных занятиях по физике в ПГФА. Съёмка 25 февраля 2019 года
На первом курсе студенты изучают биологию, физиологию, математику, физику, неорганическую химию, физическую химию, латинский язык, информатику, экономическую теорию, историю. Основной предмет — химия. За годы учёбы её будет 9 видов.
Впечатления первокурсника
после двух месяцев учёбы в 2018 году.
Ректор
Проректоры
Помощник ректора по воспитательной работе
Ученый совет
Административно — управленческие подразделения
Ведущий юрисконсульт
Учебные подразделения
Кафедры
Научные подразделения
Корпуса и общежития
Отдел качества
Региональный испытательный центр «Фарматест»
Полиграфический отдел
Стоматологическая клиника
Столовая
Здравпункт
Музей
Профком сотрудников
Профком студентов
Социально-психологическая служба
Тесты на коагуляцию: типы, процедура и результаты
Свертывание предотвращает чрезмерное кровотечение при порезах. Но кровь, двигающаяся по вашим сосудам, не должна свертываться. Если такие сгустки образуются, они могут попасть через кровоток в сердце, легкие или мозг. Это может вызвать сердечный приступ, инсульт или даже смерть.
Тесты на коагуляцию измеряют способность вашей крови сворачиваться и сколько времени требуется для свертывания.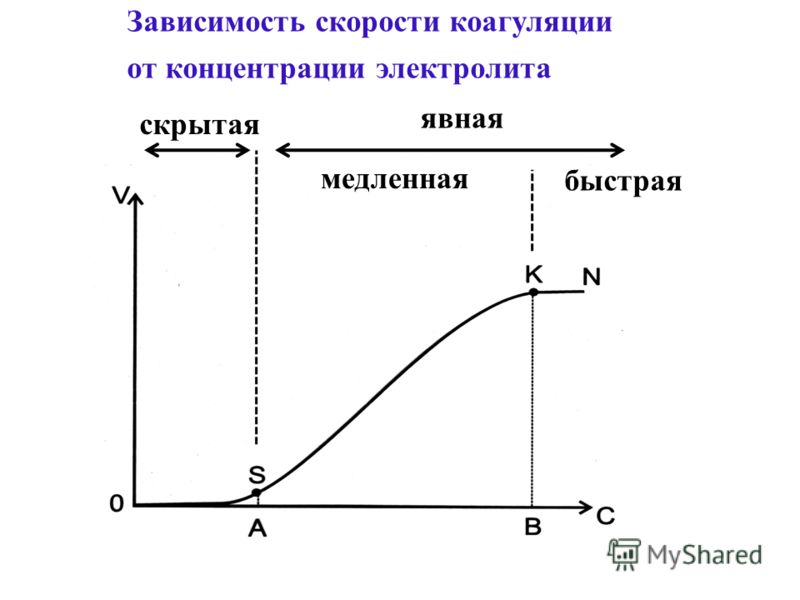 Тестирование может помочь вашему врачу оценить риск чрезмерного кровотечения или образования сгустков (тромбоз) где-то в ваших кровеносных сосудах.
Тестирование может помочь вашему врачу оценить риск чрезмерного кровотечения или образования сгустков (тромбоз) где-то в ваших кровеносных сосудах.
Узнать больше: Нарушения свертываемости крови »
Тесты на коагуляцию аналогичны большинству анализов крови. Побочные эффекты и риски минимальны. Медицинский работник возьмет образец крови и отправит его в лабораторию для тестирования и анализа.
Нарушения свертываемости крови могут вызвать опасное кровотечение или свертывание крови. Если ваш врач подозревает, что у вас нарушение свертываемости крови, он может порекомендовать один или несколько тестов на коагуляцию. Эти тесты измеряют различные белки и то, как они функционируют.
Состояния, которые могут вызывать проблемы со свертываемостью, включают:
- заболевания печени
- тромбофилию, то есть чрезмерное свертывание крови
- гемофилию, то есть неспособность нормально свертываться способность. Коагуляционные тесты также иногда рекомендуются перед операцией.

Существует множество типов тестов на коагуляцию. Разделы ниже включают объяснения некоторых из них.
Общий анализ крови (CBC)
Ваш врач может назначить общий анализ крови (CBC) как часть вашего обычного медосмотра. Результаты теста могут предупредить вашего врача, если у вас анемия или низкий уровень тромбоцитов, что может повлиять на вашу способность к свертыванию.
Анализ фактора V
Этот тест измеряет фактор V, вещество, участвующее в свертывании крови. Аномально низкий уровень может указывать на заболевание печени, первичный фибринолиз (распад тромбов) или синдром диссеминированного внутрисосудистого свертывания крови (ДВС-синдром).
Уровень фибриногена
Фибриноген — это белок, вырабатываемый вашей печенью. Этот тест измеряет количество фибриногена в крови. Аномальные результаты могут быть признаком чрезмерного кровотечения или кровоизлияния, фибринолиза или отслойки плаценты, которая представляет собой отделение плаценты от стенки матки.

Другие названия этого теста включают фактор I и тест на гипофибриногенемию.
Протромбиновое время (PT или PT-INR)
Протромбин — это еще один белок, вырабатываемый вашей печенью. Тест протромбинового времени (PT) измеряет, насколько хорошо и сколько времени требуется вашей крови для свертывания. Обычно это занимает от 25 до 30 секунд. Это может занять больше времени, если вы принимаете препараты для разжижения крови. Другие причины аномальных результатов включают гемофилию, заболевания печени и мальабсорбцию. Это также полезно для наблюдения за теми, кто принимает лекарства, влияющие на свертываемость крови, такие как варфарин (кумадин).
Подробнее: Тест протромбинового времени »
Результаты представлены в виде количества секунд, которое требуется крови для свертывания. Иногда в тесте PT используется расчет, называемый международным нормализованным отношением (МНО), для сравнения результатов разных лабораторий.
Ваш врач обычно назначает ПВ-тест вместе с другим тестом на свертываемость крови, который называется активированным частичным тромбопластиновым временем (АЧТВ).

Подсчет тромбоцитов
Тромбоциты — это клетки крови, которые способствуют свертыванию крови. У вас может быть аномально низкое число, если вы проходите химиотерапию, принимаете определенные лекарства или перенесли массивное переливание крови. Другими причинами низкого количества тромбоцитов являются целиакия, дефицит витамина К и лейкемия.
Узнать больше: Низкий уровень тромбоцитов (тромбоцитопения) »
Анемия, первичная тромбоцитемия или хронический миелогенный лейкоз (ХМЛ) могут вызывать аномально высокое количество тромбоцитов.
Тромбиновое время
Тромбиновое время измеряет, насколько хорошо работает фибриноген. Аномальные результаты могут быть связаны с наследственными нарушениями фибриногена, заболеваниями печени, некоторыми видами рака и приемом лекарств, влияющих на свертываемость крови.
Время кровотечения
Этот тест анализирует, насколько быстро мелкие кровеносные сосуды на коже закрываются и прекращают кровотечение.
 Он выполняется иначе, чем другие анализы крови.
Он выполняется иначе, чем другие анализы крови.Манжета для измерения артериального давления будет помещена на плечо и надута. Ваш лечащий врач сделает пару крошечных надрезов на нижней части руки. Порезы не будут глубокими и, как правило, будут ощущаться как царапины.
Ваш лечащий врач снимет манжету, когда она сдуется, и ненадолго приложит промокательную бумагу к порезам каждые 30 секунд, пока кровотечение не остановится.
Кровотечение обычно длится от одной до девяти минут. Тест считается безопасным и имеет мало побочных эффектов или рисков.
Тесты на коагуляцию проводятся так же, как и большинство анализов крови. Возможно, вам придется прекратить прием некоторых лекарств перед тестом. Никакой другой подготовки не требуется.
Ваш поставщик медицинских услуг стерилизует пятно на тыльной стороне ладони или внутри локтя. Они вставят иглу в вену. Большинство людей ощущают незначительную палку.
Ваш лечащий врач возьмет и соберет вашу кровь.
 Тогда, скорее всего, на место прокола наложат повязку.
Тогда, скорее всего, на место прокола наложат повязку.Побочные эффекты теста на коагуляцию обычно незначительны. У вас может быть небольшая болезненность или синяки на месте. Риски включают головокружение, боль и инфекцию.
Если у вас сильное кровотечение, процедура будет тщательно контролироваться.
Образец будет отправлен в лабораторию для тестирования и анализа.
Результаты анализов крови отправляются из лаборатории вашему врачу. Значения могут варьироваться от одной лаборатории к другой, поэтому попросите своего врача объяснить результаты. Если ваш врач диагностирует у вас нарушение свертываемости крови, лечение будет зависеть от конкретного диагноза.
Кровотечение, коагуляция и гемостаз (у детей) | ColumbiaDoctors
Записаться на прием
Назначить встречу. Звоните (212) 305-9770.
Что такое коагуляция?
Циркуляция крови важна для правильной работы организма. Коагуляция (или свертывание) — это процесс, посредством которого кровь превращается из жидкой в более густую, как гель.
 Коагуляция является частью более крупного процесса, называемого гемостаз , то есть способ, которым организм останавливает кровотечение, когда это необходимо.
Коагуляция является частью более крупного процесса, называемого гемостаз , то есть способ, которым организм останавливает кровотечение, когда это необходимо.Когда коагуляция работает должным образом, это важный шаг на пути к заживлению раны. При разрыве кровеносного сосуда, например, при порезе или другой травме, коагуляция способствует образованию сгустка, состоящего из вещества, называемого фибрином. Сгусток закрывает отверстие до тех пор, пока ткани не смогут восстановиться.
Когда происходит что-то, что препятствует коагуляции, это может привести к кровоподтекам, которые возникают, когда происходит кровотечение из мелких кровеносных сосудов под кожей, или к кровоизлиянию, которое является неконтролируемым кровотечением. (Слово «кровоизлияние» противоположно гемостазу.)
Когда коагуляция происходит там, где ее не должно быть, может образоваться сгусток, который блокирует кровеносный сосуд, а не фиксирует его. Тромбоз – это образование кровяного сгустка, называемого тромбом , внутри кровеносного сосуда, который блокирует ток крови по системе кровообращения.

К основным причинам тромбоза относятся состояния, при которых кровь свертывается легче, повреждение близлежащих тканей и состояния, препятствующие нормальному току крови. Если тромб достаточно велик, чтобы уменьшить кровоток, он может помешать некоторым тканям получать необходимый им кислород. Более крупный тромб, вызывающий гораздо большее препятствие кровотоку, может привести к гибели ткани, также называемой инфарктом. Сгусток крови, который перемещается из одного места в другое в организме, называется0007 эмбол .
Нарушения свертывания крови и гемостаза могут передаваться при рождении или развиваться позже. Гемофилия, наиболее распространенное состояние, приводящее к кровотечению, является примером состояния, которое является врожденным или присутствует с рождения.
Наш подход к нарушениям свертывания крови и гемостаза
Наш подход к лечению тромбоза начинается с выяснения причины образования тромба, устранения любых идентифицируемых факторов риска и иногда с использования разбавителей крови, называемых антикоагулянтами, для предотвращения дальнейшего нежелательного свертывания крови.
 В целом, наш подход к тромбозу соответствует опубликованным рекомендациям Американского колледжа врачей-пульмонологов. Мы стараемся свести к минимуму время, в течение которого ребенок находится на антикоагулянтах, и в то же время убедиться, что мы снижаем риск увеличения или повторного образования тромба.
В целом, наш подход к тромбозу соответствует опубликованным рекомендациям Американского колледжа врачей-пульмонологов. Мы стараемся свести к минимуму время, в течение которого ребенок находится на антикоагулянтах, и в то же время убедиться, что мы снижаем риск увеличения или повторного образования тромба.В некоторых случаях организму не хватает веществ, необходимых для образования тромба. Это может произойти, потому что либо человек родился с недостаточным количеством этих веществ (наследственное), либо у него есть состояние, препятствующее свертыванию крови (приобретенное). Часто к нам обращаются пациенты, у которых есть проблемы с образованием тромба, из-за необычного кровотечения.
Во время первого визита мы стараемся как можно быстрее понять характер кровотечений у пациента, в том числе расспрашиваем о любой семейной истории кровотечений и любых возможных причинах приобретенного состояния кровотечения. Это помогает нам получить лучшие анализы и обнаружить причину кровотечения.





 Он выполняется иначе, чем другие анализы крови.
Он выполняется иначе, чем другие анализы крови. Тогда, скорее всего, на место прокола наложат повязку.
Тогда, скорее всего, на место прокола наложат повязку. Коагуляция является частью более крупного процесса, называемого гемостаз , то есть способ, которым организм останавливает кровотечение, когда это необходимо.
Коагуляция является частью более крупного процесса, называемого гемостаз , то есть способ, которым организм останавливает кровотечение, когда это необходимо.
 В целом, наш подход к тромбозу соответствует опубликованным рекомендациям Американского колледжа врачей-пульмонологов. Мы стараемся свести к минимуму время, в течение которого ребенок находится на антикоагулянтах, и в то же время убедиться, что мы снижаем риск увеличения или повторного образования тромба.
В целом, наш подход к тромбозу соответствует опубликованным рекомендациям Американского колледжа врачей-пульмонологов. Мы стараемся свести к минимуму время, в течение которого ребенок находится на антикоагулянтах, и в то же время убедиться, что мы снижаем риск увеличения или повторного образования тромба.