Фосфатидилхолина структура: Функциональные свойства и преимущества липосом
Функциональные свойства и преимущества липосом
В работе рогового слоя кожи, служащего защитой от внешних физических воздействий, фосфолипиды – и фосфатидилхолин в частности – играют не столь важную роль. В липидных бислоях обнаруживаются лишь следы фосфолипидов, в то время как основными компонентами являются свободные жирные кислоты, холестерин, церамиды, триглицериды и углеводороды. Однако в более глубоких слоях эпидермиса фосфатидилхолин является одним из важнейших компонентов всех биологических мембран, в особенности плазматических клеточных мембран. Кроме того, фосфатидилхолин опосредованно участвует в преобразовании церамидов в сфингомиелин. В этом случае фосфатидилхолин, препятствуя увеличению количества церамидов в клетках, продлевает их жизнь в апоптозе (Рис.1).
Рис.1 Медиаторная роль фосфатидилхолина в биосинтезе липидов при созревании барьера.
Пояснения к рисунку: в живых кератиноцитах фосфатидилхолин отвечает за превращение церамидов в сфингомиелины, а увеличение уровня церамидов внутри живых клеток является признаком клеточного старения.
Состав фосфатидилхолина человека и фосфатидилхолина растительного происхождения представлен жирными кислотами, среди которых доминируют ненасыщенные жирные кислоты. Наиболее часто используемый в косметических препаратах фосфатидилхолин сои содержит до 70% линолевой кислоты в общей массе жирных кислот. Температура фазового перехода фосфатидилхолина сои в водосодержащих системах ниже 00С. В этом заключается его способность разжижать липидные бислои рогового слоя, которая характеризуется степенью увеличения показателя трансэпидермальной потери воды (TEWL) после кратковременного воздействия. Незначительное увеличение показателя TEWL совпадает с проникновением фосфатидилхолина и сходных с ним по формуле активных агентов. Из-за большого содержания линолевой кислоты и высокой проникающей способности, фосфатидилхолин сои быстро доставляет линолевую кислоту в кожу и может быть использован для успешного лечения акне.
Прочно связываясь с поверхностными белками эпидермиса (например, кератином), фосфатидилхолин оказывает кондиционирующий и смягчающий эффекты, хорошо известные со времен начала разработок продуктов по уходу за кожей. Так, например, шампуни раньше содержали в своем составе яичный желток, который смягчал волосы и предохранял их от статического электричества. Яичный желток богат лецитином, основным компонентом которого является фосфатидилхолин.
Так, например, шампуни раньше содержали в своем составе яичный желток, который смягчал волосы и предохранял их от статического электричества. Яичный желток богат лецитином, основным компонентом которого является фосфатидилхолин.
В данном случае не имеет значения, в какой форме фосфатидилхолин входит в состав препарата. При приготовлении фосфатидилхолина практически всегда будут образовываться бислой содержащие структуры, такие как липосомы, поскольку это наиболее естественная форма организации данного вещества. Например, фосфатидилхолин при большом количестве воды самопроизвольно трансформируется в липосомы, которые стабилизируются при добавлении невысоких концентраций солей или водорастворимых органических соединений, таких как мочевина. С другой стороны, известно, что неинкапсулированные вещества намного легче проникают через роговой слой, предварительно обработанный фосфатидилхолином. Поэтому липосомы не являются обязательным условием проявления функциональных свойств фосфатидилхолина, но их использование удобно, поскольку работа с чистым фосфатидилхолином требует большого опыта, а иногда еще и терпения.
Поскольку фосфатидилхолин известен способностью увеличивать проницаемость мембран, свойство это обычно ассоциируется с липосомами. Липосомы – это везикулы, которые способствуют облегчению переноса косметических агентов в роговой слой. В этих условиях роговой слой выступает в роли депо для этих агентов. Системные исследования активных препаратов показали, что увеличение впитывающей способности не означает увеличения проницаемости. Часто фосфатидилхолин замедляет проницаемость активных агентов и предотвращает резкое увеличение их концентрации в начале применения. Происходит более продолжительное по времени прохождение веществ из рогового слоя. Это свойство делает фосфатидилхолин и липосомы чрезвычайно привлекательными при применении витаминов, поливитаминов и других веществ, оказывающих воздействие на регенерирующую способность базальных клеток эпидермиса.
С другой стороны, липосомы, состоящие из ненасыщенного фосфатидилхолина, следует использовать с большой осторожностью, поскольку они не улучшают естественную барьерную функцию кожи, за исключением их опосредованного, участия в образовании церамида I. Церамид I содержит линолевую кислоту и является одним из важных активизирующих барьерную функцию веществ. В препаратах, предназначенных для защиты кожи, следует использовать вместо ненасыщенного фосфатидилхолина полностью гидрогенизированный фосфатидилхолин (Рис. 2).
Церамид I содержит линолевую кислоту и является одним из важных активизирующих барьерную функцию веществ. В препаратах, предназначенных для защиты кожи, следует использовать вместо ненасыщенного фосфатидилхолина полностью гидрогенизированный фосфатидилхолин (Рис. 2).
Рис. 2. Гидрогенизированный фосфатидилхолин (n=14, 16)
Аналогично церамидам гидрогенезированный фосфатидилхолин способен стабилизировать нормальный уровень TEWL (трансэпидермальной потери воды) роговой слоя после воздействия на него гидрофильных или липофильных веществ. В таблице 1 представлены основные свойства ненасыщенного и гидрогенизированного фосфатидилхолина. Гидрогенизированный фосфатидилхолин, полученный из сои, содержит в основном пальмитиновую и стеариновую кислоты. Поскольку ненасыщенный и насыщенный фосфатидилхолин обладают специфическими свойствами, имеет смысл совмещение их в одном косметическом или дерматологическом продукте.
Аббревиатуры: TEWL – трансэпидермальная потеря воды (transepidermal water loss), CIR – Cosmetic Ingredient Review (организация по оценке безопасности компонентов применяемых в косметике)
Липосомы
Липосомы представляют собой сферческие везикулы, мембраны которых состоят из одного (однослойные) или более (многослойные) бислоев фосфатидихолина. Иногда, особенно в патентах, говорят не о липосомах, а о «везикулах с внутренней водной фазой». В зависимости от процесса приготовления везикулы могут отличаться как по размеру (диаметр в пределах от 15 до 3500 нм), так и по форме (одиночные и соединенные частицы). Наибольшая стабильность липосом наблюдается в пределах 100 – 300 нм в чистых водных дисперсиях высокообогащенного (80-100%) фосфатидилхолина сои.
Иногда, особенно в патентах, говорят не о липосомах, а о «везикулах с внутренней водной фазой». В зависимости от процесса приготовления везикулы могут отличаться как по размеру (диаметр в пределах от 15 до 3500 нм), так и по форме (одиночные и соединенные частицы). Наибольшая стабильность липосом наблюдается в пределах 100 – 300 нм в чистых водных дисперсиях высокообогащенного (80-100%) фосфатидилхолина сои.
Эффективными препаратами являются чистые дисперсии липосом с липофильными добавками на мембранах сфер и/или гидрофильными добавками на внутренней и внешней водяных фазах в пределах диапазона их несущей способности. Проведены исследования с целью повысить способность липосом инкапсулировать липиды, поскольку потребители привыкли пользоваться богатыми липидами кремами. Были предприняты попытки ввести в дисперсии липосом более высокое содержание липидов и для стабилизации добавляли дополнительно эмульгаторы. Сегодня известно, что сочетаемость липосом и эмульгаторов ограничена. Более того, дополнительные эмульгаторы оказывают ослабляющее действие на барьерное сродство фосфатидилхолина. Они вымывают фосфатидилхолин и липиды из кожи во время очищения. Из этого положения есть только один рациональный выход – использовать вместо липосом наночастицы («наноэмульсии», «нанодисперсии»), состоящие из фосфатидилхолина и липидов. Установлено, что в момент, когда исчерпывается способноcть бислоев включать липиды, капельки масла начинают соединяться с липосомами [8]. Дальнейшее увеличение соотношения липиды/фосфатидилхолин и использование гомогенизаторов высокого давления приводит к образованию наночастиц. Наночастицы состоят из капелек масла, окруженных монослоем фосфатидилхолина. Преимущество наночастиц в том, что они позволяют вводить в состав большее количество липидов, оставаясь при этом стабильными, и не требуют введения дополнительных эмульгаторов.
Более того, дополнительные эмульгаторы оказывают ослабляющее действие на барьерное сродство фосфатидилхолина. Они вымывают фосфатидилхолин и липиды из кожи во время очищения. Из этого положения есть только один рациональный выход – использовать вместо липосом наночастицы («наноэмульсии», «нанодисперсии»), состоящие из фосфатидилхолина и липидов. Установлено, что в момент, когда исчерпывается способноcть бислоев включать липиды, капельки масла начинают соединяться с липосомами [8]. Дальнейшее увеличение соотношения липиды/фосфатидилхолин и использование гомогенизаторов высокого давления приводит к образованию наночастиц. Наночастицы состоят из капелек масла, окруженных монослоем фосфатидилхолина. Преимущество наночастиц в том, что они позволяют вводить в состав большее количество липидов, оставаясь при этом стабильными, и не требуют введения дополнительных эмульгаторов.
Дисперсии липосом на основе ненасыщенного фосфатидилхолина нестабильны и быстро окисляются. Как и линолевые эфиры и линолевые диглицериды, эти дисперсии должны быть стабилизированы антиоксидантами. С точки зрения натуральности, лучше использовать комплекс витаминов С и Е (соответственно, их производные – ацетаты и пальмитаты). В некоторых случаях фосфатидилхолин и мочевина демонстрируют способность стабилизировать друг друга [9,10].
С точки зрения натуральности, лучше использовать комплекс витаминов С и Е (соответственно, их производные – ацетаты и пальмитаты). В некоторых случаях фосфатидилхолин и мочевина демонстрируют способность стабилизировать друг друга [9,10].
Ненасыщенный фосфатидилхолин может быть замещен насыщенным, типа гидрогенизированного фосфатидилхолина сои. Так как температура фазового перехода у гидрогенизированного фосфатидилхолина значительно выше, приготовление липосом на их основе технологически более сложный процесс и ограничивает их фармакологическое применение.
Новая разработка в области косметических средств с использованием гидрогенизированного фосфатидилхолина сои – это технология DMS (дерма-мембранная структура – Derma Membrane Structure) [11]. DMS – это обычные кремы, содержащие гидрогенизированный фосфатидилхолин сои, совместимые с кожным салом триглицериды средней цепи (MCT – medium chain triglycerides), масло ши и сквалан. Наряду с дисперсиями липосом и наночастиц, DMS являются еще одним способом сочетания фосфатидилхолина с гидрофильными и липофильными составляющими без использования дополнительных эмульгаторов. DMS устойчивы к воде и поту и, поэтому, подходят для защиты кожи, создания солнцезащитных кремов без добавления силиконов и\или минеральных масел. DMS можно легко трансформирать в другие конечные продукты путем простого перемешивания с жидкими липидами и/или водными фазами при комнатной температуре.
DMS устойчивы к воде и поту и, поэтому, подходят для защиты кожи, создания солнцезащитных кремов без добавления силиконов и\или минеральных масел. DMS можно легко трансформирать в другие конечные продукты путем простого перемешивания с жидкими липидами и/или водными фазами при комнатной температуре.
Рис. 3. Препараты с фосфатидилхолином без дополнительных эмульгаторов
Как отмечалось ранее, DMS предназначены для защиты кожи, однако добавление наночастиц и/или дисперсий липосом обогащает DMS ненасыщенным фосфатидилхолином, содержащим линолевую кислоту. Получаемый продукт имеет кремовую консистенцию, стабилен и не комедогенен. Эффект кремов с DMS на увлажнение, смягчение и тонизацию кожи сохраняется в течение нескольких дней после применения.
Липосомы, наночастицы и DMS требуют использования консервантов. Здесь могут возникнуть сложности, поскольку фосфатидилхолин (лецитин) дезактивирует большинство традиционных консервантов [12].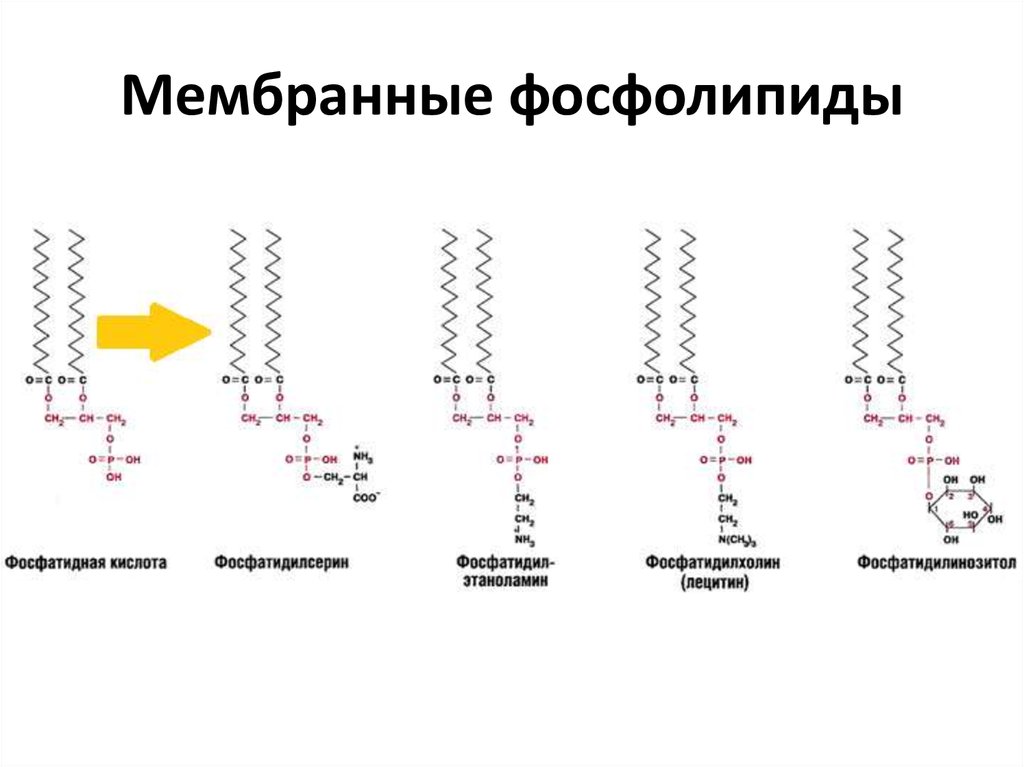 С другой стороны, следует избегать проникновения консервантов в кожу, так как они могут вызвать раздражение и сенсибилизацию кожи. В данной ситуации предпочтительными являются гликоли, такие как, пропиленгликоль, глицерин, бутиленгликоль, пентиленгликоль, гексиленгликоль, сорбитол и их сочетания. В отличие от этанола, применение которого ограничено концентрацией, данные полиолы одновременно обладают и увлажняющим эффектом.
С другой стороны, следует избегать проникновения консервантов в кожу, так как они могут вызвать раздражение и сенсибилизацию кожи. В данной ситуации предпочтительными являются гликоли, такие как, пропиленгликоль, глицерин, бутиленгликоль, пентиленгликоль, гексиленгликоль, сорбитол и их сочетания. В отличие от этанола, применение которого ограничено концентрацией, данные полиолы одновременно обладают и увлажняющим эффектом.
В начале проведения разработок в области липосом фосфатидилхолин из-за его гидролитической нестабильности в водных системах в течение длительного времени и высоких температур заменяли на полиглицерины и другие синтетические производные. Фосфатидилхолин распадается на лизофосфатидилхолин и свободные жирные кислоты. Разрыв глицеридной связи, происходит в основном при рН выше 7, поэтому препараты с показателем рН в пределах от 5,5 до 7 являются для большинства случаев использования достаточно стабильными. На гидролиз фосфатидилхолина также влияет количество дополнительных поверхностно-активных составляющих. Это еще одна причина использования дисперсий липосом без дополнительных эмульгаторов.
Это еще одна причина использования дисперсий липосом без дополнительных эмульгаторов.
Как уже отмечалось выше, дисперсии липосом являются очень удобным способом включения фосфатидилхолина в косметические препараты для получения наиболее полного спектра функциональности. В продаже имеются предлипосомные жидкие фазы с содержанием фосфатидилхолина до 20% и более [13]. Существуют также работы по использованию быстрорастворимых липосом в сочетании с углеводами в форме порошков [1]. Интерес представляют также масла, образующие дисперсии липосом без дополнительных эмульгаторов [14]. Эти препараты имеют в своей основе смесь фосфатидилхолина, триглицеридов и спирта. Липосомы образуются самопроизвольно при вливании смесей в воду. Такие липосомы имеют высокое сродство к поверхностным липидам кожи, и могут быть использованы при уходе за обезвоженной и чувствительной кожей. Описаны многочисленные способы приготовления липосом [1].
Большинство специалистов, работающих в области дисперсий липосом, сегодня сходятся во мнении, что липосомы не проникают в кожу нетронутыми везикулами, и не впитываются в кожу. По современным представлениям, липосомы, как правило, деформируются и фрагментируются. Поэтому их размер, форма и многослойная структура не имеют значения при применении. Имеет значение – химическая композиция всего препарата.
По современным представлениям, липосомы, как правило, деформируются и фрагментируются. Поэтому их размер, форма и многослойная структура не имеют значения при применении. Имеет значение – химическая композиция всего препарата.
Области применения фосфатидилхолина вытекают из его многофункциональных свойств. Препараты с ненасыщенным фосфатидилхолином используются для поддержания процессов регенерации кожи, борьбы со старением, предотвращения угревой сыпи и доставки в кожу других активных агентов, таких как витамины и их производные. Препараты с гидрогенизированным фосфатидилхолином используются для защиты кожи, в том числе и от солнца [15]. На рисунке 4 показан выбор основных компонентов для подготовки «натуральных» составов, которые будут совместимы с роговым слоем, компонентами кожного сала и их функциями.
Рис. 4. Основные компоненты «натуральных» препаратов
Подписи к рисунку: horny layer — роговой слой, deeper skin layers — глубокие слои кожи, PC — фосфатидилхолин, РС-Н — гидрогенизированный фосфатидилхолин, МСТ-триглицериды средней цепи, SPF — солнцезащитный фактор, NMF — натуральный увлажняющий фактор, MeX- минеральные соли, AA- активные агенты, barrier — барьер, sebum – кожное сало, sun protection – защита от солнца, skin moisturizing — увлажнение кожи, gradient of mineral salts — градиент минеральных солей, linoleic acid ceramides — церамиды линолевой кислоты, vitamins — витамины.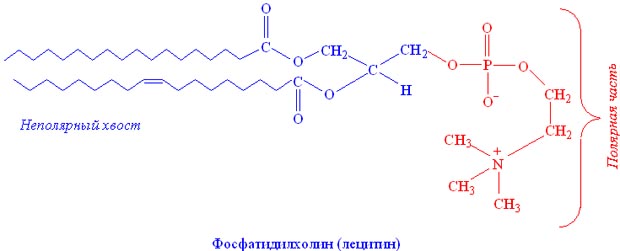
Дисперсии липосом являются не только инновационным и эффективным косметическим продуктом, но и удобной формой для работы с фосфатидилхолином. Они с успехом используются в дерматологии для профилактики и лечения различных кожных заболеваний. В таблице 2 приведена сравнительная характеристика липосом с препаратами на основе фосфатидилхолина.
Липосомы, наночастицы и DMS структуры более совместимы со структурой кожи в отличии от обычно применяемых традиционны эмульсии. «Совместимость» означает, что препараты не нарушают целостность липидных бислоев кожи и не вымываются во время очищения кожи. С точки зрения современных стратегий косметики, эти препараты содержат минимальное количество вспомогательных компонентов, которые являются лишь дополнительной нагрузкой для кожи. «Совместимость» означает также, что липиды и гидрофильные агенты вводятся в роговой слой, а естественные условия остаются ненарушенными.
Следует отметить тот факт, что фосфатидилхолин не требует применения в больших концентрациях, так как опыт показывает, что препараты остаются стабильными и при малых количествах. При повторном применении препаратов на основе фосфатидилхолина в роговом слое наблюдается кумулятивный эффект. Липосомы, наночастицы и DMS совместимы друг с другом и в этом смысле могут быть использованы как модульная система. Составление рецептур на их основе открывает неограниченные возможности и большое будущее этих препаратов.
Литература.
1. Lasic DD. Liposomes and niosomes. In: Rieger MM, Rh ein LD, eds. Surfactants in Cosmetics. 2d ed. New York: Marcel Dekker, 1997:263-283.
2. Wendel A. Lecithins, phospholipids, liposomes in co smetics, dermatology and in washing and cleansing preparations. Augsburg: Verlag fuer chemische Industrie, 1994.
3. Wendel A. Lecithins, phospholipids, liposomes in cosmetics, dermatology and in washing and cleansing preparations Part II. Augsburg: Verlag fuer chemische Industrie, 1997.
Augsburg: Verlag fuer chemische Industrie, 1997.
4. Braun-Falco O, Korting HC, Maibach HI, eds. Liposom e Dermatics. Berlin: Springer-Verlag, 1992.
5. Ghyczy M, Nissen H-P, Biltz H. The treatment of acne vulgaris by phosphatidylcholine from soybeans, with a high content of linoleic acid. J Appl Cosmetol 1996; 14:137-145.
6. Lautenschlaeger H. Kuehlschmierstoffe und Hautschutz – neue Perspektiven. Mineraloeltechnik 1998 (5):1-16.
7. Cosmetic Ingredient Review. Lecithin and Hydrogenated Lecithin. Washington: The Cosmetic, Toiletry, and Fragrance Association, 1996.
8. Lautenschlaeger H. Liposomes in dermatological preparations Part II. Cosmet Toilet 1990; 105 (7):63-72.
9. Nippon Surfactant Kogyo KK, Japanese Patent 199104364104 (1992).
10. Lautenschlaeger, German Patent 4021082 (1990).
11. Kutz G. Galenische Charakterisierung ausgewaehlter Hautpflegeprodukte.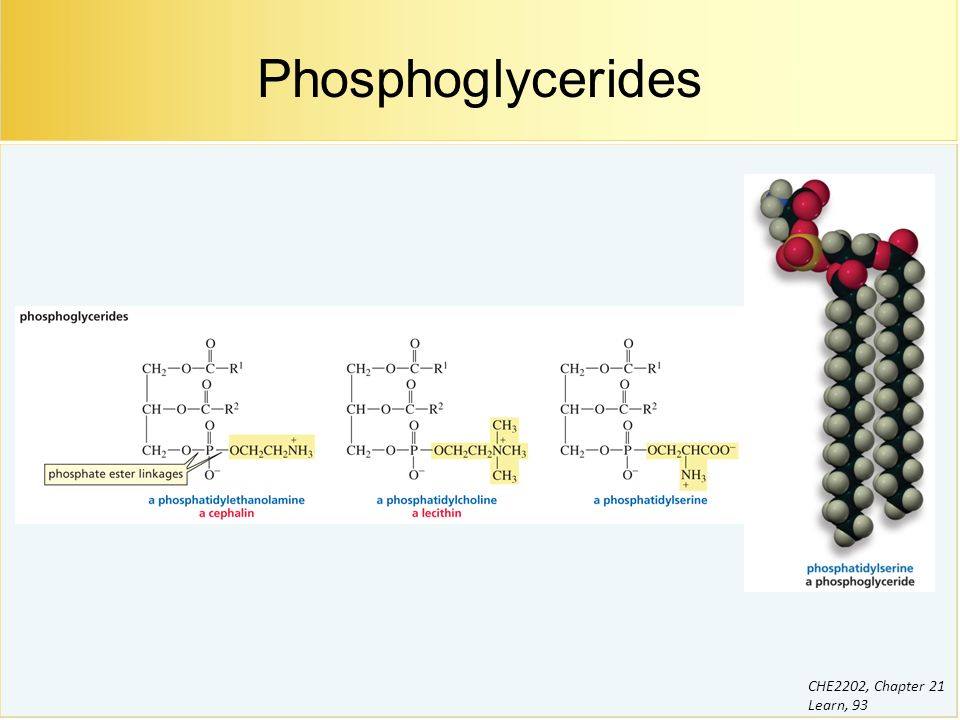 Pharmazeutische Zeitung 1997; 142 (45):4015-4019.
Pharmazeutische Zeitung 1997; 142 (45):4015-4019.
12. Wallhaeusser KH. Praxis der Sterilisation, Desinfektion – Konservierung. 5th ed. Stuttgart: Georg Thieme Verlag, 1995:43, 394.
13. Roeding J. Properties and characterisation of pre-liposome systems. In Braun-Falco O, Korting HC, Maibach HI, eds. Liposome Dermatics. Berlin: Springer-Verlag, 1992:110-117.
14. Lautenschlaeger, German Patent 4021083 (1990).
15. Feingold KR. Permeability barrier homoeostasis: Itsbiochemical basis and regulation. Cosmet Toilet 1997; 112 (7):49-59. 16.
Dr. Hans Lautenschläger
Опубликовано в Handbook of Cosmetic Science and Technology, p. 155-163
edited by A. O. Barel, M. Paye and H. I. Maibach CRC Press Taylor & Francis Group, Boca Raton 2006
Использование фосфолипидов в косметике | Журнал «Сырье и Упаковка»
В. А. Аверьянова, к.б.н. А. Аверьянова, к.б.н. |
Фосфолипиды – эмульгаторы и активные вещества для укрепления кожного барьера
Косметологи отмечают, что в последнее время во многих странах, особенно в больших городах, увеличивается количество людей, страдающих от симптомов, связанных с такими состояниями, как сухая, чувствительная или гиперреактивная кожа. Специалисты связывают такое состояние кожи с нарушениями в функционировании липидного барьера рогового слоя. Одной из причин этого явления можно считать содержание в составе косметических рецептур значительных концентраций веществ, способных оказывать разрушающее действие на липидный барьер. В качестве примера таких веществ можно привести ПАВ, которые могут работать в составе косметической рецептуры, том числе и как эмульгаторы. Другая причина – большое количество агрессивных загрязняющих частиц в воздухе больших городов, которые могут инициировать окисление кожного сала. Как результат – число людей, которые считают свою кожу сухой, раздраженной и очень чувствительной все время увеличивается. Можно сказать, что это люди с нарушенной барьерной функцией кожи.
Можно сказать, что это люди с нарушенной барьерной функцией кожи.
С целью укрепления барьера, в состав косметических рецептур целесообразно вводить такие ингредиенты, как фосфолипиды, которые являются натуральными, биоразлагаемыми и многофункциональными компонентами. Это не только технические добавки, проявляющие эмульгирующие свойства и позволяющие получать ламеллярные композиции, не только вещества, образующие липосомы, и, тем самым, облегчающие доставку активных компонентов в косметике, но и увлажняющие активные компоненты, доставляющие в кожу линолевую и линоленовую кислоты. Было показано, что линоленовая кислота из фосфолипидов проникает довольно глубоко в кожу человека и может работать, как строительный материал – она включается в состав собственных церамидов кожи и способствует укреплению ее естественной барьерной функции [1]. Также есть данные, демонстрирующие, что фосфолипиды подавляют развитие акне, облегчают такие состояния кожи, как нейродермит и псориаз [1]. Сегодня на рынке косметического сырья представлено большое количество продуктов на основе фосфолипидов, которые позволяют создавать готовые композиции с оптимальными косметическими свойствами. Причем это сырье не только импортного, но и отечественного производства.
Причем это сырье не только импортного, но и отечественного производства.
Химическое строение и свойства фосфолипидов
С химической точки зрения фосфолипиды – это сложные эфиры многоатомных спиртов и высших жирных кислот, которые содержат остаток фосфорной кислоты и соединенную с ней добавочную группу атомов различной химической природы, например, холин в случае фосфатидилхолина или этаноламин в случае фосфатидилэтаноламина. В зависимости от того, какой многоатомный спирт лежит в основе структуры фосфолипида, различают глицерофосфолипиды (на основе глицерина), фосфосфинголипиды (на основе сфингозина) и фосфоинозитиды (на основе инозитола). Наиболее распространены в природе глицерофосфолипиды, в частности, фосфатидилхолин (рис.1), который является основным липидом клеточных мембран.
Рисунок 1. Химическая формула и молекулярная модель фосфатидилхолина
Все глицерофосфолипиды построены по единому плану, и их молекулы стерически хорошо соответствуют друг другу. В то же время, огромное разнообразие фосфолипидов обеспечивается разнообразием жирных кислот, которые входят в состав их молекул. Так, есть несколько десятков природных видов фосфатидилхолина (рис.2).
В то же время, огромное разнообразие фосфолипидов обеспечивается разнообразием жирных кислот, которые входят в состав их молекул. Так, есть несколько десятков природных видов фосфатидилхолина (рис.2).
Рисунок 2. Амфифильное строение молекулы фосфолипидов
Благодаря своему химическому строению фосфолипиды – это амфифильные молекулы. В состав полярной «головки» входят глицерин (или другой многоатомный спирт), отрицательно заряженный остаток фосфорной кислоты и присоединенная к нему группа атомов, часто несущая положительный заряд. Неполярные хвосты – это остатки жирных кислот, присоединенные к многоатомному спирту сложноэфирными связями (Рис 2). В случае лизофосфолипидов (моноацильных фосфолипидов) к остатку глицерина присоединена только одна жирная кислота, в этом случае молекула фосфолипида имеет конусообразную форму и может образовывать мицеллы в водном растворе (Рис.3). Если образование эфирной связи идет по двум гидроксильным группам глицерина, образуется диацилфосфолипид, содержащий остатки двух молекул жирных кислот. Молекула диацилфосфолипида имеет форму цилиндра и в водном растворе образует ламеллярные бислои, в которых гидрофобные хвосты ориентированы внутрь слоя, а гидрофильные головки – наружу (Рис.3). Благодаря этому свойству, фосфолипиды способны формировать биологические мембраны (липидный бислой), липосомы и ламеллярные эмульсии. В составе этих эмульсий фосфолипиды формируют бислои, окружающие масляные капли и стабилизирующие их. Такая структура позволяет увеличить в составе эмульсии количество масел и других липидов, снизить концентрацию других эмульгаторов, а наличие водной фазы позволяет включать в средства водорастворимые биологически активные вещества.
Молекула диацилфосфолипида имеет форму цилиндра и в водном растворе образует ламеллярные бислои, в которых гидрофобные хвосты ориентированы внутрь слоя, а гидрофильные головки – наружу (Рис.3). Благодаря этому свойству, фосфолипиды способны формировать биологические мембраны (липидный бислой), липосомы и ламеллярные эмульсии. В составе этих эмульсий фосфолипиды формируют бислои, окружающие масляные капли и стабилизирующие их. Такая структура позволяет увеличить в составе эмульсии количество масел и других липидов, снизить концентрацию других эмульгаторов, а наличие водной фазы позволяет включать в средства водорастворимые биологически активные вещества.
Рисунок 3
Фосфолипиды – эссенциальные вещества, незаменимые для человека. Они не вырабатываются в организме в достаточном количестве и должны поступать с пищей. Их важнейшей функцией является непосредственное участие в строительстве клеточных мембран. Согласно последним исследованиям, большинство людей недополучает до 40% необходимой нормы фосфолипидов. Содержание фосфолипидов в пищевых маслах относительно невелико и редко превышает 2%, наибольшее содержание можно отметить у соевого, подсолнечного масел и масла хлопчатника – 1,7–1,8%.
Содержание фосфолипидов в пищевых маслах относительно невелико и редко превышает 2%, наибольшее содержание можно отметить у соевого, подсолнечного масел и масла хлопчатника – 1,7–1,8%.
Будучи эссенциальными компонентами биологических мембран всех живых клеток, фосфолипиды нетоксичны и очень хорошо воспринимаются кожей.
Использование фосфолипидов в косметике
Наиболее распространенным в тканях животных и растений типом фосфолипидов является фосфатидилхолин (лецитин), который состоит из структурных остатков фосфорной кислоты, холина, жирных кислот, глицерина (рис 1). Лецитин является также основным фосфолипидом, используемым в составе косметических рецептур.
Косметический лецитин описывается как смесь фосфолипидов, которая состоит в основном из фосфатидилхолина, но также может включать в себя такие компоненты как жирные кислоты, триглицериды, стеролы, углеводороды и гликолипиды. Лецитины могут быть фракционированы по содержанию фосфатидилхолина, начиная от «сырого» лецитина, содержащего около 15% фосфатидилхолина и значительное количество растительного масла, из которого лецитин был получен, и заканчивая обезжиренным или фракционированным лецитином, с содержанием фосфатидилхолина от 25 до 96%. Источниками лецитина для промышленности могут быть соевые бобы, яйца, молоко, сырье морского происхождения, рапс, хлопчатник и подсолнечник. Жирнокислотный состав изолированных фосфолипидов типичен для каждого конкретного вида сырья и определяет температуру, при которой жирные кислоты меняют свою мобильность. Ниже точки, называемой «температурой перехода из гелевого в жидкокристаллическое состояние», жирные кислоты находятся в жесткой гелевой форме. Выше этого значения температуры они подвижны и находятся в жидкокристаллической или жидкой форме. Фосфолипиды, содержащие полиненасыщенные жирные кислоты, характеризуются очень низкой (ниже 00C) температурой перехода. Это означает, что при температуре 220C, эти липиды находятся в жидкокристаллической форме и при контакте с водой образуют очень мобильные структуры – липосомы. Фосфолипиды, содержащие ненасыщенные жирные кислоты в результате гидрирования могут быть преобразованы в фосфолипиды, содержащие насыщенные жирные кислоты. Такие гидрированные фосфолипиды при температуре кожи находятся в состоянии геля и имеют тенденцию образовывать более жесткие и стабильные мембраноподобные структуры.
Источниками лецитина для промышленности могут быть соевые бобы, яйца, молоко, сырье морского происхождения, рапс, хлопчатник и подсолнечник. Жирнокислотный состав изолированных фосфолипидов типичен для каждого конкретного вида сырья и определяет температуру, при которой жирные кислоты меняют свою мобильность. Ниже точки, называемой «температурой перехода из гелевого в жидкокристаллическое состояние», жирные кислоты находятся в жесткой гелевой форме. Выше этого значения температуры они подвижны и находятся в жидкокристаллической или жидкой форме. Фосфолипиды, содержащие полиненасыщенные жирные кислоты, характеризуются очень низкой (ниже 00C) температурой перехода. Это означает, что при температуре 220C, эти липиды находятся в жидкокристаллической форме и при контакте с водой образуют очень мобильные структуры – липосомы. Фосфолипиды, содержащие ненасыщенные жирные кислоты в результате гидрирования могут быть преобразованы в фосфолипиды, содержащие насыщенные жирные кислоты. Такие гидрированные фосфолипиды при температуре кожи находятся в состоянии геля и имеют тенденцию образовывать более жесткие и стабильные мембраноподобные структуры. В последнее время в косметике применяют, в основном, соевый лецитин или лецитин, полученный из другого растительного сырья (рапс, подсолнечник). Также существует тенденция использовать лецитин, полученный не из генно-модифициро- ванной сои.
В последнее время в косметике применяют, в основном, соевый лецитин или лецитин, полученный из другого растительного сырья (рапс, подсолнечник). Также существует тенденция использовать лецитин, полученный не из генно-модифициро- ванной сои.
Лецитин и его производные обладают следующими полезными в косметике свойствами [2]:
- эмульгирование и солюбилизация
- увлажнение
- улучшение барьерной функции, стимулирование синтеза церамидов в коже
- снижение раздражения кожи
- уменьшение размера пор
- уменьшение гиперкератоза
- стимуляция пролиферации клеток
- увеличение активного проникновения других активных ингредиентов в кожу
- кондиционирующие добавки для волос
- образование липосом и активная доставка активных веществ
- увеличение осаждения катионных красителей на волосы.
На российском рынке присутствуют как ведущие мировые поставщики лецитина, так и российские производители. Основное потребление лецитина в России – это пищевая промышленность (больше 95%). Лидерами по объемам ввозимого в Россию лецитина являются компания АDM – 46% от общего объема импорта, Cargrill (13,4%) и др.
Лидерами по объемам ввозимого в Россию лецитина являются компания АDM – 46% от общего объема импорта, Cargrill (13,4%) и др.
Важные коммерческие производные для косметики
Важными коммерческими производными лецитина, применяемыми в косметике, являются лизолецитин, гидроксилированный лецитин, лизофосфатидная кислота и гидрогенизированный лецитин [2] .
Лизолецитин, также называемый лизофосфатидилхолином, получают путем частичного гидролиза фосфатидилхолина, в результате чего удаляется один из остатков жирных кислот. Лизолецитин, как было показано, имеет хорошие эмульгирующие, увлажняющие и солюбилизирующие свойства, а также увеличивает активное проникновение веществ в кожу. Для косметики производят лизолецитин под следующими торговыми названиями: Lysofix Dry (Glycine soja (Soybean) Seed Extract) – поставщик Kemin; Lecinol WS 50 (Lysolecithin, glycerin) – поставщик Nikko Chemical; Alcolec EM и Alcolec C LPC 20 (Lysolecithin) – поставщик American Lecithin; Emultop (Lysolecithin) – поставщик Cargill.
Гидроксилированный лецитин производится путем обработки лецитина перекисью водорода и органическими кислотами, например, такими, как уксусная или молочная кислоты. Гидроксилированный лецитин значительно более гидрофильный, чем обычный лецитин, является очень стабильным и имеет отличные увлажняющие, эмульгирующие и солюбилизирующие свойства. В качестве примеров можно привести Yelkin 1018 (Lecithin) производства ADM и NET HS-70 (Hydroxylated lecithin, Glycerin) производства Nikko Chemical.
Лизофосфатидная кислота (LPA) – это фосфатированный эфир глицерина, который получают удалением холина из молекулы лецитина. LPA в косметике имеет свойство контролировать салоотделение, уменьшать поры, сокращать морщины, восстанавливать кожный барьер и усиливает проникновение активов в кожу. Nikkol Chemical предлагает лизофосфатидную кислоту для косметики под торговой маркой DisaPore 20 / BarPore 42 (Lecithin ).
Гидрированный (гидрогенизированный) лецитин получают взаимодействием водорода с лецитином.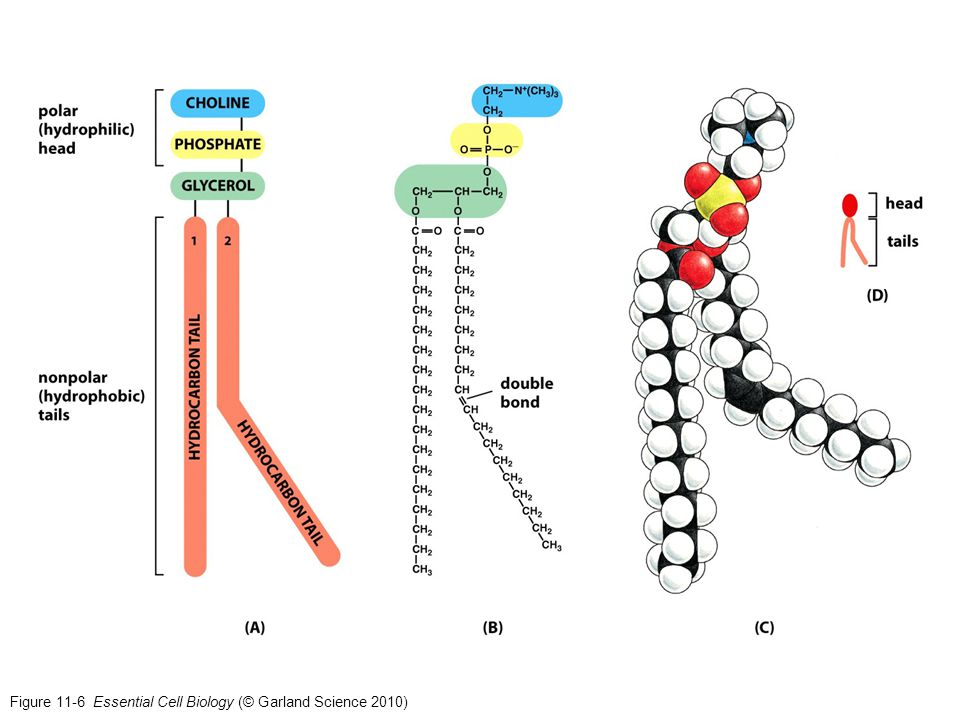 В результате образуется очень стабильный воскообразный материал. Самые полезные разновидности содержат 20–30% фосфатидилхолина и являются не раздражающими кожу эмульгаторами с отличными увлажняющими свойствами. Они способствуют доставке как маслорастворимых, так и водорастворимых активов. Гидрированный фосфатидилхолин обладает выраженной гидрофильностью. Одна молекула гидрированного фосфатидилхолина способна связать 20 молекул воды и «пронести» эту воду на себе в более глубокие слои эпидермиса, оказывая прямое увлажняющее действие. Предлагают гидрированный лецитин под следующими торговыми наименованиями: Lecinol S-10 (Hydrogenated lecithin) от Nikkol Chemical; Epikuron 100 / 200H (Hydrogenated lecithin) от Cargill; Emulmetik 300 и 320 (Hydrogenated lecithin) производства Lucas Meyer. Lipoid Cosmetics AG предлагает гидрированный фосфатидилхолин соевых бобов под торговой маркой Skin Lipid Matrix (Hidrogenated soy bean phosphatidylcholine).
В результате образуется очень стабильный воскообразный материал. Самые полезные разновидности содержат 20–30% фосфатидилхолина и являются не раздражающими кожу эмульгаторами с отличными увлажняющими свойствами. Они способствуют доставке как маслорастворимых, так и водорастворимых активов. Гидрированный фосфатидилхолин обладает выраженной гидрофильностью. Одна молекула гидрированного фосфатидилхолина способна связать 20 молекул воды и «пронести» эту воду на себе в более глубокие слои эпидермиса, оказывая прямое увлажняющее действие. Предлагают гидрированный лецитин под следующими торговыми наименованиями: Lecinol S-10 (Hydrogenated lecithin) от Nikkol Chemical; Epikuron 100 / 200H (Hydrogenated lecithin) от Cargill; Emulmetik 300 и 320 (Hydrogenated lecithin) производства Lucas Meyer. Lipoid Cosmetics AG предлагает гидрированный фосфатидилхолин соевых бобов под торговой маркой Skin Lipid Matrix (Hidrogenated soy bean phosphatidylcholine).
В России сырье для косметики с высоким содержанием фосфолипидов производит из куриного сырья компания Техкон. В качестве примера ее продукции можно привести Липокомп (INCI: Chicken oil) и Липофолк (INCI: Eggs yolk extract). Эти продукты в составе рецептур являются богатым источником ненасыщенных фосфолипидов (до 75%), борются с сухостью кожи и способствуют глубокому проникновению в кожу других биологически активных веществ.
В качестве примера ее продукции можно привести Липокомп (INCI: Chicken oil) и Липофолк (INCI: Eggs yolk extract). Эти продукты в составе рецептур являются богатым источником ненасыщенных фосфолипидов (до 75%), борются с сухостью кожи и способствуют глубокому проникновению в кожу других биологически активных веществ.
Перспективы российского рынка лецитина и производства лецитина в России
В России наметились неплохие перспективы для развития отечественного производства лецитина. Что немаловажно в случае соевых продуктов, речь идет о не содержащей ГМО продукции. Так, в 2009 году были запущены три завода, которые начали производить отечественный соевый лецитин: «Содружество Соя» (Калининград), «Амурагроцентр» (Благовещенск), «Кубаньагропрод» (станица Тбилисская, Краснодарский край). На этих заводах установлено современное оборудование зарубежного производства, позволяющее
получать лецитин, по качеству не уступающий импортному. Плановые мощности трех новых производств по выпуску лецитина довольно внушительны и составляют более 4,5 тыс. тонн в год, что сопоставимо с объемом импорта лецитина в 2008 году [3]. В 2016 году планируется запустить производство лецитина в Алтайском крае на предприятии «АгроСиб-Раздолье». Таким образом, созданы предпосылки для постепенного замещения импортного лецитина конкурентоспособным и качественным отечественным продуктом.
тонн в год, что сопоставимо с объемом импорта лецитина в 2008 году [3]. В 2016 году планируется запустить производство лецитина в Алтайском крае на предприятии «АгроСиб-Раздолье». Таким образом, созданы предпосылки для постепенного замещения импортного лецитина конкурентоспособным и качественным отечественным продуктом.
Согласно экспортным прогнозам, потенциал российского рынка лецитинов очень велик. При активном внедрении лецитина в пищевую, фармацевтическую и косметическую отрасли, а также распространении лецитина для технического применения, совокупное потребление лецитина может увеличиться в несколько раз. По экспертным оценкам потребление лецитина пищевой отраслью может вырасти в 3 раза до 15 тыс. тонн. Учитывая американский и европейский опыт технического применения лецитина, фактический потенциал для роста потребления лецитина в России значительно выше. Эксперты прогнозируют, что развитие российского рынка будет происходить вместе с его структурным изменением. С одной стороны, очевидно постепенное вытеснение импортных лецитинов отечественными аналогами. С другой стороны, можно ожидать изменения пропорций ГМО и не ГМО лецитинов на российском рынке со значительным увеличением доли не ГМО как отечественных, так и импортных лецитинов. Более того, дальнейшее развитие отечественного производства лецитина может переориентировать Россию с импорта на частичный экспорт этого продукта.
С другой стороны, можно ожидать изменения пропорций ГМО и не ГМО лецитинов на российском рынке со значительным увеличением доли не ГМО как отечественных, так и импортных лецитинов. Более того, дальнейшее развитие отечественного производства лецитина может переориентировать Россию с импорта на частичный экспорт этого продукта.
Литература
- P. van Hoogevest, D. Prusseit, R. Wajda «Phospholipids- Natural Functional Ingredients and Actives for Cosmetic Products», SOFW-Journal,139, 8–2013, p. 9–14.
- G. Deckner «Use of Phospholipids in Personal Care Products», http://www.ulprospector.com
- Ольга Кузнецова, Лецитин – король на рынке натуральных эмульгаторов http://bfi-online.ru/
Структура и функция белка переноса фосфатидилхолина (PC-TP)/StarD2
1. Малая СД. Физическая химия липидов. От алканов к фосфолипидам. Том. 4. Пленум Пресс; Нью-Йорк: 1986. [Google Scholar]
2. Уайт Д.А. В: Форма и функция фосфолипидов. Ansel GB, Hawthorne JN, Dawson RMC, редакторы. Эльзевир; Амстердам: 1973. стр. 441–482. [Google Scholar]
Эльзевир; Амстердам: 1973. стр. 441–482. [Google Scholar]
3. Шахтер Д. В кн.: Печень: биология и патобиология. 3. Ариас И.М., Бойер Дж.Л., Фаусто Н., Якоби В.Б., Шахтер Д.А., Шафриц Д.А., редакторы. Рейвен Пресс; Нью-Йорк: 1994. стр. 145–154. [Google Scholar]
4. Walkey CJ, Yu L, Agellon LB, Vance DE. Биохимическое и эволюционное значение метилирования фосфолипидов. Дж. Биол. Хим. 1998; 273:27043–27046. [PubMed] [Google Scholar]
5. Smith R, Tanford C. Критическая концентрация мицеллообразования L-α-дипальмитоилфосфатидилхолина в воде и водно-метанольных растворах. Дж Мол Биол. 1972; 67: 75–83. [PubMed] [Google Scholar]
6. Wirtz KWA, Zilversmit DB. Обмен фосфолипидов между митохондриями печени и микросомами in vitro . Дж. Биол. Хим. 1968; 243:3596–3602. [PubMed] [Google Scholar]
7. Wirtz KW, Kamp HH, van Deenen LL. Выделение белка из говяжьей печени, который специфически стимулирует обмен фосфатидилхолина. Биохим Биофиз Акта. 1972; 274: 606–617. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
8. Westerman J, Kamp HH, Wirtz KWA. Белок-переносчик фосфатидилхолина из бычьей печени. Методы Энзимол. 1983; 98: 581–586. [PubMed] [Google Scholar]
9. Wirtz KW. Белки-переносчики фосфолипидов. Анну Рев Биохим. 1991;60:73–99. [PubMed] [Google Scholar]
10. Feng L, Cohen DE. Опосредованная бакуловирусом экспрессия рекомбинантного крысиного белка-переносчика фосфатидилхолина. J липидный рез. 1998; 39: 1862–1869. [PubMed] [Google Scholar]
11. Ву М.К., Бойлан М.О., Коэн Д.Э. Клонирование и структура гена крысиного белка-переносчика фосфатидилхолина, Pctp . Ген. 1999; 235:111–120. [PubMed] [Google Scholar]
12. Kamp HH, Wirtz KWA, van Deenen LLM. Некоторые свойства фосфатидилхолинового обменного белка, очищенного из говяжьей печени. Биохим Биофиз Акта. 1973;318:313–325. [Google Scholar]
13. Kamp HH, Wirtz KWA, Baer PR, Slotboom AJ, Rosenthal AF, Paltauf F, van Deenen LLM. Специфичность белка обмена фосфатидилхолина из бычьей печени. Биохимия. 1977; 16: 1310–1316. [PubMed] [Google Scholar]
Биохимия. 1977; 16: 1310–1316. [PubMed] [Google Scholar]
14. Geijtenbeek TB, Westerman J, Heerma W, Wirtz KW. Белок-переносчик фосфатидилхолина из бычьей печени содержит сильно ненасыщенные виды фосфатидилхолина. ФЭБС лат. 1996; 391:333–335. [PubMed] [Академия Google]
15. де Брауэр А.П., Верслуис С., Вестерман Дж., Рулофсен Б., Хек А.Дж., Виртц К.В. Определение стабильности белково-липидного комплекса переноса нековалентных фосфолипидов методом времяпролетной масс-спектрометрии с электрораспылением. Биохимия. 2002;41:8013–8018. [PubMed] [Google Scholar]
16. ван ден Бесселаар AMHP, Helmkamp GM, Wirtz KWA. Кинетическая модель белково-опосредованного обмена фосфатидилхолина между однослойными липосомами. Биохимия. 1975; 14: 1852–1858. [PubMed] [Академия Google]
17. Runquist EA, Helmkamp GM., Jr Влияние акцепторной мембраны фосфатидилхолина на каталитическую активность белка-переносчика фосфатидилхолина бычьей печени. Биохим Биофиз Акта. 1988; 940: 21–32. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
18. Мачида К., Ониши С.И. Исследование белка обмена фосфатидилхолина с помощью спиновой метки. Регуляция активности фосфатидилсерином и ионом кальция. Биохим Биофиз Акта. 1978; 507: 156–164. [PubMed] [Google Scholar]
19. DiCorleto PE, Zilversmit DB. Катализируемый белком обмен фосфатидилхолина между липосомами, обработанными ультразвуком, и мультиламеллярными везикулами. Биохимия. 1977;16:2145–2150. [PubMed] [Google Scholar]
20. Wirtz KW, Vriend G, Westerman J. Кинетический анализ взаимодействия белка обмена фосфатидилхолина с однослойными везицеллами и мультиламеллярными липосомами. Евр Дж Биохим. 1979; 94: 215–221. [PubMed] [Google Scholar]
21. Akeroyd R, Moonen P, Westerman J, Puyk WC, Wirtz KWA. Полная первичная структура белка-переносчика фосфатидилхолина из бычьей печени. Евр Дж Биохим. 1981; 114: 385–391. [PubMed] [Академия Google]
22. Акеройд Р., Ленстра А., Вестерман Дж., Вринд Г., Виртц КВА, ван Динен, магистр права. Прогнозирование вторичных структурных элементов в белке-переносчике фосфатидилхолина из бычьей печени. Евр Дж Биохим. 1982; 121: 391–394. [PubMed] [Google Scholar]
Прогнозирование вторичных структурных элементов в белке-переносчике фосфатидилхолина из бычьей печени. Евр Дж Биохим. 1982; 121: 391–394. [PubMed] [Google Scholar]
23. Devaux PF, Moonen P, Bienvenue A, Wirtz KW. Липид-белковое взаимодействие в белке обмена фосфатидилхолина. Proc Natl Acad Sci USA. 1977; 74: 1807–1810. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Westerman J, Wirtz KW, Berkhout T, van Deenen LL, Radhakrishnan R, Khorana HG. Идентификация сайта связывания липидов белка-переносчика фосфатидилхолина с аналогами фосфатидилхолина, содержащими фотоактивируемые предшественники карбенов. Евр Дж Биохим. 1983;132:441–449. [PubMed] [Google Scholar]
25. Berkhout TA, Visser AJWG, Wirtz KWA. Статические и временные флуоресцентные исследования флуоресцентного фосфатидилхолина, связанного с белком-переносчиком фосфатидилхолина бычьей печени. Биохимия. 1984; 23: 1505–1513. [PubMed] [Google Scholar]
26. Родерик С.Л., Чан В.В., Агат Д.С., Олсен Л. Р., Веттинг М.В., Раджашанкар К.Р., Коэн Д.Э. Структура белка-переносчика фосфатидилхолина человека в комплексе с его лигандом. Природа Структура Биол. 2002;9: 507–511. [PubMed] [Google Scholar]
Р., Веттинг М.В., Раджашанкар К.Р., Коэн Д.Э. Структура белка-переносчика фосфатидилхолина человека в комплексе с его лигандом. Природа Структура Биол. 2002;9: 507–511. [PubMed] [Google Scholar]
27. Фэн Л., Чан В.В., Родерик С.Л., Коэн Д.Э. Экспрессия высокого уровня и мутагенез рекомбинантного белка-переносчика фосфатидилхолина человека с использованием синтетического гена: свидетельство С-концевого мембраносвязывающего домена. Биохимия. 2000;39:15399–15409. [PubMed] [Google Scholar]
28. Ponting CP, Aravind L. START: липид-связывающий домен в StAR, HD-ZIP и сигнальных белках. Тенденции биохимических наук. 1999; 24:130–132. [PubMed] [Академия Google]
29. Айер Л.М., Кунин Е.В., Аравинд Л. Адаптация складки спираль-захват для связывания лиганда и катализа в суперсемействе доменов START. Белки. 2001; 43: 134–144. [PubMed] [Google Scholar]
30. Шрик К., Нгуен Д., Карловски В.М., Майер К.Ф. Липид-стерол-связывающие домены START амплифицируются в растениях и преимущественно связаны с гомеодоменовыми транскрипционными факторами.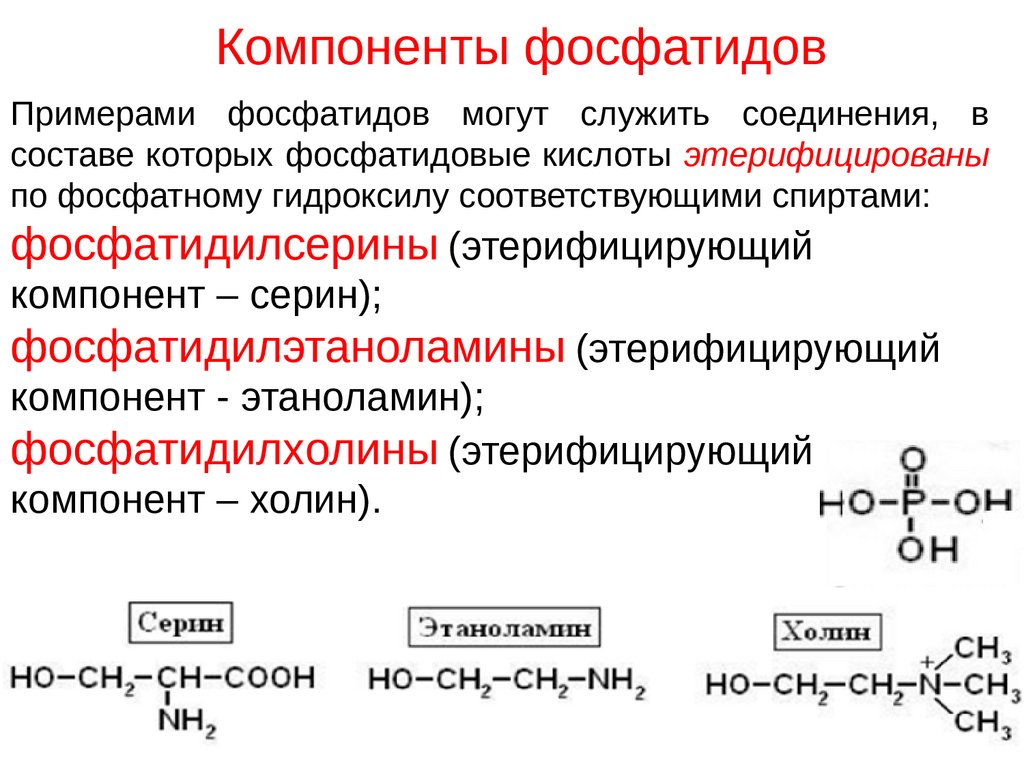 Геном биол. 2004;5:R41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Геном биол. 2004;5:R41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Soccio RE, Breslow JL. StAR-родственные белки переноса липидов (START): медиаторы внутриклеточного метаболизма липидов. Дж. Биол. Хим. 2003; 278:22183–22186. [PubMed] [Академия Google]
32. Alpy F, Tomasetto C. Дайте липидам START: связанный со StAR домен переноса липидов (START) у млекопитающих. Дж. Клеточные науки. 2005; 118: 2791–2801. [PubMed] [Google Scholar]
33. Soccio RE, Adams RM, Romanowski MJ, Sehayek E, Burley SK, Breslow JL. Холестерин-регулируемый ген StarD4 кодирует родственный StAR белок-переносчик липидов с двумя близкородственными гомологами, StarD5 и StarD6. Proc Natl Acad Sci USA. 2002; 99: 6943–6948. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Tsujishita Y, Hurley JH. Структура и механизм транспорта липидов домена, связанного с StAR. Nat Struct Biol. 2000; 7: 408–414. [PubMed] [Академия Google]
35. Романовский MJ, Soccio RE, Breslow JL, Burley SK.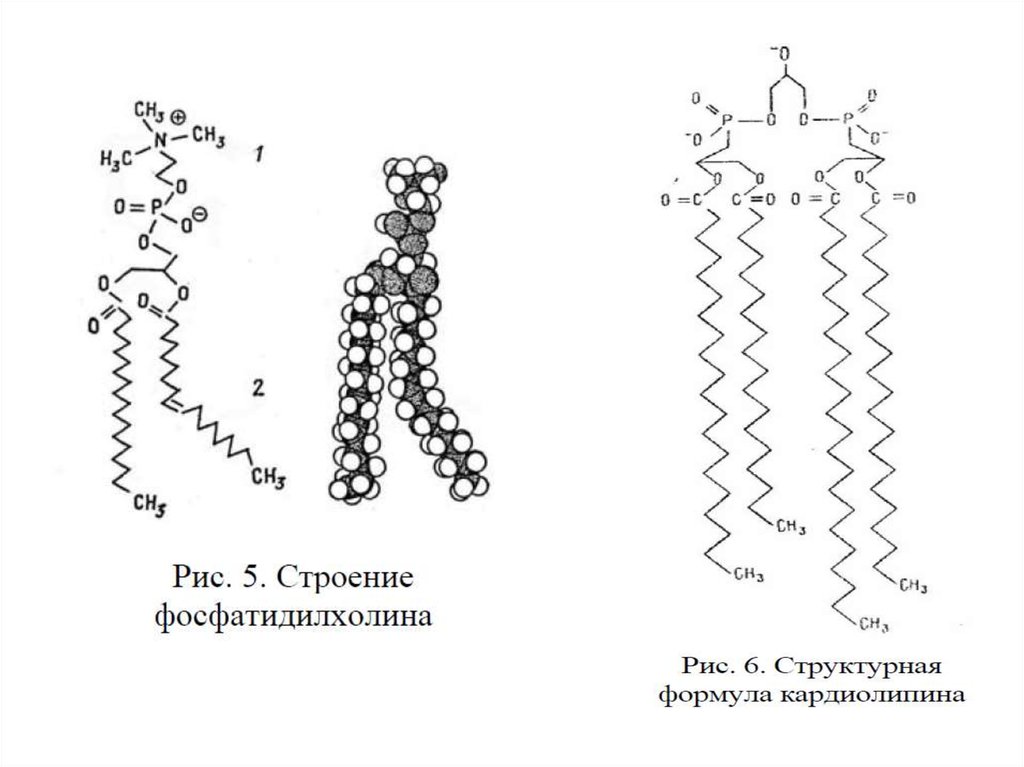 Кристаллическая структура белка 4 START (StarD4), регулируемого холестерином Mus musculus, содержащего домен переноса липидов, родственный StAR. Proc Natl Acad Sci USA. 2002; 99: 6949–54. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Кристаллическая структура белка 4 START (StarD4), регулируемого холестерином Mus musculus, содержащего домен переноса липидов, родственный StAR. Proc Natl Acad Sci USA. 2002; 99: 6949–54. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Bernlohr DA, Simpson MA, Hertzel AV, Banaszak LJ. Внутриклеточные липидсвязывающие белки и их гены. Анну Рев Нутр. 1997; 17: 277–303. [PubMed] [Google Scholar]
37. Choinowski T, Hauser H, Piontek K. Структура белка-носителя стеролов 2 при разрешении 1,8 A показывает гидрофобный туннель, подходящий для связывания липидов. Биохимия. 2000;39: 1897–902. [PubMed] [Google Scholar]
38. Yoder MD, Thomas LM, Tremblay JM, Oliver RL, Yarbrough LR, Helmkamp GM., Jr Структура многофункционального белка. Белок-переносчик фосфатидилинозитола млекопитающих в комплексе с фосфатидилхолином. Дж. Биол. Хим. 2001; 276:9246–9252. [PubMed] [Google Scholar]
39. Cohen DE, Green RM, Wu MK, Beier DR. Клонирование, тканеспецифическая экспрессия, структура гена и хромосомная локализация белка-переносчика фосфатидилхолина человека. Биохим Биофиз Акта. 1999;1447:265–270. [PubMed] [Google Scholar]
Биохим Биофиз Акта. 1999;1447:265–270. [PubMed] [Google Scholar]
40. ван Хелвоорт А., де Брауэр А., Оттенхофф Р., Брауэрс Дж. Ф., Вейнхолдс Дж., Бейнен Дж. Х., Рейневельд А., ван дер Полл Т., ван дер Валк М. А., Майор Д., Вурхаут В., Wirtz KW, Elferink RP, Borst P. Мыши без белка-переносчика фосфатидилхолина не имеют дефектов секреции фосфатидилхолина в желчь или в легкие. Proc Natl Acad Sci USA. 1999;96:11501–11506. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Cohen DE, Green RM. Клонирование и характеристика кДНК, кодирующей специфический белок-переносчик фосфатидилхолина из бычьей печени. Ген. 1995;163:327–328. [PubMed] [Google Scholar]
42. Geijtenbeek TBH, Smith AJ, Borst P, Wirtz KWA. Клонирование кДНК и тканеспецифичная экспрессия гена белка-переносчика фосфатидилхолина. Биохим Дж. 1996; 316:49–55. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Teerlink T, van der Krift TP, Post M, Wirtz KWA. Распределение в тканях и субклеточная локализация белка-переносчика фосфатидилхолина у крыс по данным радиоиммуноанализа. Биохим Биофиз Акта. 1982; 713: 61–67. [PubMed] [Академия Google]
Биохим Биофиз Акта. 1982; 713: 61–67. [PubMed] [Академия Google]
44. Ву М.К., Хёго Х., Ядав С., Новикофф П.М., Коэн Д.Э. Нарушенная реакция секреции липидов желчи на литогенную диету у мышей с дефицитом белка, переносящего фосфатидилхолин. J липидный рез. 2005; 46: 422–431. [PubMed] [Google Scholar]
45. Мандард С., Мюллер М., Керстен С. Гены-мишени альфа-рецептора, активируемого пролифератором пероксисом. Cell Mol Life Sci. 2004; 61: 393–416. [PubMed] [Google Scholar]
46. Чу Р., Лим Х., Брамфилд Л., Лю Х., Херринг С., Улинц П., Редди Дж. К., Дэвисон М. Белковый профиль печени мышей с альфа-активацией рецептора, активируемого пролифератором пероксисом. Мол Селл Биол. 2004; 24:6288–97. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Kanno K, Scapa EF, Wang WJ, Orasanu G, Plutzky J, Cohen DE. Белок, переносящий фосфатидилхолин (PC-TP), регулируется рецептором, активируемым пролифератором пероксисом а (PPARa), и участвует в опосредованном PPARa метаболизме триглицеридов в печени (аннотация) Гастроэнтерология. 2006; 130:А-65. [Google Scholar]
2006; 130:А-65. [Google Scholar]
48. de Brouwer AP. Кандидатская диссертация. Утрехтский университет; Утрехт, Нидерланды: 2002. Функциональные исследования белка-переносчика фосфатидилхолина; п. 176. [Google Академия]
49. Ю С., Мацусуэ К., Каширедди П., Цао В.К., Йелданди В., Йелданди А.В., Рао М.С., Гонсалес Ф.Дж., Редди Дж.К. Адипоцит-специфическая экспрессия генов и адипогенный стеатоз в печени мышей из-за сверхэкспрессии рецептора гамма-1, активируемого пролифератором пероксисом (PPARgamma1). Дж. Биол. Хим. 2003; 278: 498–505. [PubMed] [Google Scholar]
50. де Брауэр А.П., Вестерман Дж., Кляйнниенхуис А., Беверс Л.Е., Рулофсен Б., Виртц К.В. Клофибрат-индуцированное перемещение белка переноса фосфатидилхолина в митохондрии в эндотелиальных клетках. Разрешение ячейки опыта. 2002; 274:100–11. [PubMed] [Академия Google]
51. Хэй Д.У., Кэри М.К. Химические виды липидов в желчи. Гепатология. 1990;12:6С–16С. [PubMed] [Google Scholar]
52. LaMorte WW, Booker ML, Kay S. Детерминанты выбора молекулярных видов фосфатидилхолина для секреции в желчь у крыс. Гепатология. 1998; 28: 631–637. [PubMed] [Google Scholar]
Детерминанты выбора молекулярных видов фосфатидилхолина для секреции в желчь у крыс. Гепатология. 1998; 28: 631–637. [PubMed] [Google Scholar]
53. Cohen DE, Leonard MR, Carey MC. Доказательства in vitro, что секреция фосфолипидов в желчь может координироваться внутриклеточно за счет комбинированного действия солей желчных кислот и специфического белка-переносчика фосфатидилхолина печени. Биохимия. 1994;33:9975–9980. [PubMed] [Google Scholar]
54. Смит Дж. Дж. М., Шинкель А. Х., Ауде Эльферинк РП.Дж., Гроен А. К., Вагенаар Э., ван Деемтер Л., Мол CAAM, Оттенхофф Р., ван дер Лугт НМТ, ван Роон М. А., ван дер Валк М. А. , Offerhaus GJA, Berns AJM, Borst P. Гомозиготное нарушение мышиного mdr2 гена P-гликопротеина приводит к полному отсутствию фосфолипидов в желчи и к заболеванию печени. Клетка. 1993; 75: 451–462. [PubMed] [Google Scholar]
55. Shoda J, Oda K, Suzuki H, Sugiyama Y, Ito K, Cohen DE, Feng L, Kamiya J, Nimura Y, Miyazaki H, Kano M, Matsuzaki Y, Tanaka N. Этиологическое значение нарушений обмена холестерина, фосфолипидов и желчных кислот в печени больных с внутрипеченочными конкрементами. Гепатология. 2001;33:1194–1205. [PubMed] [Google Scholar]
Этиологическое значение нарушений обмена холестерина, фосфолипидов и желчных кислот в печени больных с внутрипеченочными конкрементами. Гепатология. 2001;33:1194–1205. [PubMed] [Google Scholar]
56. Wirtz KW. Белки-переносчики фосфолипидов в перспективе. ФЭБС лат. 2006 г. в печати. [PubMed] [Google Scholar]
57. Batenburg JJ, Ossendorp BC, Snoek GT, Wirtz KW, Houweling M, Elfring RH. Белки, переносящие фосфолипиды, и их мРНК в развивающихся легких крыс и в альвеолярных клетках типа II. Биохим Дж. 1994; 298:223–229. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Baez JM, Barbour SE, Cohen DE. Белок-переносчик фосфатидилхолина способствует опосредованному аполипопротеином A-I оттоку липидов в клетках яичников китайского хомячка. Дж. Биол. Хим. 2002;277:6198–6206. [PubMed] [Google Scholar]
59. Филдинг CJ, Филдинг PE. Молекулярная физиология обратного транспорта холестерина. J липидный рез. 1995; 36: 211–228. [PubMed] [Google Scholar]
60. Oram JF, Yokoyama S. Опосредованное аполипопротеинами удаление клеточного холестерина и фосфолипидов. J липидный рез. 1996; 37: 2473–2491. [PubMed] [Google Scholar]
Опосредованное аполипопротеинами удаление клеточного холестерина и фосфолипидов. J липидный рез. 1996; 37: 2473–2491. [PubMed] [Google Scholar]
61. Barrans A, Jaspard B, Barbaras R, Chap H, Perret B, Collet X. Pre-beta HDL: структура и метаболизм. Биохим Биофиз Акта. 1996;1300:73–85. [PubMed] [Google Scholar]
62. Yokoyama S. Опосредованный аполипопротеинами отток клеточного холестерина. Биохим Биофиз Акта. 1998; 1392:1–15. [PubMed] [Google Scholar]
63. фон Эккардштейн А., Нофер Дж. Р., Ассманн Г. Липопротеины высокой плотности и атеросклероз. Роль оттока холестерина и обратного транспорта холестерина. Артериосклеры Тромб Васк Биол. 2001; 21:13–27. [PubMed] [Google Scholar]
64. Орам Дж. Ф. Болезнь Танжера и ABCA1. Биохим Биофиз Акта. 2000;1529: 321–330. [PubMed] [Google Scholar]
65. Schmitz G, Langmann T. Структура, функция и регуляция продукта гена ABC1. Карр Опин Липидол. 2001; 12: 129–140. [PubMed] [Google Scholar]
66. Белицкий Дж. К., Джонсон В. Дж., Вайнберг Р. Б., Глик Дж. М., Ротблат Г. Х. Отток липидов из фибробластов в аполипопротеины: зависимость от повышенного уровня клеточного неэтерифицированного холестерина. J липидный рез. 1992; 33: 1699–1709. [PubMed] [Google Scholar]
К., Джонсон В. Дж., Вайнберг Р. Б., Глик Дж. М., Ротблат Г. Х. Отток липидов из фибробластов в аполипопротеины: зависимость от повышенного уровня клеточного неэтерифицированного холестерина. J липидный рез. 1992; 33: 1699–1709. [PubMed] [Google Scholar]
67. Gillotte KL, Davidson WS, Lund-Katz S, Rothblat GH, Phillips MC. Удаление клеточного холестерина с помощью пре-β-ЛПВП включает микросолюбилизацию плазматической мембраны. J липидный рез. 1998;39:1918–1928. [PubMed] [Google Scholar]
68. Zhang W, Asztalos B, Roheim PS, Wong L. Характеристика фосфолипидов в пре-альфа-ЛПВП: селективный отток фосфолипидов с аполипопротеином A-I. J липидный рез. 1998; 39: 1601–1607. [PubMed] [Google Scholar]
69. Forte TM, Bielicki JK, Goth-Goldstein R, Selmek J, McCall MR. Рекрутирование клеточных фосфолипидов и холестерина аполипопротеинами A-II и A-I: образование зарождающихся аполипопротеин-специфических ЛПВП, различающихся по размеру, составу фосфолипидов и реактивности с ЛХАТ. J липидный рез. 1995;36:148–157. [PubMed] [Google Scholar]
J липидный рез. 1995;36:148–157. [PubMed] [Google Scholar]
70. Филдинг П.Е., Нагао К., Хакамата Х., Чимини Г., Филдинг С.Дж. Двухэтапный механизм оттока свободного холестерина и фосфолипидов из сосудистых клеток человека в аполипопротеин А-1. Биохимия. 2000;39:14113–14120. [PubMed] [Google Scholar]
71. Kiss RS, McManus DC, Franklin V, Tan WL, McKenzie A, Chimini G, Marcel YL. Липидизация гепатоцитами человеческого аполипопротеина А-I происходит как по ABCA1-зависимому, так и по независимому пути. Дж. Биол. Хим. 2003;278:10119–10127. [PubMed] [Google Scholar]
72. Робинс С.Дж., Фасуло Дж.М., Паттон Г.М. Влияние соли желчных кислот на состав фосфатидилхолина и секрецию печеночных липопротеидов высокой плотности. Am J Physiol. 1990; 259:G205–G211. [PubMed] [Google Scholar]
73. Baez JM, Tabas I, Cohen DE. Снижение оттока липидов и повышенная восприимчивость к холестерин-индуцированному апоптозу в макрофагах, лишенных белка-переносчика фосфатидилхолина. Биохим Дж. 2005; 388:57–63. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2005; 388:57–63. [Бесплатная статья PMC] [PubMed] [Google Scholar]
74. Табас И. Холестериновый и фосфолипидный обмен в макрофагах. Биохим Биофиз Акта. 2000; 1529: 164–174. [PubMed] [Google Scholar]
75. Wu MK, Cohen DE. Белок-переносчик фосфатидилхолина регулирует размер и поглощение печенью липопротеинов высокой плотности. Am J Physiol. 2005; 289:G1067–G1074. [PubMed] [Google Scholar]
76. Wu MK, Cohen DE. Измененный метаболизм холестерина в печени компенсирует нарушение белка-переносчика фосфатидилхолина у мышей. Am J Physiol. 2005;289:G456–G461. [PubMed] [Google Scholar]
77. Табас И. Апоптоз и дестабилизация бляшек при атеросклерозе: роль апоптоза макрофагов, индуцированного холестерином. Смерть клеток 2004; 11 (Приложение 1): S12–6. [PubMed] [Google Scholar]
78. Wang WJ, Baez JM, Maurer R, Dansky HM, Cohen DE. Гомозиготное нарушение Pctp модулирует атеросклероз у мышей с дефицитом аполипопротеина Е. J липидный рез. 2006;47:2400–2407. [PubMed] [Google Scholar]
79. Бреслоу Дж.Л. Мышиные модели атеросклероза. Наука. 1996;272:685–688. [PubMed] [Google Scholar]
Бреслоу Дж.Л. Мышиные модели атеросклероза. Наука. 1996;272:685–688. [PubMed] [Google Scholar]
80. Scapa EF, Kanno K, Wang W, Cohen DE. Ключевая регулирующая роль белка, переносящего фосфатидилхолин (PC-TP), в метаболизме триглицеридов в печени: значение для патогенеза неалкогольной жировой болезни печени (аннотация) Гепатология. 2005; 42:508А–509А. [Google Scholar]
81. Scapa EF, Kanno K, Wang WJ, Cohen DE. Регуляция потоков и синтеза жирных кислот в печени белком-переносчиком фосфатидилхолина (PC-TP) (аннотация) Гастроэнтерология. 2006; 130:А-86. [Академия Google]
82. Pan HJ, Agate DS, King BL, Wu MK, Roderick SL, Leiter EH, Cohen DE. Полиморфизм новозеландских инбредных линий мышей, который инактивирует белок-переносчик фосфатидилхолина. ФЭБС лат. 2006; 580: 5953–5958. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Анализ фосфатидилхолина — анализ липидов
Основные (1)
Основные файлы cookie обеспечивают выполнение основных функций и необходимы для правильной работы веб-сайта.
Показать информацию о файлах cookie
Скрыть информацию о файлах cookie
| Имя | Печенье Борлабс |
|---|---|
| Провайдер | Владелец этого веб-сайта, Выходные данные |
| Назначение | Сохраняет настройки посетителей, выбранные в окне файлов cookie Borlabs Cookie. |
| Имя файла cookie | borlabs-печенье |
| Срок действия файлов cookie | 1 год |
Статистика (2)
Статистика
Статистические файлы cookie собирают информацию анонимно. Эта информация помогает нам понять, как наши посетители используют наш веб-сайт.
Показать информацию о файлах cookie
Скрыть информацию о файлах cookie
| Принять | Гугл Аналитика |
|---|---|
| Имя | Гугл Аналитика |
| Провайдер | Google Ireland Limited, Gordon House, Barrow Street, Dublin 4, Ирландия |
| Назначение | Файл cookie Google, используемый для аналитики веб-сайта. Генерирует статистические данные о том, как посетитель использует веб-сайт. Генерирует статистические данные о том, как посетитель использует веб-сайт. |
| Политика конфиденциальности | https://policies.google.com/privacy?hl=en |
| Имя файла cookie | _ga,_gat,_gid |
| Срок действия файла cookie | 2 года |
| Принять | Google Аналитика 4 |
|---|---|
| Имя | Google Аналитика 4 |
| Провайдер | Google Ireland Limited, Gordon House, Barrow Street, Dublin 4, Ирландия |
| Назначение | Файл cookie Google, используемый для аналитики веб-сайта. Генерирует статистические данные о том, как посетитель использует веб-сайт. Генерирует статистические данные о том, как посетитель использует веб-сайт. |
| Политика конфиденциальности | https://policies.google.com/privacy?hl=en |
| Имя файла cookie | _ga,_gat,_gid |
| Срок действия файла cookie | 2 года |
Маркетинг (5)
Маркетинг
Маркетинговые файлы cookie используются сторонними рекламодателями или издателями для отображения персонализированной рекламы. Они делают это, отслеживая посетителей на веб-сайтах.
Они делают это, отслеживая посетителей на веб-сайтах.
Показать информацию о файлах cookie
Скрыть информацию о файлах cookie
| Принять | |
|---|---|
| Имя | |
| Провайдер | Гугл |
| Назначение | Код Google для отслеживания конверсий в магазине. |
| Срок действия файла cookie | 2 года |
| Принять | Диспетчер тегов Google |
|---|---|
| Имя | Диспетчер тегов Google |
| Провайдер | Google Ireland Limited, Gordon House, Barrow Street, Dublin 4, Ирландия |
| Назначение | Файл cookie Google используется для управления расширенными сценариями и обработкой событий. |
| Политика конфиденциальности | https://policies.google.com/privacy?hl=en |
| Имя файла cookie | _ga,_gat,_gid |
| Срок действия файлов cookie | 2 года |
| Принять | Пиксель Facebook |
|---|---|
| Имя | Пиксель Facebook |
| Провайдер | Meta Platforms Ireland Limited, 4 Grand Canal Square, Dublin 2, Ирландия |
| Назначение | Файл cookie Facebook, используемый для аналитики веб-сайта, таргетинга рекламы и измерения рекламы. |
| Политика конфиденциальности | https://www.facebook.com/policies/cookies |
| Имя файла cookie | _fbp,act,c_user,datr,fr,m_pixel_ration,pl,presence,sb,spin,wd,xs |
| Срок действия файла cookie | Сессия / 1 год |
| Принять | Тег статистики LinkedIn |
|---|---|
| Имя | Тег статистики LinkedIn |
| Провайдер | |
| Назначение | Тег LinkedIn Insight Tag – это фрагмент легкого кода JavaScript, который вы можете добавить на свой веб-сайт, чтобы включить подробные отчеты о кампаниях и получить ценную информацию о посетителях вашего веб-сайта. Как клиент LinkedIn Marketing Solutions, вы можете использовать LinkedIn Insight Tag для отслеживания конверсий, перенацеливания посетителей веб-сайта и получения дополнительной информации об участниках, взаимодействующих с вашими объявлениями. Как клиент LinkedIn Marketing Solutions, вы можете использовать LinkedIn Insight Tag для отслеживания конверсий, перенацеливания посетителей веб-сайта и получения дополнительной информации об участниках, взаимодействующих с вашими объявлениями. |
| Политика конфиденциальности | https://www.linkedin.com/help/lms/answer/81849/linkedin-insight-tag-haufig-gestellte-fragen?lang=en |
| Имя файла cookie | тег LinkedInInsight |
| Принять | Твиттер пиксель |
|---|---|
| Имя | Твиттер пиксель |
| Провайдер | Твиттер |
| Назначение | На нашем веб-сайте мы используем услуги Twitter Inc. , 1355 Market Street, Suite 900, San Francisco, CA 94103, USA. («Твиттер»). Эти службы используют файлы cookie и код для подключения веб-сайта к другой сторонней платформе, такой как Twitter. Кроме того, так называемый «твиттер-пиксель» можно использовать для отслеживания действий пользователей после того, как они увидели или нажали на рекламу в Твиттере. Целью сбора данных является запись поведения пользователя (например, посещенные веб-сайты, извлеченный контент, время посещения, данные, связанные с устройством, такие как приложения и операционные системы). IP-адрес пользователя сохраняется и используется для географического таргетинга рекламы. Твиттер также пытается отслеживать поведение пользователя на всех его устройствах. Twitter объединяет и связывает эти данные с соответствующим профилем пользователя на twitter.com. , 1355 Market Street, Suite 900, San Francisco, CA 94103, USA. («Твиттер»). Эти службы используют файлы cookie и код для подключения веб-сайта к другой сторонней платформе, такой как Twitter. Кроме того, так называемый «твиттер-пиксель» можно использовать для отслеживания действий пользователей после того, как они увидели или нажали на рекламу в Твиттере. Целью сбора данных является запись поведения пользователя (например, посещенные веб-сайты, извлеченный контент, время посещения, данные, связанные с устройством, такие как приложения и операционные системы). IP-адрес пользователя сохраняется и используется для географического таргетинга рекламы. Твиттер также пытается отслеживать поведение пользователя на всех его устройствах. Twitter объединяет и связывает эти данные с соответствующим профилем пользователя на twitter.com. |
| Политика конфиденциальности | https://legal. |
