Экстубация что это: Недопустимое название — Викисловарь
Экстубация трахеи: Протокол Ассоциации трудные дыхательные пути (2012 г.). Часть I
Экстубация трахеи является ключевым этапом восстановления после общей анестезии. Это не просто процесс противоположный интубации трахеи, поскольку экстубация обычно несет больше осложнений, чем манипуляции на дыхательных путях в начале наркоза. При экстубации имеет место переход от контролируемой ситуации к неконтролируемой. Анатомические и физиологические изменения в комбинации с лимитом времени и другими стесняющими факторами способствует ситуации, которая может представлять большую сложность для анестезиолога, чем интубация трахеи.
Большая часть осложнений, возникающих после экстубации, незначительны. Но в некоторых случаях они ведут к серьезным последствиям, включая гипоксическое поражение головного мозга и летальный исход (1–6).
Данные Великобритании позволяет считать, что респираторные осложнения встречаются при экстубации и на протяжении периода восстановления (7, 8). В четвертом Национальном аудиторском проекте (NAP4, от англ. National Audit Project) Королевского колледжа анестезиологов и Ассоциации трудные дыхательные пути на тяжелые осложнения со стороны дыхательных путей, развивающиеся на этапе прекращения наркоза и восстановления, приходится примерно треть сообщений, связанных с анестезией (9).
National Audit Project) Королевского колледжа анестезиологов и Ассоциации трудные дыхательные пути на тяжелые осложнения со стороны дыхательных путей, развивающиеся на этапе прекращения наркоза и восстановления, приходится примерно треть сообщений, связанных с анестезией (9).
В данных из США об исках также имеются факты летальных исходов и осложнений при экстубации трахеи (10). Публикация рекомендаций Американского общества анестезиологов (АОА) по трудным дыхательным путям привела к уменьшению количества исков, связанных с дыхательными путями вследствие осложнений на этапе введения в наркоз. Но количество исков, обусловленных осложнениями во время операции, на этапе экстубации и восстановления, осталось на прежнем уровне. Летальность и поражение головного мозга часто встречаются в исках, связанными с экстубацией и восстановлением, в сопоставлении с теми, которые привязаны к этапу индукции в наркоз. Проблемы при экстубации чаще встречаются у пациентов с ожирением и обструктивным апноэ во время сна.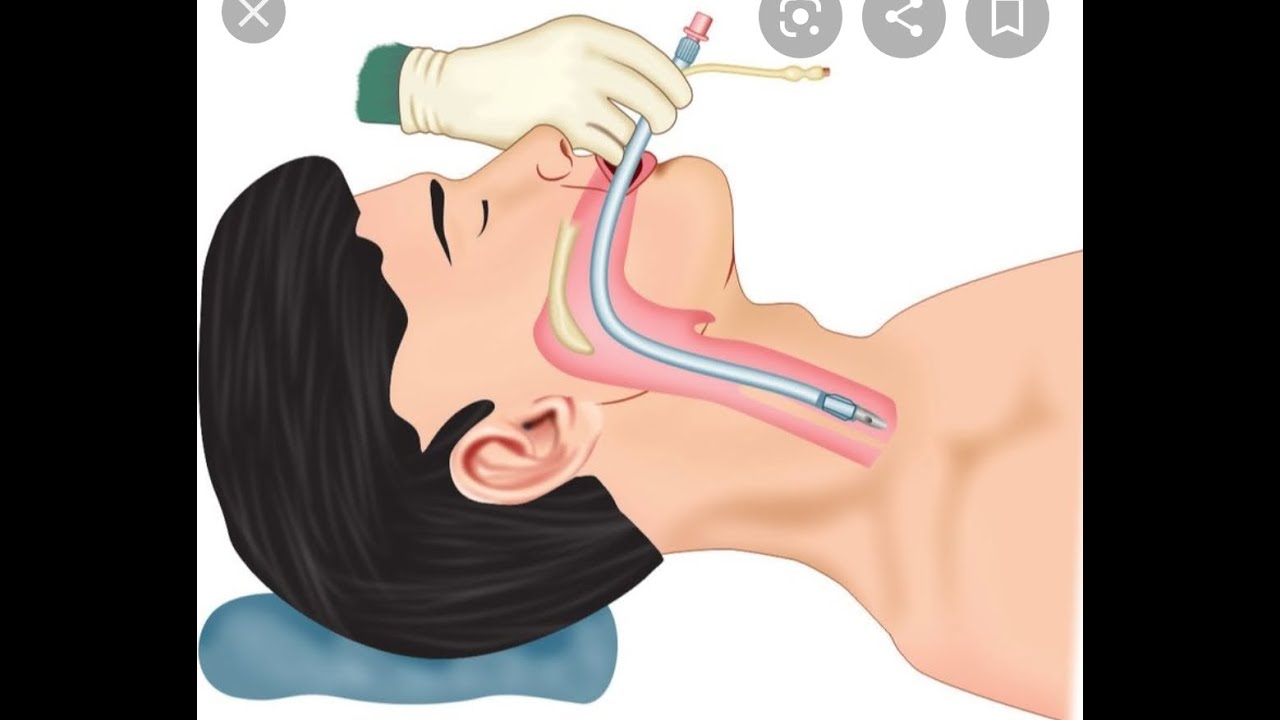
Несмотря на данные о большом риске осложнений, экстубация трахеи и восстановление после наркоза привлекают меньше внимания, чем индукция в наркоз и интубация. Разработано множество интернациональных руководство по сложной интубации трахеи, но только в некоторых из них в деталях обсуждается экстубация (11–16). В Великобритании в учебной программе Королевского колледжа анестезиологов экстубации уделяется мало внимания (17). Рекомендации по трудным дыхательным путям Ассоциации трудные дыхательные пути получили широкое распространение среди анестезиологов Великобритании с момента их публикации в 2004 г. В них упоминается экстубация, но в детальности характеристика не дается (18). По этим причинам Ассоциация трудные дыхательные пути пришла к заключению подготовить рекомендации по экстубации трахеи у взрослых в периоперативном периоде.
Кратко – в рекомендациях не преследуется цель ни приуменьшить их значение, ни заменить ими взвешенный клинический подход.
Проблемы при экстубации: почему экстубация представляет опасность?
Целью интубации трахеи является обеспечение проходимости дыхательных путей, изоляции дыхательных путей, искусственной вентиляции легких (ИВЛ) и улучшения условий для работы хирурга. В большинстве случаев извлечение эндотрахеальной трубки (экстубация) является неизбежным процессом. Но у небольшого количества пациентов анатомические и/или физиологические осложнения могут вести к летальному исходу и осложнениям. Данные проблемы чаще всего развиваются у пациентов, распределяемых в группу риска. Проблемы, связанные с экстабцией, не являются чисто техническими и могут быть связаны с человеческим фактором (2–4, 21).
В большинстве случаев извлечение эндотрахеальной трубки (экстубация) является неизбежным процессом. Но у небольшого количества пациентов анатомические и/или физиологические осложнения могут вести к летальному исходу и осложнениям. Данные проблемы чаще всего развиваются у пациентов, распределяемых в группу риска. Проблемы, связанные с экстабцией, не являются чисто техническими и могут быть связаны с человеческим фактором (2–4, 21).
Проблемы, связанные с рефлексами со стороны дыхательных путей
Восстановление рефлексов со стороны дыхательных путей зависит от многих факторов, возможно замедленное их восстановление на протяжении нескольких часов после извлечения эндотрахеальной трубки. В практической деятельности проблемы могут быть связаны с усилением, ослаблением и нарушением рефлексов (22).
Усиление рефлексов гортани
Задержка дыхания, кашель, двигательное возбуждение (форсированный кашель, напоминающий прием Вальсальвы) являются физиологической ответной реакцией на раздражение дыхательных путей и сопровождаются увеличением артериального давления, венозного давления, частоты сердечных сокращений.
Ларингоспазм является защитным усиленным нормальным рефлексом смыкания голосовых связок, обусловленный раздражением верхнего гортанного нерва (23–27). Ларингоспазм часто запускается скоплением крови, секрета или тканей после хирургической обработки, особенно на фоне поверхностного наркоза. В качестве этиологических факторов ларингоспазма упоминаются раздражение носовой полости, слизистой щек, глотки, гортани, стимуляция или манипуляции на верхнем этаже брюшной полости. Клинические исследования предполагают, что внутривенная анестезия на основе пропофола ведет к уменьшению частоты осложнений, связанных с усилением рефлексов дыхательных путей. В поддержку этого есть ряд научных данных (28–31). Обычно ларингоспазм приводит к клинике нарушения проходимости верхних дыхательных путей (включая стридор), вслед за этим может развиваться полное нарушение проходимости дыхательных путей, что требует немедленных действий (см. приложение). Некупированный ларингоспазм может вести к постобструктивному отеку легких (также известен как отек легких на фоне отрицательного давления на вдохе) и гипоксической остановке сердечной деятельности (см. приложение). Подобной ответной реакцией со стороны нижних дыхательных путей является бронхоспазм.
приложение). Подобной ответной реакцией со стороны нижних дыхательных путей является бронхоспазм.
Ослабление рефлексов дыхательных путей
Рефлексы с верхних дыхательных путей поддерживают тонус и проходимость верхних дыхательных путей; рефлексы гортани обеспечивают защиту ниже лежащих дыхательных путей.
Множество факторов могут способствовать уменьшению глоточного тонуса, вызывая коллапс и нарушая проходимость дыхательных путей (37, 38). Это особенно часто встречается у пациентов с ожирением и обструктивным апноэ во время сна. Такие больные более чувствительны к влиянию наркотических аналгетиков и остаточным эффектам анестезии (39, 40). Поздняя обструкция дыхательных путей при применении наркотических аналгетиков является общепризнанной проблемой для пациентов с обструктивным апноэ во время сна (41). Остаточная мышечная релаксация в соответствии с результатами наблюдений увеличивает частоту респираторных осложнений после операции. Отношение train-of-four (стимулятор периферических нервов) 0,7–0,9 сопровождается нарушением глоточной функции, нарушением проходимости дыхательных путей, повышенным риском аспирации и ослабленной ответной реакцией на гипоксию со стороны дыхания (42–44).
Отношение train-of-four (стимулятор периферических нервов) 0,7–0,9 сопровождается нарушением глоточной функции, нарушением проходимости дыхательных путей, повышенным риском аспирации и ослабленной ответной реакцией на гипоксию со стороны дыхания (42–44).
Ослабленные ларинготрахеальные рефлексы увеличивают риск аспирации и нарушения функции дыхательных путей. Частичная или полная обструкция дыхательных путей с форсированными попытками вдоха создает выраженное отрицательное внутригрудное давление, что ведет к открытию пищевода, увеличивая риск регургитации (45).
Форсированная вентиляция под положительным давлением через маску или супраглоточные приспособления для восстановления проходимости дыхательных путей (например, сложности при ИВЛ мешок/маска) могут преодолевать тонус нижнего пищеводного сфинктера и вызывать расширение желудка.
При ослаблении рефлексов с дыхательных путей попадание в них сгустков крови может вести к полному нарушению проходимости дыхательных путей (46).
Защитные ларингеальные рефлексы после экстубации трахеи отклонены от нормы. Дальнейшему их нарушению могут способствовать последующие манипуляции на дыхательных путей с использованием супраглоточных устройств для восстановления проходимости (47–49).
Дисфункция ларингеальных рефлексов
Под парадоксальные движением голосовых связок понимают редкое состояние, при котором голосовые связки на вдохе смыкаются. Это может становиться причиной стридор при экстубации. Более часто встречается у пациентов молодого возраста женского пола и при эмоциональном стрессе. Данное состояние часто трактуется неверно, а пациенту оказывают помощь как при ларингоспазме или бронхоспазме. Диагноз можно поставить только при непосредственном анализе состояния голосовых связок и ответной реакции на применение с лечебной целью анксиолитиков, седативных или наркотических аналгетиков (50–53).
Исчерпание запасов кислорода при экстубации
Вслед за экстубацией преследуется цель обеспечить беспрерывную доставку кислорода в легкие пациента. Факторы, способствующие быстрому истощению запасов кислорода и уменьшению сатурации кислорода в артериальной крови, суммированы в табл. 1.
Факторы, способствующие быстрому истощению запасов кислорода и уменьшению сатурации кислорода в артериальной крови, суммированы в табл. 1.
Табл. 1. Факторы, способствующие уменьшению сатурации кислородом артериальной крови и истощению запасов кислорода при экстубации
| Патофизиологические | Уменьшение функциональной остаточной емкости Гиповентиляция Диффузионная гипоксия Ателектазы Вентиляционно-перфузонные нарушения Нарушение рефлексов с дыхательных путей Озноб Нестабильность сердечно-сосудистой системы Нарушение функции нервной системы Метаболические нарушения Поражения дыхательных путей |
| Фармакологические | Мышечные релаксанты Наркотические аналгетики Остаточный эффект анестетиков |
| Человеческие и другие факторы | Неправильное использование оборудование Неадекватная помощь со стороны вспомогательного персонала Положение пациента Контакт с дыхательными путями, например, повязки/желудочный зонд/ригидные фиксаторы Нарушение подачи кислорода во время транспортировки пациента Затруднения в общении (например, языковые, ментальные препятствия) Нарушение подачи кислорода пациенту в состоянии возбуждения или пациенту, который неспособен к продуктивному контакту |
Повреждение дыхательных путей
Повреждение дыхательных путей может быть результатом непосредственной травмы при хирургическом или анестезиологическом вмешательстве или опосредованным – при последующем кровотечении, отеке.
Любое оперативное вмешательство или повреждение в просвете или вокруг дыхательных путей может вызывать осложнения при экстубации. Операции на щитовидной железе, ларингоскопия, панендоскопия, вмешательства в челюстно-лицевой области, на шейном отделе позвоночника, сонных артериях или иные операции на голове/шее могут вызывать непосредственное нарушение функции дыхательных путей в связи с образованием гематомы, отеком, нарушением лимфатического дренажа, параличом голосовых связок, трахеомаляцией (54, 55). Положение пациента (на животе или длительное положение в позиции Тренделенбурга), длительная операция, гипергидратация, анафилаксия могут способствовать отеку дыхательных путей.
Повреждение дыхательных путей может быть следствием ларингоскопии, введения и присутствия интубационной трубки или дополнительных устройств в дыхательных путях. Травма в области голосовой щели может быть следствием использования электродов для транспищеводной эхокардиографии и применения назогастрального зонда, зондов чрезмерно большого размера и избыточного давления в манжетке или вследствие неправильного расположения трубки в трахее (например, раздувание манжетки в области голосовых связок). Осложнения, развивающиеся вследствие поражения дыхательных путей, зачастую не проявляются до экстубации трахеи; к непосредственным осложнениям относятся нарушение функции перстнечерпаловидного сустава и паралич голосовых связок; опосредованные осложнения могут быть следствием эффектов давления и обусловливаться гематомой, отеком или медиастинитом (56).
Осложнения, развивающиеся вследствие поражения дыхательных путей, зачастую не проявляются до экстубации трахеи; к непосредственным осложнениям относятся нарушение функции перстнечерпаловидного сустава и паралич голосовых связок; опосредованные осложнения могут быть следствием эффектов давления и обусловливаться гематомой, отеком или медиастинитом (56).
Анализ исков АОА в отношении повреждения дыхательных путей показал, что 33% повреждений приходится на гортань, 19% – глотку, 18% – пищевод, 15% – трахею, 10% – височно-челюстной сустав, 5% – нос. Среди повреждений гортани, которые привели к искам, наиболее часто встречался паралич голосовых связок (34%), следующее место в частотном ряду заняла гранулема (17%), смещение черпаловидного хряща (8%), гематома (3%). Большинство случаев повреждений гортани (85%) развивалось после кратковременной интубации трахеи, 80% – рутинной (неосложненной) интубации трахеи (57). У взрослых наиболее узкой частью дыхательных путей является голосовая щель. Смещение эндотрахеальной трубки избыточного размера, плохо установленной трубки или трубки с перераздутой манжеткой в области заднего отдела глотки и черпаловидного хряща может вести к отеку и нарушению газотока (58). Супраглоточный отек может становиться причиной смещения надгортанника кзади и (обычно) обструкции на вдохе. Отек глотки, подглоточного пространства, трахеи может быть причиной опасного для жизни нарушения проходимости дыхательных путей.
Смещение эндотрахеальной трубки избыточного размера, плохо установленной трубки или трубки с перераздутой манжеткой в области заднего отдела глотки и черпаловидного хряща может вести к отеку и нарушению газотока (58). Супраглоточный отек может становиться причиной смещения надгортанника кзади и (обычно) обструкции на вдохе. Отек глотки, подглоточного пространства, трахеи может быть причиной опасного для жизни нарушения проходимости дыхательных путей.
Физиологические отклонения в других системах
Процесс экстубации вызывает усиленные рефлекторные реакции в других физиологических системах, что ведет к гипертензии, тахикардии (с ишемией миокарда), повышению венозного давления, росту внутриглазного и внутричерепного давления (59–63).
Факторы со стороны человека
Факторы окружающей среды не столь благоприятны как на момент интубации. Оборудование, мониторинг, помощь окружающих могут не соответствовать требованиям. Факторы со стороны человека могут быть обусловлены снижением внимания, недостатком времени, усталостью оператора, отсутствием оборудованием или опытного помощника, невозможностью полноценной коммуникации (64–66).
Оборудование, мониторинг, помощь окружающих могут не соответствовать требованиям. Факторы со стороны человека могут быть обусловлены снижением внимания, недостатком времени, усталостью оператора, отсутствием оборудованием или опытного помощника, невозможностью полноценной коммуникации (64–66).
1. Membership of the Difficult Airway Society Extubation Guidelines Group: Popat M., Mitchell V., Dravid R. et al. Difficult Airway Society Guidelines for the management of tracheal extubation // Anaesthesia. – 2012. – V. 67. – P. 318–340, with permission from the Association of Anaesthetists of Great Britain & Ireland/Blackwell Publishing Ltd.
Проф. Беляев А.В.
Экстубация трахеи: Протокол Ассоциации трудные дыхательные пути (2012 г.). Часть II.Раздел:Протоколы.Ассоциация анестезиологов Киева
Экстубация
Отсутствуют четкие научные данные в поддержку какой-то одной стратегии экстубации для каждого из пациентов. Тем не менее, существует общая согласованная позиция, что хорошая подготовка является ключом успешной экстубации и такой подход следует применить к каждому из пациентов (10, 18, 67, 68).
Тем не менее, существует общая согласованная позиция, что хорошая подготовка является ключом успешной экстубации и такой подход следует применить к каждому из пациентов (10, 18, 67, 68).
Общие принципы
Экстубация является плановой манипуляцией. Важно спланировать и выполнить ее успешно. Целью является обеспечение непрерывной подачи кислорода в легкие пациента, исключение раздражения дыхательных путей, обладать планом возвращения к исходной позиции, что позволит обеспечить вентиляцию и повторную интубацию с минимальными затратами и замедлением во времени. С момента внедрения рекомендаций по непланируемой сложной интубации Ассоциации трудные дыхательные пути концепция ступенчатого подхода получила широкое распространение. Такой подход был использован и для реализации безопасной экстубации.
Рекомендации по экстубации трахеи Ассоциации трудные дыхательные пути (рис. 1–3)
1–3)
Рис. 1. Базовый алгоритм
Рис. 2. Алгоритм для пациентов низкого риска
Рис. 3. Алгоритм для пациентов с риском
В рекомендациях описываются четыре следующих шага:
Шаг 1: Планирование экстубации.
Шаг 2: Подготовка к экстубации.
Шаг 3: Выполнение экстубации.
Шаг 4: Мероприятия после экстубации: восстановление и последующие мероприятия.
Шаг 1: планирование экстубации
Следует иметь черновой план экстубации до введения в наркоз, его следует скорректировать на этапе наркоза и непосредственно перед экстубацией. В планирование входит анализ состояния дыхательных путей и общих факторов риска. Следующие вопросы могут оказать помощь в принятии решения (69), ответы на эти вопросы окажут помощь в определении, относится ли экстубация к группе «низкого риска» или является «рискованной» (67):
1. Имеют ли место факторы риска со стороны дыхательных путей?
Имеют ли место факторы риска со стороны дыхательных путей?
— были ли дыхательные пути в норме/неосложненными на момент индукции?
— произошли ли изменения со стороны дыхательных путей?
2. Имеют ли место общие факторы риска?
Экстубация «низкого риска». Это экстубация рутинная или неосложненная. Дыхательные пути в норме/неосложненные на момент индукции и остаются без изменений на момент окончания операции, отсутствуют общие факторы риска.
Экстубация с «риском». Это экстубация с риском возможных осложнений. Факторы риска со стороны дыхательных путей:
1. Исходно трудные дыхательные пути. Доступ к дыхательным путям был сложен на момент индукции (ожидаемо или неожидаемо), во время операции могли произойти дополнительные негативные отклонения. В эту группу относятся пациенты с ожирением и обструктивным апноэ во время сна, с риском аспирации желудочного содержимого.
2. Ухудшения состояния дыхательных путей в периоперативном периоде. Дыхательные пути в норме на момент индукции, но их состояние, возможно, ухудшилось, например, в связи с нарушением анатомии, кровотечением, гематомой или отеком вследствие операции, травмы или факторов, не связанных с операцией.
Дыхательные пути в норме на момент индукции, но их состояние, возможно, ухудшилось, например, в связи с нарушением анатомии, кровотечением, гематомой или отеком вследствие операции, травмы или факторов, не связанных с операцией.
3. Доступ к дыхательным путям ограничен. На момент индукции имел место полноценный доступ, но он ограничен на момент окончания операции, например, сужен просвет или ограничены движения головы/шеи (фиксация теменных бугров, шинирование нижней челюсти, хирургические импланты, фиксация шейного отдела позвоночника).
Могут также иметь место общие факторы риска; к ним может относиться осложненная экстубация, нарушение функции дыхания, нестабильность сердечно-сосудистой системы, нарушения неврологические/нейромышечные, гипо/гипертермия, нарушения со стороны системы свертывания, кислотно-основного состояния и концентрации электролитов.
Медленное восстановление после наркоза желательно для успешного завершения некоторых хирургических вмешательств. Например, кашель и напряжение могут становиться причинами роста венозного давления, ведущего к образованию гематомы, компрессии дыхательных путей и расхождению швов. Увеличение внутриглазного и внутричерепного давления могут ухудшать исходы операций. Сердечно-сосудистые изменения могут представлять риск для пациента с ишемической болезнью сердца (62, 70).
Например, кашель и напряжение могут становиться причинами роста венозного давления, ведущего к образованию гематомы, компрессии дыхательных путей и расхождению швов. Увеличение внутриглазного и внутричерепного давления могут ухудшать исходы операций. Сердечно-сосудистые изменения могут представлять риск для пациента с ишемической болезнью сердца (62, 70).
Шаг 2: подготовка к экстубации
Подготовка преследует цели окончательной оптимизации дыхательных путей, общих и логистических факторов для обеспечения наилучших возможных условий для успешной экстубации. Одновременно с планированием (шаг 1) подготовка (шаг 2) стратифицирует экстубацию в группы «низкого риска» и «рискованную» и всегда должна предшествовать экстубации (шаг 3).
Окончательный анализ и оптимизация дыхательных путей. Следует повторно оценить состояние дыхательных путей в конце операции и перед экстубации. Такой анализ следует применить при окончательной подготовке плана экстубации и определения наиболее приемлемого плана повторной интубации при неэффективности экстубации.
Анализ следует предпринять в следующей логической последовательности:
1. Дыхательные пути. Обязательно необходимо рассмотреть, будет ли возможность обеспечить вентиляцию мешком-маской. Отек, кровотечение, сгустки крови, травмы, инородные тела, изменение формы дыхательных путей можно определить прямой или непрямой ларингоскопией. Необходимо помнить, что наличие эндотрахеальной трубки может сформировать ложный оптимистичный вывод о состоянии гортани при прямой ларингоскопии, а отек может прогрессировать очень быстро.
2. Гортань. Тест с возможностью дыхания при спущенной манжетке можно использовать для анализа субглоточного диаметра. С клинической точки зрения наличие звучного шума прохождения газового потока при спущенной манжетке является убедительным аргументом: отсутствие проникновения газа вокруг интубационной трубки с правильно подобранным диаметром является фактором, препятствующим безопасной экстубации. Если клинический статус предполагает отек дыхательных путей, необходимо быть крайне осторожным, даже при положительном тесте. Спирометрия позволяет количественно оценить поступление газа и является чувствительным, но малоспецифичным методом (71–76).
Спирометрия позволяет количественно оценить поступление газа и является чувствительным, но малоспецифичным методом (71–76).
3. Нижние отделы дыхательных путей. Необходимо рассмотреть факторы со стороны более нижних отделов дыхательных путей, которые могут быть противопоказаниями для экстубации, такие как травма нижних отделов дыхательных путей, отек, инфекция, скопление секрета. Рентгенография грудной клеток может потребоваться для исключения интубации бронха, пневмоторакса, хирургической эмфиземы или иной патологии легких, если интубация была затруднительной или оксигенация оставалась субоптимальной на протяжении операции.
Расширение желудка препятствует движению диафрагмы и ограничивает дыхание. Декомпрессия желудка оро/назогастральным зондом является желательной манипуляцией, если была потребность в ИВЛ под большим давлением с использованием лицевой маски/супраглоточных водуховодов.
Если план неотложной помощи при манипуляции с дыхательными путями включает субглоточный подход, необходимо определить возможность доступа к шее.
Окончательное исследование и оптимизация общих факторов. Следует полностью купировать мышечную релаксацию для обеспечения максимально возможного адекватного дыхания, восстановить защитные рефлексы с дыхательных путей и способность к удалению секрета из верхних дыхательных путей. Рекомендуется использование стимулятора периферических нервов с достижением соотношения в режиме train-of-four 0,9 или более, что в соответствии с наблюдениями уменьшает частоту осложнений со стороны дыхательных путей после операции. Акселерометр дает более точный результат в сопоставлении с визуальной оценкой ответной реакции в режиме train-of-four (42, 77). Сугаммадекс лучше купирует мышечную релаксацию, вызываемую рокурониумом (в меньшей степени – векурониумом), в сопоставлении с неостигмином. Следует скорректировать нестабильность сердечно-сосудистой системы и обеспечить адекватный водный баланс. Необходимо оптимизировать температуру тела, кислотно-основное состояние, электролитный баланс, систему свертывания крови. Необходимо обеспечение адекватной аналгезии.
Необходимо обеспечение адекватной аналгезии.
Окончательный анализ и оптимизация логистических факторов. Экстубация является плановым процессом, который следует выполнять под контролем с тем же стандартом мониторинга, требованиями к аппаратному оснащению и помощи, что и на момент индукции в наркоз. Экстубация трахеи должна занимать столько времени, сколько необходимо для ее безопасного выполнения, как и при интубации трахеи. Это следует учесть при планировании списка операций или направления за следующим пациентом. Узловым аспектом является коммуникация, все – анестезиолог, хирург и хирургическая бригада играют важную роль. Для пациента с риском могут потребоваться дополнительные ресурсы.
Шаг 2: выполнение экстубации
Шаг 3: оценка результатов экстубации
Общие соображения. Любая использованная методика экстубации должна основываться на минимальном прекращении подачи кислорода в легкие пациента. Следующие общие сообщения имеют значение для экстубации пациентов группы низкого риска и группы риска:
Следующие общие сообщения имеют значение для экстубации пациентов группы низкого риска и группы риска:
Создание запасов кислорода (преоксигенация): периоперативные анатомические и физиологические изменения, описанные выше, ухудшают газообмен, это обусловливает жизненно важное значение преоксигенации перед экстубацией. Как и при индукции в наркоз, целью преоксигенации до экстубации является пополнение запасов кислорода в легких до максимально возможного уровня за счет увеличения FEO2 более 0,9 или настолько близко к FiO2, насколько это возможно (78). Хотя исследования показывают, что FiO2 1,0 увеличивает ателектазирование легких, клиническое значение этого до сих пор не определено (79, 80). При экстубации первоочередной задачей является доведение запасов кислорода до максимально возможного уровня для продолжения поглощения кислорода во время апноэ. В силу этого рекомендуется преоксигенация FiO2 1,0 (81–85).
Положение пациента: отсутствуют научно обоснованные данные в поддержку универсального положения пациента для экстубации. Имеет место тенденция выполнять экстубацию в положении с приподнятой головой (обратное положение Тренделенбурга) или приподнятым плечевым поясом. Приподнимание и наклон головы особенно эффективно у пациентов с ожирением, поскольку создает механические преимущества для дыхания и обеспечивает более привычные условия для мониторинга и манипуляции на дыхательных путях. Положение на левом боку, с опущенным головном концом традиционно используется для пациентов с возможностью полного желудка (77, 86).
Имеет место тенденция выполнять экстубацию в положении с приподнятой головой (обратное положение Тренделенбурга) или приподнятым плечевым поясом. Приподнимание и наклон головы особенно эффективно у пациентов с ожирением, поскольку создает механические преимущества для дыхания и обеспечивает более привычные условия для мониторинга и манипуляции на дыхательных путях. Положение на левом боку, с опущенным головном концом традиционно используется для пациентов с возможностью полного желудка (77, 86).
Отсасывание: существует риск травмы мягких тканей ротоглотки, если санирование не обеспечивается под визуальным контролем (87, 88) (в идеале с использованием ларингоскопа), в частности при опасении в отношении скопления крови или тканей после хирургической обработки, нарушающих функцию дыхательных путей. Ларингоскопию следует выполнять на фоне адекватной глубины анестезии, возможно возникновение потребности в повторной ларингоскопии. Особая бдительность необходима при обнаружении крови в дыхательных путях, поскольку Национальный аудиторский проект NAP4 обращает внимание на опасность свернувшейся крови: аспирация кровью может вести к обструкции дыхательных путей и летальному исходу (89). Может потребоваться отсасывание из нижних отделов дыхательных путей с использованием эндобронхиальных катетеров одновременно с отсасыванием содержимого желудка желудочным зондом.
Может потребоваться отсасывание из нижних отделов дыхательных путей с использованием эндобронхиальных катетеров одновременно с отсасыванием содержимого желудка желудочным зондом.
Альвеолярный рекруитмент: у пациентов под наркозом развиваются ателектазы. Приемы альвеолярного рекруитмента (такие как продолжительное положительное давление в конце выдоха (ПДКВ), форсированный вдох) могут временно купировать ателектазы, но в соответствии с исследованиями не ведут к какому-либо позитивному последствию в послеоперационном периоде (81, 90). Одновременное распускание манжетки интубационной трубки и удаление трубки на пике устойчивого вдоха вызывает пассивный выдох, такой подход может быть грамотно использован для откашливания секрета и, возможно, уменьшения частоты ларингоспазма и задержки дыхания.
Препятствие закусыванию: препятствие закусыванию предотвращает нарушение проходимости интубационной трубки. Вероятность этого следует уменьшить при выходе из наркоза (91–93). Форсированные дыхательные усилия на фоне нарушения проходимости дыхательных путей может быть привести к отеку легких (см. Приложение 2) (94). При возникновении закусывания распускание манжетки интубационной трубки или ларингеальной маски может предотвратить постобструктивный отек легких, поскольку в таком случае исключается большое отрицательное давление, если существует возможность для воздуха перемещаться вокруг устройства. В качестве устройств для препятствия закусывания используются различные приспособления, включая воздуховод Гюделя. При использовании свернутого тампона важно, чтобы он был фиксирован к интубационной трубке для предотвращения смещения или случайного нарушения проходимости дыхательных путей.
Приложение 2) (94). При возникновении закусывания распускание манжетки интубационной трубки или ларингеальной маски может предотвратить постобструктивный отек легких, поскольку в таком случае исключается большое отрицательное давление, если существует возможность для воздуха перемещаться вокруг устройства. В качестве устройств для препятствия закусывания используются различные приспособления, включая воздуховод Гюделя. При использовании свернутого тампона важно, чтобы он был фиксирован к интубационной трубке для предотвращения смещения или случайного нарушения проходимости дыхательных путей.
Исключение последствий раздражения дыхательных путей: традиционно экстубацию выполняют, когда пациент или в полном сознании, или в состоянии глубокого наркоза.
Экстубация на фоне восстановленного сознания безопаснее, т. к. восстановление тонуса дыхательных путей, рефлексов, функции дыхательного центра позволяют пациенту самостоятельно поддерживать проходимость дыхательных путей.
Экстубация на фоне глубокого наркоза уменьшает вероятность возникновения кашля, сопротивления и возбуждения, гемодинамических отклонений в ответ на перемещение интубационной трубки, но эти преимущества нивелируются увеличением вероятности нарушения проходимости дыхательных путей (95–97). Данная методика не является рутинной, ее следует зарезервировать для пациентов, у которых легко управлять состоянием дыхательных путей и отсутствует риск аспирации.
Данная методика не является рутинной, ее следует зарезервировать для пациентов, у которых легко управлять состоянием дыхательных путей и отсутствует риск аспирации.
Для уменьшения риска нарушения проходимости дыхательных путей возможна замена перед выходом из наркоза интубационной трубки на ларингеальную маску (прием Бэйли (Bailey), см. далее) (98).
Наркотические аналгетики, такие как альфентанил, фентанил и морфин, используются для подавления кашлевого рефлекса. В настоящее время ультракороткого действия наркотический аналгетик ремифентанил, вводимый путем инфузии, является препаратом выбора для решения такой задачи, но методика требует скрупулезного выполнения (см. далее). Положительные последствия подавления кашля следует сопоставить с увеличением риска седации и депрессии дыхания. Для подавления кашля используется лидокаин; его можно с некоторыми положительными последствиями применять локально на момент интубации, вводить в манжетку интубационной трубки или внутривенно перед экстубацией (77).
К другим фармакологическим препаратам, используемым для уменьшения отклонений со стороны сердечно-сосудистой системы и дыхания при экстубации, относятся наркотические аналгетики, блокаторы кальциевых каналов, магнезия, лидокаин, клонидин, кетамин, бета-блокаторы (28, 99–103). Для предотвращения и/или терапии ларингоспазма используется доксапрам, но его применение сопровождается активацией сердечно-сосудистой системы, полноценная научная база в поддержку его использования по этим соображениям для предотвращения и терапии ларингоспазма отсутствует (104). Применение глюкокортикоидов для уменьшения воспалительного отека описана далее (105–107).
Экстубация «низкого риска» (рутинная). При любой экстубации существует риск осложнений. Рутинная экстубация характеризуется ожиданием того, что при необходимости реинтубацию можно будет выполнить без затруднений.
Пошаговый подход для экстубации «низкого риска» в сознании и глубокой седации приведены соответственно в табл. 1 и 2.
1 и 2.
Табл. 1. Последовательность экстубации «низкого риска» у пациента в сознании
1. Обеспечить кислородом через систему дыхания в концентрации 100% 2. Извлечь орофарингеальный секрет использованием устройств для отсасывания, в идеале – под непосредственным визуальным контролем 3. Ввести блокатор закусывания для предотвращения окклюзии трубки 4. Придать пациенту адекватное положение 5. Ввести антагонисты мышечных релаксантов 6. Обеспечить стабильное нормальное и адекватную спонтанную минутную вентиляцию 7. Обеспечить возможность восстановления сознания, проявляющегося открытием глаз и выполнением команд 8. Свести к минимуму движения головы и шеи 9. Использовать положительное давление, распустить манжетку и извлечь трубку тогда, когда объем легких примерно соответствует жизненной емкости 10. Обеспечить кислород 100% в дыхательном контуре, убедиться в проходимости дыхательных путей и адекватности дыхания 11. |
Табл. 2. Последовательность экстубации «низкого риска» у пациента в глубокой седации. Резервируется для пациента со спонтанным дыханием, неосложненными дыхательными путями, выполняется только клиницистом, который знаком с методикой
1. Убедиться в отсутствии дальнейшей хирургической активности 2. Обеспечить оптимальное соотношение между адекватной аналгезией и подавлением дыхательного центра 3. Обеспечить подачу кислорода 100% через дыхательный контур 4. Обеспечить адекватную глубину анестезии ингаляционными анестетиками или тотальной внутривенной анестезии при необходимости 5. Придать пациенту адекватное положение 6. Удалить орофарингеальный секрет использованием отсоса, в идеале – под непосредственным визуальным контролем 7. Распустить манжетку интубационной трубки. 8. Применить положительное давление в дыхательном контуре и извлечь интубационную трубку 9. Перепроверить проходимость дыхательных путей и адекватность дыхания 10. Поддержать проходимость дыхательных путей простыми манипуляциями на дыхательных путях, ротовой полости или носоглотке до полного пробуждения пациента 11. Продолжить подачу кислорода маской до завершения восстановления 12. Необходим контроль со стороны анестезиолога до восстановления сознания пациента и обеспечения пациентом проходимости дыхательных путей |
1. Membership of the Difficult Airway Society Extubation Guidelines Group: Popat M., Mitchell V., Dravid R. et al. Difficult Airway Society Guidelines for the management of tracheal extubation // Anaesthesia. – 2012. – V. 67. – P. 318–340, with permission from the Association of Anaesthetists of Great Britain & Ireland/Blackwell Publishing Ltd.
– 2012. – V. 67. – P. 318–340, with permission from the Association of Anaesthetists of Great Britain & Ireland/Blackwell Publishing Ltd.
Проф. Беляев А.В.
Ускоренное вмешательство в виде общей анестезии, основанной на низких дозах опиоидов и ранней экстубации трахеи у взрослых, перенесших операцию на сердце
Вопрос обзора
Ускоренная кардиологическая помощь включает раннее удаление, в течение восьми часов после операции на сердце, трубки, которая обеспечивает механическую поддержку дыхания (так называемая ранняя экстубация трахеи), чтобы обеспечить проведение кардиохирургического вмешательства. В этом обзоре рассмотрены данные об эффективности и безопасности ускоренной медицинской помощи по сравнению с обычной (не ускоренной) помощью. Мы обновили опубликованные доказательства, которые мы создали в 2012 году. Доказательства актуальны по март 2016.
Актуальность
В прошлом, в сердечно-сосудистой хирургии взрослым проводили анестезию, основанную на высоких дозах опиоидов, и обеспечивали механическую поддержку дыхания в течение ночи в отделении интенсивной терапии после операции. Сейчас многие хирургические отделения убирают трубку, которая обеспечивает механическую поддержку дыхания, когда пациент находится на операционном столе, или в течение нескольких часов после операции на сердце. Они используют протоколы, рассчитанные по времени, для удаления поддержки дыхания. Некоторые пациенты восстанавливаются в отделении интенсивной терапии (ICU) или в специальном отделении за пределами ICU. Важно повысить эффективность работы больницы, используя безопасное ускоренное вмешательство.
Сейчас многие хирургические отделения убирают трубку, которая обеспечивает механическую поддержку дыхания, когда пациент находится на операционном столе, или в течение нескольких часов после операции на сердце. Они используют протоколы, рассчитанные по времени, для удаления поддержки дыхания. Некоторые пациенты восстанавливаются в отделении интенсивной терапии (ICU) или в специальном отделении за пределами ICU. Важно повысить эффективность работы больницы, используя безопасное ускоренное вмешательство.
Характеристика исследований
Мы нашли 28 соответствующих рандомизированных контролируемых исследований, проведенных в период с 1994 по 2015 год. Большинству из 4438 взрослых, принимавших участие в этих исследованиях, впервые проводили плановое коронарное шунтирование или хирургическую замену клапана, или оба вмешательства одновременно. Они были с низким или умеренным риском смерти после операции. Восемнадцать исследований изучали использование низких доз опиоидов для общей анестезии. В шестнадцати исследованиях оценивали, насколько были эффективны протоколы, как руководство к действию для персонала по удалению трубки, которая поддерживала дыхание в течение восьми часов после операции.
В шестнадцати исследованиях оценивали, насколько были эффективны протоколы, как руководство к действию для персонала по удалению трубки, которая поддерживала дыхание в течение восьми часов после операции.
Основные результаты и качество доказательств
Мы не обнаружили никаких различий в риске смерти в течение первого года после операции (18 испытаний, 3796 участников), ни осложнений после операции, таких как необходимость замены трахеальной трубки после операции (17 испытаний, 1855 участников) и возникновение инфаркта миокарда ( 16 испытаний, 3061 участников) или инсульта (16 испытаний, 2208 участников), при анализе обоих видов вмешательств. Различий в частоте случаев острой почечной недостаточности, больших кровотечений, сепсиса и раневой инфекции также не обнаружено. Мы оценили качество доказательств как низкое для обоих исходов, как смертность так и послеоперационные осложнения.
Экстубация трахеи была проведена у взрослых в группе по уходу с ускоренной помощью раньше на полдня, чем у тех, кто был в группе традиционной терапии. Группа ускоренного лечения провела меньше времени в отделении интенсивной терапии, но продолжительность времени, проведенного в больнице была одинаковой в обеих группах. Качество доказательств было низким из-за ограничений исследований и необъяснимых различий в результатах исследования. Крупных испытания было мало, и только одно исследование было направлено на изучение послеоперационных осложнений, таких как инфаркт миокарда, инсульт или смерть.
Группа ускоренного лечения провела меньше времени в отделении интенсивной терапии, но продолжительность времени, проведенного в больнице была одинаковой в обеих группах. Качество доказательств было низким из-за ограничений исследований и необъяснимых различий в результатах исследования. Крупных испытания было мало, и только одно исследование было направлено на изучение послеоперационных осложнений, таких как инфаркт миокарда, инсульт или смерть.
Наши результаты не относятся к пациентам «высокого риска», которые имели несколько проблем со здоровьем одновременно или условий, в которых были использованы короткодействующие опиоиды (ремифентанил) для общей анестезии.
Выводы
Ускоренная кардиологическая помощь безопасна у пациентов, послеоперационный риск смерти которых низкий или средний.
Экстубация трахеи: Протокол Ассоциации трудные дыхательные пути (2012 г.). Часть III.Раздел:Протоколы.Ассоциация анестезиологов Киева
Экстубация с «риском». При экстубации «с риском» выявляются (шаги 1 и 2 представленные ранее) общий фактор риска и/или фактор риска со стороны дыхательных путей, которые позволяют предполагать, что пациент будет не способен самостоятельно поддерживать проходимость дыхательных путей после извлечения интубационной трубки и может возникнуть потребность в реинтубации.
При экстубации «с риском» выявляются (шаги 1 и 2 представленные ранее) общий фактор риска и/или фактор риска со стороны дыхательных путей, которые позволяют предполагать, что пациент будет не способен самостоятельно поддерживать проходимость дыхательных путей после извлечения интубационной трубки и может возникнуть потребность в реинтубации.
К примеру, экстубация с «риском» может иметь место при выходе из наркоза у пациента, которому выполнялась ургентная операция по поводу расслаивающейся аневризмы аорты на фоне таких общих факторов, как полный желудок, нестабильность сердечно-сосудистой системы, нарушения кислотно-основного состояния или температуры тела, что делает экстубацию более проблемной.
Примером экстубации с «риском» в связи с факторами со стороны дыхательных путей может быть пациент, которому выполняется операция на голове и шее после интубации трахеи до операции с использованием фибробронхоскопа в силу предшествующей лучевой терапии головы и шеи.
Шаг 1 определит обоих пациентов в группу экстубации с «риском». Шаг 2 даст возможность стабилизировать общие факторы и оптимизировать логистические факторы, например, связь с отделением интенсивной терапии, настройку оборудования, запрос о помощи.
Ключевое решение, которое следует принять, безопаснее ли пациента экстубировать или лучше трахея пусть остается интубированной. Если рассматривается, что безопаснее пациента экстубировать, следует рассмотреть вопрос об экстубации в сознании или с использованием одной из ниже приведенных продвинутых методик. В наличии широкий спектр устройств и продвинутых методик, но ни одна из методик не может использоваться одновременно во всех клинических случаях. Ни одна из данных методик не лишена риска; подготовка и приобретение опыта в их использовании крайне важны перед их применением, поскольку данные методики применяются в ситуациях трудных дыхательных путей. Если рассматривается небезопасность экстубации, возможными вариантами решения являются отложить экстубацию или выполнить трахеостомию.
Экстубация больного в сознании: методика экстубации пациента с «риском» после восстановления сознания такова же, как и описанная выше для группы низкого риска. Она приемлема для большинства пациентов группы с «риском» (например, с риком аспирации, ожирением, многие больные с трудными дыхательными путями). Но в некоторых ситуациях помощь могут оказать одна или несколько из ниже приведенных методик:
Замена на ларингеальную массу (прием Бэйли (Bailey)): прием включает в себя замену эндотрахеальной трубки на ларингеальную маску для поддержания проходимости дыхательных путей без их раздражения, физиологического контроля, защиты дыхательных путей от нарушения их проходимости кровью и секретом в ротовой полости. Эта методика эффективна как для экстубации в сознании, так и экстубации в состоянии глубокой седации (108–111), она несет пользу в случаях, когда имеет место риск нарушений зоны хирургического вмешательства в связи с активацией сердечно-сосудистой системы вследствие наличия эндотрахеальной трубки. Методика может быть также давать положительный эффект у курильщиков, астматиков и других пациентов с раздраженными дыхательными путями. Она неприемлема для пациентов с ожидаемыми затруднениями при реинтубации или риском регургитации. В исходно описанной методике используется классическая ларингеальная маска (98, 112). Данные по использованию других супраглоточных устройств отсутствуют. Методика нуждается в опыте и внимательном отношении к деталям; для исключения ларингоспазма весьма значима адекватная глубина анестезии (табл. 1).
Табл. 1. Последовательность замены на ларингеальную маску при экстубации с «риском»
1. Применить кислород 100% 2. Избегать раздражения дыхательных путей: необходима или глубокая анестезия, или мышечные релаксанты 3. Выполнить ларингоскопию и отсасывание под непосредственным визуальным контролем 4. Ввести ларингеальную маску со спущенной манжетской позади интубационной трубки 5. Обеспечить расположение лангеальной маски с правильным положением ее концевой части 6. Раздуть манжетку ларингеальной маски 7. Спустить манжетку интубационной трудки и извлечь трубку на фоне поддержания положительного давления 8. Продолжить доставку кислорода через ларингеальную маску 9. Ввести блокатор закусывания 10. Усадить пациента в вертикальном положении 11. Допустить самостоятельный выход из наркоза |
Данный метод позволяет правильно расположить ларингеальную маску, поскольку эндотрахеальная трубка после введения фиксирует надгортанник, предотвращая смещение надгортанника книзу. К методикам, аналогичным приему Бэйли, относятся:
1. Извлечение эндотрахеальной трубки до введения ларингеальной маски с последующей ларингоскопией и отсасыванием из глотки.
2. Введение фибробронхоскопа через трубку ларингеальной маски для подтверждения правильности ее расположения и регистрации движения голосовых связок. Такая методика пригодна для пациента с операцией на щитовидной или паращитовидной железе и других ситуациях нарушения целостности анатомии дыхательных путей.
3. Замена назотрахеальной трубки ларингеальной маской с использованием одного из двух методов: ларингеальная маска может быть введена со стороны назотрахеальной трубки так, чтобы маска прошла позади трубки; или назотрахеальную трубку извлекают до введения ларингеальной маски.
Методика экстубации с использованием ремифентанила: наличие эндотрахеальной трубки может индуцировать кашель, возбуждение, гемодинамические нарушения при выходе из наркоза. В некоторых группах пациентов (например, нейрохирургического профиля, челюстно-лицевого профиля, после пластических операций, с выраженными заболеваниями сердца или мозговых сосудов) такие ответные реакции нежелательны. В данных ситуациях возможны и экстубация в сознании, и экстубации в глубокой седации, но они далеки от идеала. Подавление кашля наркотическими аналгетиками и их способность купировать сердечно-сосудистые отклонения при экстубации известны на протяжении многих лет (113, 114). Инфузия ультракороткого действия наркотического аналгетика ремифентанила купирует такие нежелательные ответные реакции и может использоваться для обеспечения переносимости нахождения трубки у пациента, который находится в полном сознании и выполняет команды.
Инфузия ремифентанила широко описывалась в качестве метода обеспечения седации на фоне сознания для фиброоптической интубации на фоне спонтанного дыхания (115–119). Появляются данные за использование аналогичной методики при выходе из наркоза и экстубации (120–125). Ряд факторов оказывают влияние на дозы ремифентанила, необходимые для предотвращения кашля во время экстубации: обусловленные состоянием пациента, особенностями хирургического вмешательства и обезболивания. Инфузию ремифентанила можно использовать двумя путями: продолжение введения препарата после исходного интраоперационного применения, назначение ремифентанила специально для экстубации. Успех данных методик лежит в исключении гипнотического компонента анестезии (ингаляционного препарата или пропофола) задолго до экстубации, что позволяет вводить ремифентанил методом титрования фармакологического эффекта адекватно клинической ситуации. В литературе описано большое разнообразие доз, но в целом введение методом титрования фармакологического эффекта преследует цель или исключить кашель (слишком малые дозы), или отсрочить выход из наркоза и апноэ (слишком большие дозы) (табл. 2).
Табл. 2. Последовательность применения инфузии ремифентанила для экстубации с «риском»
1. Рассмотреть вопрос об аналгезии после операции. При адекватности ситуации применить морфин внутривенно до окончания операции (126) 2. До окончания операции обеспечить инфузию ремифентанила с желательной скоростью 3. Ввести антагонисты мышечных релаксантов на адекватном ситуации этапе операции и выхода из наркоза 4. Прекратить введение анестетика (ингаляционного препарата или пропофола) 5. При использовании ингаляционного препарата применить смесь с высоким содержанием кислорода с целью полной элиминации анестетика, обеспечить мониторинг его концентрации 6. Продолжить вентиляцию 7. Ларингоскопию и отсасывание по возможности следует выполнить под непосредственным визуальным контролем 8. Перевести пациента в положение сидя 9. Не торопить события, не стимулировать пациента, ожидать, когда пациент откроет свои глаза по команде 10. Прекратить вентиляцию с положительным давлением 11. При адекватном спонтанном дыхании извлечь интубационную трубку и прекратить инфузию 12. Если спонтанное дыхание неадекватно, способствовать глубокому дыханию пациента и уменьшить скорость инфузии |
Экстубация с помощью катетера в дыхательных путях: у пациента с вероятностью сложной реинтубации возможен положительный эффект от постоянного доступа к дыхательным путям, чего можно достичь применением обменного катетера для дыхательных путей (AEC, от англ. airway exchange catheter) (127, 128). Данное приспособление вводят в трахею через интубационную трубку до экстубации. Концепция экстубации со специально разработанными полыми катетерами для трахеи у пациентов с трудными дыхательными путями была разработана Бедгером (Bedger) и Чангом (Chang), а позже использована Купером (Cooper) у 202 пациентов (129–131). Описаны другие подобные устройства, но в Великобритании продается только одно устройство для решения такой задачи. Это Cook Airway Exchange Catheters (William Cook Europe, Bjaeverskov, Denmark). Описано использование катетеров для санации, назогастральных зондов, Aintree Intubation Catheter (William Cook Europe), но они имеют недостатки (132).
Обменный катетер для дыхательных путей является длинной тонкой полой трубкой, сделанной из полужесткого термостабильного полиуретана. Катетеры имеют тупой конец, отверстия на дистальном конце и боковые отверстия, являются рентгенконтрастными, по внешней поверхности нанесены маркеры длины введения. Они снабжены съемными 15 мм коннекторами, которые совместимы с дыхательным контуром и/или коннекторами Люера для вентиляции от источника высокого давления (jet) или носителей кислорода. Доступны для практического использования катетеры различных размеров, наиболее приемлемыми для экстубации являются катетеры 11- и 14-FG с длиной 83 см; их внутренний диаметр 2,3 и 3 мм соответственно, внешний – 3,7 и 4,7 мм, что совместимо с интубационными трубками, имеющими внутренний диаметр более 4 и 5 мм соответственно.
Обменные катетеры для дыхательных путей могут использоваться как направитель, поверх которого интубационная трубка может быть введена в случае потребности в реинтубации, и могут использоваться для оксигенации легких пациента. Эффективность при использовании для реинтубации велика. Большинство случаев летальных исходов связывают с неадекватной оксигенацией и неправильным расположением. Во всех случаях обязательно необходимо уделить внимание расположению дистального конца в средней части трахеи. Инсуфляцию кислорода и вентиляцию от источника с повышенным давлением следует использовать с большой осторожностью, поскольку имели место сообщения о боратравме и летальных исходах (133–136). Анестезиолог должен быть знаком с таким устройствами: тренировку, практику и повторное применение можно достичь использованием сценариев с применением манекенов.
Проспективное исследование 354 пациентов с трудными дыхательными путями на протяжении 9-летнего периода подтвердило безопасность и эффективность обменных катетеров для дыхательных путей (137). Имела место высокая степень успешного применения при первых же попытках реинтубации. Осложнения (включая низкую сатурацию кислорода, брадикардию, гипотензию, интубацию пищевода, применение дополнительных устройств для восстановления проходимости дыхательных путей) при использовании для реинтубации обменных катетеров встречались реже. В других исследованиях пациентов с трудными дыхательными путями также приведены данные об успешном применении катетеров (128, 138). Визуализация гортани или прямой, или видеоларингоскопией увеличивает эффективность реинтубации при использовании обменах катетеров и уменьшает частоту осложнений (139). Внимание к деталям и выполнению манипуляции следует закрепить в ходе упражнений по использованию обменных катетеров, поскольку осложнения при их использовании могут быть тяжелой степени.
Нуждаются в рассмотрении четыре методики с использованием экстубации с применением обменных катетеров:
1. Введение обменных катетеров до экстубации (табл. 3).
2. Ухудшение функции дыхания: поддержание оксигенации.
Выявление причины ухудшения функции легких и инициация необходимых мероприятий. Если ухудшение связано с нарушением проходимости на уровне верхних дыхательных путей, следует подать кислород с большой скоростью только через лицевую маску (не через обменные катетеры), необходимо использовать стандартные приемы на дыхательных путях или дополнительные приспособления, постоянное положительное давление в дыхательных путях (СРАР) с использованием маски можно применить, если обменные катетер смещается к углу рта для обеспечения адекватного контакта лицевой маски, через маску следует небулайзером подать адреналин. Смесь гелия в кислороде (Heliox) можно назначить в качестве временного мероприятия для уменьшения роли отека дыхательных путей (140, 141).
Следует обеспечить подачу кислорода через обменные катетеры только в исключительных случаях в силу риска баротравмы. Обязательно необходимо убедиться, что конец катетера находится выше карины и есть пространство для выдоха газа. Газоток не должен превышать 1–2 л/мин. В подобной ситуации обычно необходима реинтубация.
3. Реинтубация с использованием обменных катетеров. Это сложная манипуляция. Требуется полноценный мониторинг, помощь опытного ассистента и необходимое оборудование (табл. 4).
4. Вентиляция с использованием источника высокого давления (jet) через обменный катетер во время неотложных мероприятий по восстановлению проходимости дыхательных путей. Jet вентиляция через обменные катетеры преследует цель избежать опасной для жизни гипоксии, а не обеспечить полноценную вентиляцию. Необходимо быть знакомым с оборудованием и методикой. Баротравма, развивающиеся вследствие миграции обменного катетера и jet вентиляции ниже карины, является потенциально опасным осложнением, поэтому данную методику следует рассматривать только в качестве мероприятия последней очереди и использовать, когда обеспечен газоток вокруг обменного катетера на выдохе (134, 137). Проходимость верхних дыхательных путей с использованием приемов по восстановлению проходимости и/или дополнительных устройств для обеспечения выдоха способствует дополнительному исключению вероятности баротравмы. В наличии множество источников для вентиляции под высоким давлением, но наиболее безопасный включает датчик давления, который прекращает подачу газа при давлении выше 10–20 см вод.ст. Риск баротравмы можно уменьшить использованием минимально эффективного давления на вдохе на фоне гарантированного обеспечения спадения грудной клетки до нейтрального положения перед последующим расправлением и кратковременным временем вдоха.
Кроме баротравмы, к рискам использования обменных катетеров относятся непосредственная перфорация слизистой трахеи, интерстициальная эмфизема легких (133–136, 142, 143), смещение (в связи с сниженным комплайенсом, неэффективным контролем, неправильной фиксацией обменного катетера или манипуляций на дыхательных путях).
Табл. 3. Последовательность использования обменных катетеров для экстубации с «риском»
1. Принять решение, насколько глубоко ввести обменный катетер. Крайне необходимо, чтобы дистальный конец оставался выше карины. Если существует какая-либо неуверенность в отношении положения конца эндотрахеальной трубки, ее положение относительно карины следует перепроверить с использованием фибробронхоскопа до введения обменного катетера. Обменный катетер у взрослого никогда не следует вводить глубже 25 см 2. Когда пациент готов к экстубации, ввести смазанный любрикантом обменный катетер через эндотрахеальную трубку на исходно запланированную глубину. Никогда не продвигать обменный катетер при возникновении сопротивления 3. До удаления эндотрахеальной трубки обеспечить отсасывание из глотки 4. Извлечь эндотрахеальную трубку поверх обменного катетера при одновременном сохранения положения обменного катетера (не продвигать обменный катетер) 5. Фиксировать обменный катетер к щеке или лбу пластырем 6. Зафиксировать глубину введения на уровне зубов/губ/носа в документации 7. Перепроверить существование потока вокруг обменного катетера с использованием анестезиологического оборудования 8. Четко обозначить обменный катетер для того, чтобы не спутать его с назогастральным зондом 9. За пациентом необходим тщательный контроль 10. Дополнительно кислород может быть назначен через лицевую маску, назальные канюли или СРАР маску 11. Пациента нельзя питать через рот до извлечения обменного катетера 12. Если наличие обменного катетера вызывает кашель, перепроверить расположение конца выше карины и ввести лидокаин через обменный катетер 13. У большинства пациентов сохраняется способность к кашлю и общению 14. Извлечь обменный катетер, когда исчезает риск со стороны дыхательных путей. Обменный катетер может оставаться в дыхательных путях до 72 ч (137) |
Табл. 4. Последовательность использования обменного катетера для реинтубации
1. Расположить пациента соответствующим образом 2. Подать кислород 100% СРАР через лицевую маску 3. Выбрать интубационную трубку малого диаметра с мягким тупым фальцетированным концом (например, трубка, разработанная для использования с ларингеальной маской (Intavent Direct Ltd, Maidenheld UK)) 4. По показаниям применить анестетик или местный препарат 5. Использовать прямую или непрямую лирингоскопию для смещения языка и введения интубационной трубки (скос кпереди) поверх обменного катетера 6. После реинтубации подтвердить положение интубационной трубки капнографией |
Отложенная экстубация: экстубация является исключительно плановым процессом. Иногда нарушение состояния дыхательных путей настолько выражено, что экстубацию выполнять не следует. Наиболее приемлемым подходом в таком случае может быть отложенная экстубация на несколько часов или в некоторых случаях – на несколько дней. Отсрочка может позволить разрешить отек и увеличивает шансы успешной экстубации. Такой вариант имеет право на существование при потребности повторной операции в пределах 24 ч. Это может быть наилучшим подходом сосредоточения наиболее опытного персонала в период максимального риска; например, может быть более безопасно не экстубировать пациента с трудными дыхательными путями поздно вечером.
Если пациента переводят в отделение интенсивной терапии, следует расписать план ургентной реинтубации в соответствии с рекомендациями NAP4 (144).
Плановая хирургическая трахеостомия: вопрос о трахеостомии следует рассмотреть, когда проходимость дыхательных путей может быть нарушена в течение существенного интервала времени в связи с исходными проблемами со стороны дыхательных путей, характером операции (например, реконструктивная операция) или степени опухолевого процесса, отека, кровотечения. Анестезиолог и хирург должны обсудить эти аспекты на этапах планирования или подготовки и принять решение о трахеостомии в плановом порядке.
Решение выполнить принимается на основании: 1. Степени нарушения со стороны дыхательных путей к моменту окончания операции, 2. Вероятности ухудшения со стороны дыхательных путей в послеоперационном периоде (обычно в связи с отеком), 3. Возможности неотложных мероприятий по восстановлению проходимости, 4. Ожидаемой продолжительности выраженных нарушений со стороны дыхательных путей.
Трахеостомия уменьшает риск повреждения гортани в сопоставлении с длительным использованием эндотрахеальной трубки, в особенности это важно при отеке гортани или при ожидаемом медленном восстановлении проходимости дыхательных путей. Кроме этого, существует возможность быстрого разрешения ургентной ситуации в послеоперационном периоде без опасения в отношении незапланированной экстубации или неуспешности попытки повторной интубации. После перевода из отделения интенсивной терапии с пациентом может работать специалист общего профиля.
Профилактическое (неотложное) канюлирование субглоточного пространства: транстрахеальная канюля не формирует дыхательные пути, но в ситуациях, когда канюля может быть введена на этапе индукции по поводу предполагаемых трудных дыхательных путей, ее можно оставить in situ (145). «Гарантированное» наличие транстрахеального катетера и возможность подать кислород или обеспечить вентиляцию с использованием источника с большим давлением может оказаться жизнеспасающим вариантом отказания помощи пациенту, но такой подход должен быть сбалансирован с возможными осложнениями, включая баротравму, смещение, нарушение проходимости, перегиб, травму, кровотечение, инфицирование. Необходим послеоперационный уход и мониторинг в такой же степени, как и при трахеостомии. Канюлю можно оставить в установленном место до 72 ч.
Шаг 4: уход после экстубации: восстановление и последующее ведение пациента
Представляющие опасность для жизни осложнения после экстубации не ограничиваются ранним послеоперационным периодом. Анестезиолог имеет обязательства продолжительной работы с пациентом (146).
Кислород следует применять на протяжении транспортировки в отделение восстановления после операции. Необходимо рассмотреть вопрос о портативном мониторинге при расположении послеоперационного отделения на некотором расстоянии от операционной или нестабильности состояния пациента.
Персонал и коммуникация. Опытный персонал должен обеспечивать уход за пациентом до восстановления рефлексов со стороны дыхательных путей и стабилизации физиологических функций пациента. Необходимо обеспечить каждого пациента одной сестрой, обеспечивающей восстановительное лечение. В палате восстановления после операции должно находиться не менее двух медицинских работников. Всегда должна быть предусмотрена возможность включения в работу в неотложном порядке опытного анестезиолога (147, 148).
Неотъемлемым компонентом является обеспечение полноценной коммуникации. При окончании наркоза следует обсудить хирургические и анестезиологические риски восстановления и течения послеоперационного периода. Необходимы четко сформулированные и письменно зафиксированные инструкции и для этапа выхода из наркоза, и для этапа лечения в палате или отделении интенсивной терапии. В случаях большого риска следует обеспечить возможность привлечения в неотложном порядке команды специалистов и зафиксированный в письменном виде план восстановления проходимости дыхательных путей. Особую пользу для пациента с нарушением состояния дыхательных путей несут спокойная атмосфера и уверенность, поскольку тревога увеличивает работу дыхания.
Наблюдение и угрожающие симптомы. При наблюдении необходим контроль уровня сознания, частоты дыхания, частоты сердечных сокращений, артериального давления, периферической сатурации кислорода, температуры и интенсивности боли. Капнография (использованием специально разработанной лицевой маски) дает возможность решить задачу раннего обнаружения нарушения проходимости дыхательных путей (149, 150). Во время восстановления после наркоза необходимо тщательное наблюдение за больным. Пульсоксиметр не предназначен для мониторинга вентиляции. Оксиметры могут выдать некорректные данные в различных ситуациях и на них никогда не следует полагаться, как на единственный вариант мониторинга за состоянием пациента (151–154).
К угрожающим симптомам относятся рано возникающие проблемы с дыхательными путями (стридор, компоненты нарушения проходимости дыхательных путей на протяжении дыхательного цикла, возбуждение), осложнения оперативного вмешательства (потеря по дренажам, состояние перфузии трансплантата, легочное кровотечение, образование гематомы, отек дыхательных путей), проблемы на последующих этапах после перевода в палату, включая медиастинит и поражения дыхательных путей.
Медиастинит может развиваться после перфорации дыхательных путей, например, после трудной интубации. Он характеризуется болью (тяжелой степени боль внутри грудной клетки, глубокая боль в шее, дисфагия, болезненное глотание), гипертермией, крепитацией (57). Пациентов следует информировать о симптомах медиастинита и дать совет при их возникновении следовать рекомендациям врача.
Анализ исков к АОА позволяет считать, что травма дыхательных путей наиболее часто приходится на гортань (после обычной интубации), глотку и пищевод (после трудной интубации) (56). Повреждение глотки и пищевода диагностировать сложно, пневмоторакс, пневмомедиастинит, эмфизема имеют место только в 50% случаев.
Никогда не следует пренебрегать возбуждением пациентов или жалобами на затруднения дыхания, даже при отсутствии объективной симптоматики.
Оборудование и мониторинг. В наличии для немедленного использования следует иметь набор для трудных дыхательных путей. Он должен содержать все необходимые приспособления, такие как зажим для снятия скобок, проволочная пила. По мере восстановления необходимо обеспечить стандартный мониторинг. Должна быть обеспечена капнография.
Место оказания помощи и безопасная транспортировка. Во всех случаях экстубацией должен руководить анестезиолог. Экстубацию с «риском» следует осуществлять в операционной. При опасениях в отношении проходимости дыхательных путей больного следует или оставлять в послеоперационном восстановительном отделении, или госпитализировать в отделение интенсивной терапии. Во время транспортировки в отделение восстановления после операции или отделение интенсивной терапии за пациентом должен наблюдать анестезиолог.
Транспортировка пациентов с «риском» из отделения интенсивной терапии в операционную для экстубации может быть приемлемым шагом для обеспечения доступности всего необходимого оборудования и опытных специалистов.
Респираторная терапия пациентов со спровоцированными дыхательными путями. Пациентов со спровоцированными дыхательными путями следует курировать в вертикальном положении. Им следует назначить увлажненный кислород с большим потоком. Желателен мониторинг содержания углекислого газа в конце выдоха. Пациента не следует кормить, поскольку функция гортани может быть нарушена, несмотря на то, что пациент находится в полном сознании (48). Следует исключить факторы, которые нарушают венозный отток. Необходимо способствовать глубокому дыханию пациента и откашливанию им мокроты. У пациентов с обструктивным апноэ во время сна нарушение проходимости верхних дыхательных путей можно исключить назофарингеальным воздуховодом. При использовании пациентом устройств для СРАР в домашних условиях следует обеспечить их доступность в отделении восстановления и в общей палате.
Глюкокортикоидоы уменьшают воспалительный отек дыхательных путей, являющийся следствием непосредственного поражения дыхательных путей (операция/наркоз/термические факторы/химические факторы) (105–107, 155), но не оказывают влияния на отек механической природы в связи с нарушением венозного оттока (например, гематома шеи). Научные факты позволяют считать, что все глюкокортикоридоы в одинаковой степени эффективны при условии, что их назначают в адекватных дозах (в эквиваленте 100 мг гидрокортизона каждые 6 ч). Глюкокортикоиды следует назначить как можно раньше пациентам с высоким риском воспалительного отека дыхательных путей и продолжать применение минимум 12 ч. Глюкокортикоиды в однократно вводимой дозе непосредственно до экстубации не эффективны (105–107, 155, 156).
В случаях развития обструкции дыхательных путей/стридора их отек может уменьшить адреналин (1 мг), подаваемый небулайзером. Помощь может оказать смесь гелия в кислороде, но при этом снижается FiO2 (140, 141, 157–160).
Аналгезия. Эффективная аналгезия оптимизирует функцию легких после операции. Аналгезию с седативным компонентом следует избегать или использовать осторожно методом титрования фармакологического эффекта. Важным элементом является применение эффективных противорвотных препаратов.
Документация и рекомендации по дальнейшей терапии. Клинически значимые детали и рекомендации по ведению пациента на этапе восстановления и послеоперационной терапии следует зафиксировать в анестезиологической документации. Сложности следует документировать в разделе предупреждений медицинской документации и в локальной базе данных сложной интубации. Следует отметить детали респираторной терапии и рекомендации на будущее. Последний аспект следует отослать врачу общей практики, сопровождающего пациента, а копию отдать пациенту, которому также следует дать полное объяснение происходившему, когда он будет способен усваивать информацию (161, 162). Пациента также следует предупредить об отсроченных симптомах травмы дыхательных путей и рекомендовать обратиться за медицинской помощью при их развитии. Пациентам с трудными дыхательными путями следует рекомендовать зафиксировать свои данные в доступной специализированной базе данных (типа MedicAlert).
Заключение
Рекомендации эффективны при нечасто встречаемых представляющих опасность для жизни ситуациях, в соответствии с наблюдениями улучшают показатели исхода (16, 163–170). Опубликованы ряд национальных рекомендаций по восстановлению проходимости дыхательных путей, но ни в одном из них детально не рассматривают вопросы экстубации (11–15, 18, 19).
Экстубация отличается от интубации. Экстубация всегда должна быть плановым процессом с выделением адекватного интервала времени со стороны анестезиолога для методически выверенной помощи. Практика экстубации весьма колеблется, формально ей обычно внимания не уделяется. Осложнениям во время экстубации могут способствовать технические и нетехнические факторы (36, 135, 171, 172), но показатели исходов улучшаются планированием, организацией и взаимодействием (65, 66, 173).
Рекомендации Ассоциации трудных дыхательных путей приводят стратегию экстубации, которая складывается из ступенчатого подхода планирования, подготовки и стратификации факторов риска, целью чего выявляется четкое выделение и оказание помощи пациентам с «риском» при экстубации.
Доказательная база практики экстубации ограничена, поэтому неизбежно, что часть рекомендаций в данном руководстве основываются на позиции экспертов. В большинстве случаев предпочтительной методикой является экстубация пациента в сознании. Но в определенных клинических ситуациях позитивного эффекта можно достичь экстубацией пациента в глубокой седации, заменой интубационной трубки на ларингеальную маску, инфузией ремифентанила, применением обменных катетеров для дыхательных путей. Отсрочку в экстубации или выполнение элективной трахеостомии следует рассмотреть при небезопасности экстубации.
Представляя результаты первой попытки специально обратиться к вопросам экстубации в национальном руководстве, мы представляем данный документ анестезиологическому сообществу и надеемся, что он будет использован в клинической практике с той же степенью успеха, что и рекомендации трудной интубации Ассоциации трудные дыхательные пути.
1. Membership of the Difficult Airway Society Extubation Guidelines Group: Popat M., Mitchell V., Dravid R. et al. Difficult Airway Society Guidelines for the management of tracheal extubation // Anaesthesia. – 2012. – V. 67. – P. 318–340, with permission from the Association of Anaesthetists of Great Britain & Ireland/Blackwell Publishing Ltd.
Проф. Беляев А.В.
Современные аспекты экстубации трахеи после общей анестезии
После окончания оперативного вмешательства, пробуждение и перевод пациентов на самостоятельное дыхание и экстубация трахеи является этапом высокого риска.
Существует несколько международных руководств по обеспечению проходимости дыхательных путей и упоминающих о данной проблеме: Рекомендации Американского Общества Анестезиологов (ASA) 2003 г. по нарушению проходимости дыхательных путей; рекомендации Итальянского Общества Анестезии Анальгезии Реанимации Интенсивной Терапии (Societa Italiana Anaesthesia Analgesia Rianimazione Terapia Intensiva (SIAARTI)) по обеспечению проходимости дыхательных путей и устранению нарушений проходимости дыхательных путей, 2005 г Руководства DAS (Difficult Airway Society).
DAS разработано руководство по проведению экстубации трахеи в периоперационном периоде у взрослых пациентов (2012 г). Обозначена необходимость планирования и подготовки, а также описаны практические методики и даны рекомендации по ведению больного после экстубации.
Проблемы, связанные с экстубацией, зачастую не являются в чистом виде техническими и могут быть связаны с человеческим фактором. Экстубация трахеи вызывает патофизиологические рефлекторные реакции, провоцирующие гипертензию, тахикардию, повышенное внутриглазное и внутричерепное давления.
Отчет четвертого Национального аудиторского проекта (NAP4, National Audit Project) Королевского Колледжа анестезиологов и Общества трудных дыхательных путей указывает на тяжелые осложнения со стороны дыхательных путей, развивающиеся на этапе прекращения наркоза и восстановления, занимающие примерно треть сообщений, связанных с анестезией.
Национальные клинические рекомендации «трудная интубация трахеи» и «обеспечение проходимости верхних дыхательных путей в стационаре» составлены на основе существующих и хорошо зарекомендовавших себя протоколов (алгоритмов) DAS и ASA и могут помочь в принятии оптимального решения специалисту, столкнувшемуся с проблемами обеспечения и поддержания проходимости верхних дыхательных путей. Следование рекомендациям не может гарантировать благоприятный исход в каждом конкретном случае. Поэтому также необходимо иметь стратегию экстубации пациента, причем, она должна быть логически связана с тактикой интубации пациента в каждом конкретном случае.
Положение больного при экстубации
Традиционная анестезиологическая доктрина настаивает на экстубации пациента на левом боку при опущенном головном конце стола, что направлено на снижение риска аспирации, особенно у пациентов с ожирением.
Вместе с тем, в одном из исследований, было сделано предположение, что такой подход к выбору положения пациента во время экстубации начинает сдавать свои позиции, что впоследствии было подтверждено и при опросе ведущих анестезиологов Великобритании. Отказ от использования положения на левом боку может быть связан с распространением выраженного ожирения и хронических заболеваний легких, связанных с курением, – тех случаев, когда все чаще пациентов экстубируют в положении сидя.
Преоксигенация перед экстубацией
С учетом риска непредсказуемых респираторных нарушений для повышения порога безопасности перед экстубацией рекомендуют выполнять преоксигенацию 100 % кислородом. Целью является увеличение запасов кислорода в легких до максимально возможного уровня за счет увеличения FiO2 более 0,9, что значительно повышает запасы кислорода для продолжения его поглощения во время апноэ.
Уровень сознания перед экстубацией
Принято считать, что риск ларингоспазма повышается при стимуляции дыхательных путей во время периода возбуждения (по классификации Guedel). Таким образом, экстубация должна выполняться либо, когда пациент находится на стадии глубокой анестезии, либо же когда он уже полностью пробудился.
Потенциальные опасности экстубации в состоянии глубокой анестезии включают обструкцию дыхательных путей и аспирацию желудочного содержимого. Данная методика не является рутинной, ее следует рассматривать для пациентов, у которых легко управлять состоянием дыхательных путей и отсутствует риск аспирации. Чаще всего подход к решению этой задачи должен в первую очередь быть продиктован личными предпочтениями анестезиолога.
С целью уменьшения риска нарушения проходимости дыхательных путей, возможна замена эндотрахеальной трубки на ларингеальную маску (маневр Бэйли (Bailey). Методика может быть также давать положительный эффект у курильщиков, астматиков и других пациентов с раздраженными дыхательными путями.
Фаза дыхательного цикла при экстубации
Считается, что вероятность ларингоспазма ниже во время вдоха. Это может объясняться тем, что в инспираторную фазу порог возбуждения нейронов, иннервирующих мышцы, приводящие голосовые связки, повышается. Таким образом, существует рекомендация выполнять экстубацию на высоте вдоха, при этом вспомогательный вдох с положительным давлением совершается, когда сдувается манжета. Этот прием также понуждает пациента к кашлю, что помогает удалить секрет из дыхательных путей.
Трудные дыхательные пути при экстубации трахеи
К сожалению, алгоритм ведения пациента с трудными дыхательными путями, рекомендованный Ассоциацией трудных дыхательных путей Великобритании (Difficult Airway Society, DAS), не затрагивает проблему экстубации.
Некоторое внимание этой проблеме уделено в обновленных стандартах Американской ассоциации анестезиологов (ASA) в 2003 году. Эти стандарты также рекомендуют выработать «план Б» на случай неудавшейся экстубации в связи с обструкцией дыхательных путей или дыхательной недостаточностью, что подразумевает использование «страховочного» трахеального катетера-проводника для замены трубки.
После экстубации катетер-проводник может быть использован для струйной вентиляции или подачи кислорода. Некоторые из потенциальных опасностей, связанные с использованием катетера-проводника, включают глубокое введение, травму дыхательных путей, высокое давление раздутия при проведении струйной вентиляции с последующим развитием пневмоторакса.
Фармакологические методы анестезиологической защиты при экстубации трахеи
Бета-адренергические агонисты (например, альбутерол) не снижают частоту кашля при экстубации.
Введение лидокаина внутривенно 1 мг/кг/мин. (за две минуты до экстубации) снижает кашель и гемодинамический ответ на удаление интубационной трубки. Вместе с тем, по результатам недавних исследований внутривенное введение лидокаина неэффективно по сравнению с инстилляцией через эндотрахеальную трубку за пять минут до экстубации. Также было показано, что местное орошение лидокаином перед интубацией является более эффективным, чем введение той же дозы внутривенно. Кроме того, необходимая для подавления кашлевого рефлекса концентрация лидокаина в сыворотке крови превышает 3,0 мкг/кг, тогда как подавление кашля было достигнуто при концентрациях менее 1,63 мкг/мл при нанесении лидокаина местно.
Низкие дозы ремифентанила снижают кашель и гемодинамический ответ на экстубацию. Эффекты бета-блокаторов в отношении контроля систолического артериального давления при пробуждении на превышают таковые короткодействующих опиоидов.
В настоящее время, дексмедетомидин активно применяется для седации интенсивной терапии у пациентов, находящихся на ИВЛ и во время хирургических манипуляций. Инфузия дексмедетомидина (0,5 мкг/кг) за 5 минут до экстубации, является более эффективной мерой, чем инфузия фентанила (1 мкг/кг) для снижения патофизиологических рефлексов дыхательных путей на момент экстубации трахеи и поддержания стабильной гемодинамики.
Глюкокортикоиды следует назначать как можно раньше пациентам с высоким риском воспалительного отека дыхательных путей и продолжать применение минимум 12 ч. Глюкокортикоиды в однократно вводимой дозе непосредственно до экстубации не эффективны. В случаях развития обструкции дыхательных путей/стридора их отек может уменьшить адреналин (1 мг), подаваемый небулайзером. Помощь может оказать смесь гелия в кислороде, но при этом снижается FiО2.
Реверсия нейромышечного блока при экстубации трахеи
Важно отметить, что неадекватная реверсия нейромышечного блока может иметь место даже на фоне вполне адекватной спонтанной вентиляции и приводить к повышению вероятности обструкции дыхательных путей. Для обеспечения адекватной реверсии и объективного контроля должны быть использованы стимуляторы периферических нервов, при этом наиболее часто измеряемым показателем остается TOF -соотношение (train-of-four – тест с четырехразрядной стимуляцией). Рекомендуется достижение соотношения в режиме train-of-four 0,9 или более, что в соответствии с наблюдениями уменьшает частоту осложнений со стороны дыхательных путей после операции.
Ларингоспазм
Ларингоспазм является относительно частым осложнением постэкстубационного периода. Эта рефлекторная реакция опосредована блуждающими нервами, при этом афферентная петля замыкается через верхний гортанный нерв, иннервирующий перстнещитовидную мышцу. Запуск этого рефлекса ведет к длительному смыканию связок.
Наиболее частым пусковым моментом ларингоспазма является стимуляция голосовой щели, вместе с тем могут играть роль и другие стимулы, такие как движения и хирургическая стимуляция. Эффективность введения лидокаина будет прослеживаться, если он введен в интервале от 60 до 90 секунд относительно экстубации.
Наряду с внутривенными анестетиками (пропофол от 0,25 мг/кг) и сукцинилхолином (1 мг/кг), для устранения ларингоспазма с успехом был использован доксапрам (1,5 мг/кг). Наряду с выдвижением нижней челюсти был описан мануальный прием Ларсона (Larson). Для его выполнения необходимо сильно давить в области промежутка между вертикальной (восходящей) ветвью нижней челюсти и сосцевидным отростком – в так называемой «выемке ларингоспазма».
А.Ю. Новиков, А.В. Мамонова, И.Е. Голуб, Л.В. Сорокина
Интубация трахеи. Современные рекомендации в анестезиологии
Оротрахеальная интубация и ларингоскоп Macintosh
Изогнутый ларингоскоп Macintosh радикально отличается от предшествовавших ему прямых ларингоскопов Miller. В частности, длинная ось клинка изогнута, поперечное сечение выглядит как повернутая вправо буква «Z», ребро и кромка массивные, кончик атравматичен, а лампочка защищена ребром. Однако главной инновацией Macintosh была его новая техника непрямого поднимания надгортанника, достигаемая натяжением подъязычно-надгортанной связки вслед за кончиком ларингоскопа, расположенным в валекуле. Эта техника — ключ к успеху в применении ларингоскопа Macintosh и его фундаментальный недостаток. Когда все идет хорошо, надгортанник поднимается полностью, лежит позади и параллельно задней поверхности клинка ларингоскопа. Однако у некоторых пациентов корректно расположить ларингоскоп Macintosh невозможно. Малейшее затруднение приводит к частичному приподниманию надгортанника, ошибочно описываемому как «пролабирующий надгортанник». Большие трудности приводят к полной невозможности поднять надгортанник, и, как следствие, голосовые связки не визуализируются. Интубация трахеи производится, как правило, при помощи быстрой последовательности манипуляций, в которой все компоненты сложной техники переходят один в другой. И лучше всего техника интубации получается тогда, когда отработаны все компоненты.
Техника оротрахеальной интубации
Тремя последовательными компонентами прямой ларингоскопии являются: введение ларингоскопа, коррекция его положения и подъемной силы и применение других приемов для оптимизации обзора голосовой щели. Полное открывание рта облегчает введение ларингоскопа. Он вводится с правой стороны рта и справа от языка, одновременно с этим необходимо следить за тем, чтобы не защемить губы между клинком ларингоскопа и зубами. Ларингоскоп устанавливается и одновременно сдвигается к срединной линии, чтобы сдвинуть язык влево. Прогрессирующая визуализация анатомических структур снижает риск травмы. Надгортанник является первым ключевым анатомическим ориентиром. Кончик ларингоскопа устанавливается в валекуле, и надгортанник опосредованно поднимается под силой, натягивающей подъязычно-надгортанную связку. Когда обеспечено достаточное поднимание надгортанника, дальнейшая подъемная сила прикладывается к ларингоскопу, чтобы достичь наилучшего обзора гортани. Крайне важно не упираться в верхние зубы, поскольку это может привести к их повреждению и ухудшить визуализацию гортани. Если визуализацию гортани невозможно осуществить без давления на зубы, следует отказаться от применения такого ларингоскопа и применить другой способ интубации трахеи.
Когда достигается хорошая визуализация гортани, идентифицируются голосовые связки, черпаловидно-надгортанные складки, задние хрящи гортани и межчерпаловидные ямки. Обзор следует оптимизировать, чтобы облегчить прохождение эндотрахеальной трубки. Если визуализация гортани плохая, важно убедиться в том, что базовая техника была выполнена оптимальным образом и были применены другие приемы. Наружная манипуляция с гортанью (лучше описываемая как «бимануальная ларингоскопия», которая подразумевает внутреннее движение ларингоскопа при внешнем воздействии на гортань, маневр BURP), выполняемая анестезиологом, который дает указания помощнику, всегда улучшает обзор гортани. Это ключевой прием.
Проведение эндотрахеальной трубки при эффективной ларингоскопии
Визуализация голосовых связок поддерживается, пока анестезиолог заводит трубку между голосовыми связками под контролем зрения. Прохождение трубки в гортань из заднелатерального положения облегчает наблюдение за проведением трубки к голосовым связкам и между ними. Управление трубкой и проведение ее под контролем зрения проще осуществлять, когда она имеет оптимальную форму «хоккейной клюшки», обычно придаваемую вставляемым в трубку стилетом. Эндотрахеальную трубку продвигают до тех пор, пока манжета не окажется на 2 см дистальнее голосовых связок. Важно оставить трубку в таком положении, поскольку более проксимальная позиция может привести к утечкам через манжету и давлению на возвратный гортанный нерв. Манжету раздувают до давления чуть выше «исключительно герметизирующего» и подтверждают правильное положение трубки. Затем давление в манжете фиксируют на уровне между 25 и 30 см вод. ст.
Сложности при интубации трахеи возникают преимущественно вследствие невозможности увидеть гортань. Эффективность прямой ларингоскопии оценивают с точки зрения достигнутого наилучшего ракурса гортани. Наиболее широко используемой шкалой является описанная Cormack и Lehane.
Приемы, используемые для оптимизации обзора при прямой ларингоскопии
- Максимальное разгибание головы
- Язык полностью находится слева от ларингоскопа
- Оптимальная глубина введения ларингоскопа
- К ларингоскопу приложена большая подъемная сила в правильном направлении
- Наружная манипуляция на гортани — первоначально выполняется правой рукой анестезиолога
| Спонсоры | Ведущий спонсор: Sunnybrook Health Sciences Centre Коллаборационист: Canadian Institutes of Health Research (CIHR) | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Источник | Sunnybrook Health Sciences Centre | ||||||||||||||||||||||||
| Краткое содержание | В это рандомизированное контролируемое исследование будут включены пациенты с острой тяжелой травмой головного мозга, которые прошли проба спонтанного дыхания, но с пониженным уровнем сознания. Это будет прямо сравните (1) быстрая экстубация с (2) обычным уходом с экстубацией или трахеостомией по времени по усмотрению врачей. Первичным результатом будут дни, свободные от ОИТ (дни, потраченные жив и вне отделения интенсивной терапии). | ||||||||||||||||||||||||
| Подробное описание | Тысячи пациентов ежегодно получают серьезные травмы головного мозга от таких причин, как травмы, инсульт и инфекция. Обширные клинические исследования по отказу от ИВЛ привели к рекомендациям по быстрой экстубации после успешного испытания спонтанного дыхание в отделении общей интенсивной терапии (ОИТ). Однако существует мало свидетельств того, что решения о том, когда удалять дыхательную трубку у пациентов с тяжелой травмой головного мозга. это неясно, какая из следующих стратегий может оптимизировать важные исходы для пациентов: быстрое экстубация по сравнению с ожиданием и экстубацией или выполнением трахеостомии, время в зависимости от усмотрение врачей. Каждая стратегия сопряжена с рисками: быстрая экстубация может привести к более высокие показатели неудач экстубации и повторной интубации, тогда как более длительное ожидание может выявить пациенты с осложнениями от длительной ИВЛ и трахеостомии могут привести к процедурные осложнения (или ненужные процедуры, если требуется экстубация успешно). Это испытание на пациентах с черепно-мозговой травмой позволит проверить, что из следующего приведет к для улучшения результатов лечения пациентов: (1) незамедлительное удаление эндотрахеальной трубки после спонтанного дыхательная проба пройдена; или (2) обычная помощь с выбранной стратегией прохождения дыхательных путей по желанию лечащего врача. | ||||||||||||||||||||||||
| Общий статус | Активный, не вербовочный | ||||||||||||||||||||||||
| Дата начала | 1 февраля 2017 г. | ||||||||||||||||||||||||
| Дата завершения | 31 января 2022 г. | ||||||||||||||||||||||||
| Дата первичного завершения | 19 июня 2019 г., | ||||||||||||||||||||||||
| Фаза | Нет данных | ||||||||||||||||||||||||
| Тип исследования | Интервенционный | ||||||||||||||||||||||||
| Первичный результат |
| ||||||||||||||||||||||||
| Вторичный результат |
| ||||||||||||||||||||||||
| Регистрация | 27 | ||||||||||||||||||||||||
| Состояние | |||||||||||||||||||||||||
| Вмешательство | Тип вмешательства: Процедура Название вмешательства: Экстубация Описание: Это экстубация путем удаления эндотрахеальной трубки, которую необходимо провести в день рандомизации или на следующий день. Любое решение о повторной интубации пациента будет оставлено на усмотрение клинической бригады. Точно так же, если трахеостомия считается необходимой пациенту, которому не удалось выполнить попытку экстубации, это будет сделано на усмотрение лечащей бригады. Если по какой-либо причине пациент не экстубирован в соответствии с рандомизированным графиком, причина (ы) будут записаны в форме нарушения протокола, и исследователь будет уведомлен. Если пациенту будет выполнена трахеостомия вместо экстубации, мы снова зафиксируем причины этого, но пациент будет проанализирован в группе экстубации в соответствии с принципом намерения лечить. Этикетка Arm Group: Экстубация Тип вмешательства: Процедура Название вмешательства: Обычный уход Описание: Пациенты в этой группе будут лечиться в соответствии с обычным уходом, который может включать экстубацию (удаление эндотрахеальной трубки) или введение трахеостомии, рассчитанной по усмотрению врача. Включение этой руки позволит сравнить быструю экстубацию с обычной практикой, которая часто включает дальнейшее наблюдение и отложенное принятие решения из-за неуверенности врача в оптимальной стратегии управления проходимостью дыхательных путей. Включение групп обычной помощи продвигалось как конструктивная особенность для повышения безопасности и интерпретируемости клинических испытаний интенсивной терапии. Этикетка Arm Group: Обычный уход | ||||||||||||||||||||||||
| Приемлемость | Критерии: Критерии включения: — Возраст> 16 лет — Острая черепно-мозговая травма (субарахноидальное кровоизлияние, ишемический инсульт, спонтанный внутримозговое кровоизлияние, припадок, черепно-мозговая травма, опухоль головного мозга, глобальный церебральная аноксия / остановка сердца, менингит / энцефалит / церебральный абсцесс), произошло в течение предыдущих 4 недель. — Инвазивная ИВЛ через эндотрахеальную трубку в течение> 72 часов. — Оценка моторики по шкале комы Глазго от 3 до 6 с улучшением или без изменений по сравнению с предыдущим днем — прошел пробу спонтанного дыхания (SBT) Критерий исключения: — Предыдущая экстубация во время госпитализации в ОИТ — парализованный — нервно-мышечное заболевание, в результате которого потребуется длительная искусственная вентиляция легких, включая, помимо прочего, синдром Гийена-Барре, травму шейного отдела спинного мозга, распространенный рассеянный склероз — Приказ Do-Not-Reintubate на месте — Ранее рандомизировано в этом исследовании — Основное ранее существовавшее заболевание с ожидаемой летальностью менее 6 месяцев. — Предполагаемые / запланированные хирургические процедуры в течение 48 часов — C-позвоночник еще не очищен для активности в соответствии с переносимостью (разрешен для активности в соответствии с переносимостью) при ношении жесткого воротника допустимо) — В настоящее время известно или подозревается наличие затрудненного дыхания — Отсутствие утечки из манжеты эндотрахеальной трубки, если проверено — Отсутствие спонтанного или индуцированного кашля — Текущее участие в РКИ, исключающее совместное участие NEURO-ETT Пол: Все Минимальный возраст: 16 лет Максимальный возраст: Нет данных Здоровые волонтеры: Нет | ||||||||||||||||||||||||
| Общий Официальный | |||||||||||||||||||||||||
| Расположение |
| ||||||||||||||||||||||||
| Расположение Страны | Канада | ||||||||||||||||||||||||
| Дата проверки | Февраль 2020 г. | ||||||||||||||||||||||||
| Ответственная сторона | Тип: Главный следователь Принадлежность следователя: Саннибрук Центр медицинских наук ФИО следователя: Dr. Damon Scales Должность следователя: MD, PhD, FRCPC | ||||||||||||||||||||||||
| Ключевые слова | |||||||||||||||||||||||||
| Имеет расширенный доступ | Нет | ||||||||||||||||||||||||
| Состояние Просмотр | |||||||||||||||||||||||||
| Количество рук | 2 | ||||||||||||||||||||||||
| Группа вооружений | Метка: Экстубация Тип: Активный компаратор Описание: Экстубация путем удаления эндотрахеальной трубки. Метка: Обычный уход Тип: Активный компаратор Описание: Обычной клинической практикой является удаление эндотрахеальной трубки (экстубация) или установка трахеостомы, время проведения которой определяется по усмотрению врача. | ||||||||||||||||||||||||
| Акроним | NEURO-ETT | ||||||||||||||||||||||||
| Данные пациента | Нет | ||||||||||||||||||||||||
| Информация о дизайне исследования | Распределение: Рандомизированный Модель вмешательства: Параллельное присвоение Первичное назначение: Исследования служб здравоохранения Маскировка: Один (оценщик результатов) | ||||||||||||||||||||||||
Объяснение экстубации
Экстубация — это когда врач вынимает трубку, которая помогает вам дышать.
Иногда из-за болезни, травмы или операции вам нужно помочь дышать. Ваш врач или анестезиолог (врач, который «усыпляет» вас перед операцией) вводит трубку (эндотрахеальную трубку или ЭТТ) вам в горло и в трахею. Это помогает воздуху попадать в легкие и выходить из них. Процесс называется интубацией. Экстубация вынимает трубку.
Когда доктор его удаляет?
Лекарства, которые усыпляют вас во время операции (общая анестезия), также могут задерживать ваше дыхание.Вот почему иногда вам в первую очередь нужна ЕТТ. Но трубка неудобная, и она вам не нужна, если вы можете дышать самостоятельно. Обычно это происходит, когда вы начинаете просыпаться. Если вы бодрствуете, можете сильно кашлять и в легких не так много слизи, ваш врач спланирует экстубацию.
При необходимости вам дадут лекарство, чтобы обратить вспять действие любых лекарств, которые они использовали для паралича ваших мышц. Возможно, они использовали их, чтобы облегчить путь, когда вставляли трубку.
Продолжение
Они проверит, что вы можете вдыхать достаточно воздуха с каждым вдохом.Они также позаботятся о том, чтобы ваши рефлексы были достаточно сильными, чтобы защитить дыхательные пути от пищи или другого мусора. Это особенно верно, если вам сделали экстренную операцию, потому что у вас может быть пища в желудке.
Если вы перенесли ЭТТ из-за болезни или травмы, она может быть на месте в течение нескольких недель. Вы можете бодрствовать, когда используете его. В этих случаях персонал больницы часто проводит более сложные тесты и испытания, прежде чем решит, что можно безопасно удалить его навсегда. Это потому, что если вы не можете дышать самостоятельно, это может привести к серьезным последствиям, включая повреждение мозга и смерть.
Как снимается трубка?
Как только врач убедится, что удаление ЭТТ безопасно, его довольно просто удалить.
Врач снимет липкую ленту и убедится, что ваши дыхательные пути свободны. Небольшой всасывающий инструмент уберет весь мусор в этом месте. Они быстро сдувают небольшую «манжету», встроенную в ETT, которая помогает удерживать ее на месте. Затем врач обычно говорит вам сделать глубокий вдох, а затем выдохнуть или покашлять, и осторожно вытащит трубку.Это поможет вам безопасно кашлять любой мусор в рот, а не вдыхать его в легкие.
Управление экстубацией и периодом после экстубации в отделении интенсивной терапии
ВВЕДЕНИЕ
Процесс отлучения от инвазивной механической вентиляции (IMV), включая прекращение IMV и удаление эндотрахеальной трубки или трахеостомы из дыхательных путей пациента, является неотъемлемым этапом ведения пациента в отделении интенсивной терапии (ICU). Рекомендации по оптимальным стратегиям и срокам отлучения различаются, и этот процесс сопряжен с потенциальными осложнениями.Неудача экстубации, возможно, является наиболее серьезным осложнением отлучения от груди и определяется как необходимость повторной интубации в течение 48-часового периода после первоначального удаления пациента из IMV. 1 Неудача экстубации связана с рядом неблагоприятных исходов, связанных со здоровьем, и поэтому имеет большое значение как для медицинских работников, так и для пациентов.
Несмотря на многочисленные достижения в области интенсивной терапии в последние годы, частота неудач при экстубации за последнее десятилетие оставалась относительно неизменной: ≤25% пациентов, экстубированных в отделениях интенсивной терапии, требовали повторной интубации в течение 48 часов. 2 Широко известно, что повторная интубация вследствие респираторной недостаточности после экстубации связана с несколькими неблагоприятными исходами, включая увеличение продолжительности пребывания в больнице и смертность. 3,4 Эти риски, однако, должны быть сбалансированы с рисками, связанными с продолжительными и продолжительными IMV, которые, в свою очередь, могут быть связаны со значительными осложнениями. 5
Было изучено несколько подходов для улучшения процесса отлучения от IMV путем облегчения успешного перехода от IMV к спонтанной вентиляции.Они варьируются от тщательного отбора пациентов до поддерживающего лечения для минимизации риска неудач после экстубации. В этой статье мы рассмотрим современные данные, лежащие в основе этих стратегий, и обсудим проблемы, с которыми приходится сталкиваться при экстубации пациентов в отделении интенсивной терапии.
КОГДА ЭКСТУБИРОВАТЬ
Не подлежит сомнению, что в острых случаях необходимы как интубация, так и IMV, а также меры по спасению жизни, которые являются основой оказания помощи тяжелобольным пациентам. 6 Однако также хорошо задокументировано, что длительная IMV связана с рядом неблагоприятных исходов, включая пневмонию, связанную с аппаратом искусственной вентиляции легких, слабость, приобретенную в отделении интенсивной терапии, и увеличенную продолжительность пребывания в больнице. 5,7 Было предложено несколько этапов механической вентиляции легких (рис. 1), при этом процесс отлучения начинается после устранения причины преципитации, которая привела к интубации. 1 Отлучение от груди включает в себя путешествие пациента от начала уменьшения поддержки аппарата ИВЛ до удаления эндотрахеальной трубки. 8
Этот переход от IMV к самопроизвольному дыханию в группе интенсивной терапии часто бывает сложным с множеством смешивающих факторов, которые следует учитывать. 9 и значительно отличается от процесса бодрствования и экстубации после общей анестезии при хирургических процедурах.Пациенты, рано начинающие процесс отлучения от груди и быстро экстубирующие, имеют более низкие показатели смертности и заболеваемости. 5 Несмотря на осведомленность об этом, отлучение от IMV в отделениях интенсивной терапии часто откладывается, что увеличивает риск осложнений у пациента, а также стоимость и нагрузку на и без того ограниченные ресурсы здравоохранения. 1,5,10 Обоснование того, что отлучение от груди в отделении интенсивной терапии часто можно начинать раньше, подтверждается выводами Epstein et al., 11 , которые обнаружили, что ≤50% пациентов, случайно экстубированных в отделении интенсивной терапии, не нуждались в последующем реинтубация.
Несмотря на наличие нескольких исследований, сравнивающих различные методы отлучения, реального консенсуса относительно оптимального метода отлучения не существует. Некоторые авторы рекомендуют постепенное снижение поддержки давлением (PS) 12 в течение периода времени, пока пациенты не достигнут точки комфорта при небольшом количестве PS или вообще без него; другие исследования показывают, что ежедневные попытки спонтанного дыхания (SBT) (часто через тройник) столь же эффективны. 13,14 Возможно, наибольшее значение при столкновении с такой сложной клинической проблемой имеет мультидисциплинарный командный подход.Считается, что включение медперсонала, физиотерапевтов и специалистов в процесс реабилитации для оказания помощи в оказании помощи с разных точек зрения положительно влияет на клинические исходы пациентов, отлученных от груди. 15 Тщательная оценка, последовательность на практике, соблюдение принципов передовой практики, установленные пакеты услуг, такие как профилактика пневмонии, связанной с вентилятором, и учет индивидуального ухода за каждым пациентом — все это важные элементы при планировании стратегии отлучения. 9
Освобождение от искусственной вентиляции легких в процессе экстубации, возможно, является ключевым событием в процессе отлучения и должно выполняться на достаточно ранней стадии, чтобы ограничить риски длительной IMV, но не на столь ранней стадии, чтобы увеличить риск неудачной экстубации и всех связанных с ней заболеваний. сопутствующие осложнения. Таким образом, жизненно важно, чтобы клиницисты рассмотрели большое количество клинических факторов и факторов пациента, прежде чем принимать решение о проведении экстубации. Это решение включает оценку способности пациентов к спонтанному дыханию и рассмотрение других факторов, таких как, как и когда проводить экстубацию, возможность затруднения дыхательных путей в случае неудачной экстубации и какие вмешательства могут быть доступны для предотвращения опасных для жизни осложнений. .Несмотря на то, что это в основном относится к практике анестезии, со стороны реаниматолога было бы наивно игнорировать руководство Общества по трудным дыхательным путям 16 по экстубации, которое имеет отношение к практике интенсивной терапии. В этом руководстве освещаются вопросы, которые можно легко упустить из виду, включая оценку предшествующей трудности проходимости дыхательных путей и оптимизацию факторов, не связанных с пациентом, включая местоположение, присутствие квалифицированного персонала и наличие оборудования для дыхательных путей экстренной помощи, такого как катетеры для воздухообмена и ларингеальная маска. дыхательные пути.Положение пациента также важно, при этом предпочтительнее полувертикальное положение для облегчения самостоятельного дыхания и относительной легкости повторной интубации, если это необходимо. 16,17 Четвертый национальный аудиторский проект (NAP4) Королевского колледжа анестезиологов 18 выделил интенсивную терапию как область высокого риска неблагоприятных событий со стороны дыхательных путей, с плохой идентификацией пациентов из группы риска, недостаточным планированием и неадекватностью квалифицированный персонал сообщил о причинах таких событий. Поэтому крайне важно, чтобы лица, участвующие в процессе экстубации, были полностью осведомлены о потенциальных проблемах управления проходимостью дыхательных путей и прошли соответствующее обучение. 16
В современной практике интенсивной терапии произошел отход от выполнения ранней трахеостомии, чтобы облегчить более быстрое отлучение от груди, на основе результатов нескольких крупных и надежных исследований, 19,20 , и поэтому эта процедура становится все менее распространенной. у пациентов, находящихся на ИВЛ менее 10 дней. Тем не менее, остается когорта пациентов с интенсивной терапией, включая пациентов с известной обструкцией верхних дыхательных путей или неврологическими состояниями, приводящими к длительной бульбарной дисфункции, у которых ранняя трахеостомия без попытки экстубации может быть полезной.Это предотвращает подверженность пациентов, у которых успешная экстубация маловероятна, к часто значительным рискам, связанным с неудачной экстубацией.
Показатели силы и емкости дыхательной мускулатуры, такие как индекс быстрого поверхностного дыхания (RSBI) и максимальное давление на вдохе, противоречиво коррелируют со способностью пациента успешно экстубировать. Кроме того, было продемонстрировано, что индивидуальная оценка врача имеет низкую чувствительность и специфичность в прогнозировании успеха. 5 Таким образом, в настоящее время предпочтительным подходом является проведение SBT продолжительностью от 30 минут до 2 часов и оценка клинической реакции пациента в течение этого периода. Во время SBT пациент дышит с небольшим вдохом или без него, используя PS 5–8 cmH 2 0 PS или тройник, присоединенный к контуру вентилятора. 6 Опять же, нет четкого консенсуса относительно наиболее подходящего режима или продолжительности SBT; 6 , однако, было высказано предположение, что применение дополнительного инспираторного PS дает большую достоверность в SBT из-за его более реалистичного сходства со спонтанным дыханием.Более того, исследования показали, что большинство неудач SBT происходит в течение 30 минут, 21,22 , что позволяет предположить, что успешная SBT в течение 30 минут является таким же хорошим показателем успешной экстубации, как и один из 120 минут. Отказ SBT обычно определяется наличием ухудшения физиологических параметров, таких как тахикардия, тахипноэ, гипертония, возбуждение и беспокойство, 8 или ухудшение газообмена или параметров вентиляции, 12,13 , и следует соблюдать периодом стабилизации состояния пациента при усиленной поддержке аппарата ИВЛ перед рассмотрением вопроса о дальнейшей SBT.
Недавний систематический обзор, проведенный Американским колледжем грудных врачей (ACCP) и Американским торакальным обществом (ATS), 6 , пришел к выводу, что для пациентов, находящихся на ИВЛ в течение> 24 часов, SBT с PS 5-8 смH 2 0, а не исследование тройника, повысило эффективность SBT и последующей экстубации и, таким образом, может представлять собой разумный подход к оценке готовности к экстубации.
ПРОГНОЗЫ УСПЕХА И НЕИСПРАВНОСТИ
Несмотря на тщательное обследование пациентов с ежедневной седацией и SBT, неэффективность экстубации остается серьезной проблемой, при этом частота повторной интубации остается на уровне 25%. 23 Это означает, что только SBT не является единственным соображением при принятии решения о экстубации, и не менее важно попытаться идентифицировать пациентов с высоким риском неудачной экстубации до прекращения IMV. К сожалению, это остается трудным клиническим решением, поскольку нет доступного теста для точного воссоздания условий после экстубации. 3,4 Клиницисты должны стремиться сбалансировать риск отсроченной экстубации и преждевременной экстубации, оба из которых связаны со значительным увеличением неблагоприятных исходов, 24 и стараться использовать как можно больше информации, касающейся риска неудачной экстубации. в своих пациентах, чтобы направлять принятие решений. 25
Многие исторические исследования, изучающие неэффективность экстубации, были небольшими одноцентровыми исследованиями с участием лиц с низким риском, что снижает достоверность их результатов в применении к более широкой популяции ОИТ. 3 Исследование 2006 г. 4 , изучающее факторы риска неудачной экстубации после успешной SBT, показало, что частота неудач экстубации у тех, кто прошла SBT, составила 13,4%, что соответствует ранее задокументированным данным. Работа дыхания, гипоксия, респираторный ацидоз, задержка секреции, снижение уровня сознания и гипотензия были отмечены как факторы риска повторной интубации в этом исследовании.Хотя это заслуживающая внимания и полезная информация, остается вопрос, насколько такие факторы риска можно изменить или предотвратить в клинической практике и в какой степени эти проблемы можно лечить до того, как произойдет неэффективность экстубации.
Широко признано, что положительный баланс жидкости отрицательно влияет на успех экстубации; открытие, подтвержденное исследованиями, предполагающими, что пациенты с застойной сердечной недостаточностью имеют более высокую частоту повторной интубации. 26-28 Кроме того, положительный баланс жидкости связан с более длительными периодами IMV 29 и, следовательно, может усугублять повышенный риск неудачной экстубации с повышенной заболеваемостью и смертностью, которые возникают на фоне длительной механической вентиляции.Уровень натрийуретического пептида B-типа недавно был связан с продолжительностью отлучения от груди. Повышенные уровни натрийуретического пептида B-типа при SBT могут предсказывать неэффективность экстубации 30 и, таким образом, потенциально могут использоваться для исключения сердечной дисфункции как источника отлучения от груди и неэффективности экстубации.
Обструкция или отек верхних дыхательных путей также является важной причиной неэффективности экстубации, особенно у тех пациентов, которые успешно прошли SBT и, по-видимому, имеют адекватную механику дыхания, при этом в одном исследовании проходимость дыхательных путей указывается как прямая причина неэффективности экстубации в ≤38. % пациентов. 31 При наличии отрицательного результата теста на утечку из манжеты введение стероидов может снизить распространенность стридора и снизить частоту повторной интубации 32 и, таким образом, должно рассматриваться у всех пациентов, подвергающихся экстубации с клиническими признаками отека верхних дыхательных путей. Продолжительность предлагаемых стероидных режимов в литературе варьируется, хотя большой метаанализ 14 исследований 33 показал, что стероиды следует вводить за ≥12 часов до экстубации и в течение ≤24 часов после нее.Если существуют опасения относительно проходимости дыхательных путей без эндотрахеальной трубки или трахеостомии in situ , пытаться экстубировать не следует, и следует запросить мнение хирурга уха, носа и горла.
RSBI был тщательно изучен в отношении неудачной экстубации, при этом несколько исследований подтвердили его надежность как предиктора неудачной экстубации. 34 Одно исследование пришло к выводу, что RSBI> 105 является независимым фактором риска неудачной экстубации, при этом частота повторной интубации увеличивается с 11% до 18%. 4 Таким образом, кажется разумным измерить RSBI, где это возможно, до принятия решения относительно экстубации пациентов, но также важно учитывать, что, хотя RSBI может быть надежным индикатором способности дыхательной мышцы, он не дает никакой оценки. проблем с дыхательными путями, указанных выше, и не должны использоваться изолированно в качестве маркера пригодности для экстубации.
Факторы риска, устойчивые к модификации, такие как возраст, пневмония (как причина искусственной вентиляции легких), уровень сознания, сердечно-сосудистые заболевания и респираторные заболевания, 35,36 не могут быть параметрами, на которые может повлиять или изменить клиническая помощь, но остаются важными факторами в принятии клинических решений.Распознавание этих факторов позволяет на раннем этапе идентифицировать пациентов с высоким риском неудачной экстубации и, таким образом, позволяет клиницистам уделять больше внимания и ресурсов пациентам в период экстубации для достижения наилучших возможных результатов для пациентов.
К другим факторам риска, менее уверенно связанным с неудачей экстубации, относятся сила кашля, секреционная нагрузка, наличие делирия и полиневромиопатия, приобретенная в отделении интенсивной терапии. Эти факторы имеют ограниченные и несколько противоречивые доказательства связи, и необходимы дальнейшие исследования, чтобы определить их прогностическую ценность при неудачной экстубации. 37,38 Сводная информация о факторах риска неэффективности экстубации и сила подтверждающих доказательств показаны на Рисунке 2.
ПАЦИЕНТЫ ВЫСОКОГО РИСКА И НЕИНВАЗИВНАЯ ВЕНТИЛЯЦИЯ
После выявления пациентов с высоким риском неэффективности экстубации необходимо принять меры для предотвращения осложнений в постэкстубационном периоде. Неинвазивная вентиляция (НИВ) может использоваться для обеспечения респираторной поддержки без необходимости интубации трахеи у широкого круга недавно экстубированных пациентов. 39 Это может быть в форме постоянного положительного давления в дыхательных путях или неинвазивной вентиляции с положительным давлением. Его использование в период после экстубации подразделяется на три отдельные группы пациентов, которые будут рассмотрены отдельно; а именно, как помощь при ранней экстубации, как профилактическая мера при экстубации с высоким риском и, наконец, как лечение респираторного дистресса после экстубации. 40
Было продемонстрировано, что ранняя экстубация и переход к НИВ для продолжения отлучения от пациентов, у которых не удалось провести СБТ, но которые подходят для отлучения от груди, сокращают продолжительность времени ВИМ и риски, связанные с продолжением ВМИ в выбранных группах пациентов. 41 Этот эффект, по-видимому, наиболее заметен у пациентов с хронической обструктивной болезнью легких (ХОБЛ) и был воспроизведен в нескольких рандомизированных контролируемых исследованиях и метаанализах. 42,43 Большое многоцентровое исследование Girault et al. 44 , набранных из более общей популяции пациентов ОИТ, не обнаружили существенной разницы в частоте повторной интубации между пациентами, экстубированными на ранней стадии НИВ, по сравнению с традиционным отлучением, при этом время, проведенное в фазе отлучения, увеличилось в группе НИВ.Было высказано предположение, что использование НИВ таким образом в настоящее время не рекомендуется для общей популяции ОИТ, но может быть подходящим курсом действий у пациентов с хроническим респираторным заболеванием, что подтверждается недавними рекомендациями Британского торакального общества (BTS), как стратегия отлучения пациентов с известной ХОБЛ. 45
Профилактическое использование НИВ после экстубации широко изучалось у пациентов с высоким риском неудачной экстубации. В ряде исследований было продемонстрировано, что это значительно снижает частоту повторной интубации при использовании до начала постэкстубационного респираторного дистресса. 23,46,47 ACCP, ATS, 6 и BTS 45 — все представляют сопоставимые рекомендации, в которых говорится, что пациенты, получающие искусственную вентиляцию легких в течение более 24 часов и подверженные высокому риску неэффективности экстубации, должны получать профилактическую НИВ сразу после экстубации. . Хотя существуют некоторые дебаты относительно того, что на самом деле представляет собой высокий риск неэффективности экстубации, 48 с несколькими различными определениями, используемыми в различных исследованиях, существует общий консенсус по ряду факторов, которые требуют профилактического вмешательства после экстубации НИВ: курение, возраст > 65 лет, респираторные или сердечно-сосудистые заболевания, слабый кашель. 23
НИВЛ при острой респираторной недостаточности, вызванной такими патологиями, как обострения ХОБЛ 49 и отек легких 50 , является общепринятым лечением, которое может предотвратить необходимость в искусственной вентиляции легких. Однако использование НИВ при лечении постэкстубационной респираторной недостаточности оказалось неэффективным и потенциально вредным. Было высказано предположение, что НИВ, используемые в этой ситуации, могут привести к задержке повторной интубации после возникновения респираторного нарушения, что, в свою очередь, может увеличить заболеваемость и смертность пациентов; 51 как таковой, его использование не поддерживается в этой настройке.
НАСАЛЬНАЯ КИСЛОРОДНАЯ ТЕРАПИЯ ВЫСОКОПРОИЗВОДСТВЕННОЙ ЭКСТУБАЦИИ ПОСЛЕ ЭКСТУБАЦИИ
После экстубации обычным методом предотвращения гипоксии является применение контролируемой кислородной терапии (COT), обычно через лицевую маску, при которой доля вдыхаемого кислорода нацелена на физиологический параметр. Кислород лицевой маски, однако, может быть обременительным и связан с различными уровнями доставки кислорода в зависимости от пикового вдоха пользователя. Кроме того, высыхание слизистой оболочки может происходить из-за недостаточного увлажнения, 52 увеличивая риск неудачи экстубации из-за задержки секреции.Назальная кислородная терапия с высоким потоком (HFNOT) — относительно новая разработка для взрослых, предлагающая увлажненный, подогретый кислород со скоростью потока ≤60 л / мин. 53 Это может быть полезно для недавно экстубированных пациентов, обеспечивая более точные концентрации кислорода, создавая положительное давление в конце выдоха и улучшая газообмен. 54
В нескольких исследованиях изучалось использование HFNOT в популяциях после экстубации в ОИТ. Maggiore et al. 53 сообщили об улучшении оксигенации и меньшем количестве десатурации по сравнению с COT, возможно, из-за улучшенной переносимости пациентом системы назальной доставки и незначительной тенденции к снижению частоты повторной интубации.Эрнандес и др. 55 пришли к выводу, что пациенты из группы низкого риска, получавшие HFNOT, имели более низкую частоту повторной интубации и реже развивалась постэкстубационная респираторная недостаточность по сравнению с пациентами, получавшими COT. В более позднем исследовании 56 , преждевременно прекращенном из-за проблем с набором, не было обнаружено значительных различий в частоте респираторной недостаточности после экстубации, времени до дыхательной недостаточности или продолжительности пребывания в ОИТ и больнице с HFNOT.
Недавно опубликованный метаанализ, изучающий роль повторной интубации у пациентов после экстубации, показал, что HFNOT более эффективен для предотвращения повторной интубации, чем COT 57 , и может быть таким же эффективным, как NIV в этих условиях, но без побочных эффектов и проблем с переносимостью пациента, которые может препятствовать эффективной доставке НИВ.Важно отметить, что в одном из более крупных исследований в пуле данных были исключены группы пациентов, которые, как известно, хорошо реагировали на постэкстубационные НИВЛ, такие как пациенты с ХОБЛ и кардиогенным отеком легких; таким образом, влияние NIV могло быть недооценено в этом исследовании.
Использование HFNOT у пациентов после экстубации является многообещающим развитием, особенно у тех пациентов, у которых риск развития неэффективности экстубации низкий или у которых непереносимость НИВ может быть проблемой. Точная роль HFNOT и то, как его можно использовать вместе с NIV для достижения оптимальных клинических результатов, требует дальнейшего уточнения, и в этой важной области необходимы надежные испытания.
ЗАКЛЮЧЕНИЕ
Несмотря на многие недавние достижения в практике интенсивной терапии, оптимальное ведение экстубации остается серьезной проблемой для медицинских работников и несет значительную долю заболеваемости и смертности в случае неудачной экстубации. Некоторые стратегии отлучения хорошо описаны в литературе, при этом организованный подход и последовательность на практике кажутся более важными, чем используемый метод отлучения. Хотя описан ряд факторов, которые могут предсказать неудачу экстубации, некоторые из них можно легко изменить, и не существует единого мнения, которое помогло бы клиницистам выбрать, когда именно проводить экстубацию.
Существует ряд вмешательств для поддержки пациентов, недавно подвергшихся экстубации, и, в частности, своевременное применение НИВ может быть очень полезным, особенно у пациентов с хроническим заболеванием легких или при наличии факторов риска неэффективности экстубации. Также растет интерес к использованию HFNOT у пациентов с низким риском, и эта терапия может сыграть полезную роль в тщательно отобранных популяциях после экстубации.
Из литературы очевидно, что тщательное планирование и оценка на каждом этапе прохождения пациента через отделение интенсивной терапии, от подхода организованной многопрофильной команды к отлучению от груди, до предоставления подходящей респираторной поддержки после экстубации, необходимы для достижения наилучшего результата. возможные исходы в этой сложной группе пациентов.Необходима дальнейшая работа для более четкого определения и стратификации риска экстубации для пациентов в отделении интенсивной терапии и определения того, какие стратегии лечения следует использовать наиболее эффективно для улучшения результатов лечения пациентов в этой сложной области современной практики.
Что такое интубация и почему она проводится?
Интубация — это процесс введения трубки, называемой эндотрахеальной трубкой (ЭТ), через рот и затем в дыхательные пути. Это делается для того, чтобы пациента можно было подключить к аппарату искусственной вентиляции легких, чтобы облегчить дыхание во время анестезии, седативных средств или тяжелого заболевания.Затем трубка соединяется с вентилятором, который нагнетает воздух в легкие, чтобы вдохнуть в пациента.
Интубация проводится потому, что пациент не может поддерживать проходимость дыхательных путей, не может дышать самостоятельно без посторонней помощи или и то, и другое. Они могут находиться под наркозом и не смогут самостоятельно дышать во время операции, или они могут быть слишком больны или травмированы, чтобы обеспечить организм достаточным количеством кислорода без посторонней помощи.
Иллюстрация Джошуа Сонга. © Verywell, 2017.
Цель интубации
При общей анестезии требуется интубация. Анестезирующие препараты парализуют мышцы тела, в том числе диафрагму, из-за чего невозможно дышать без аппарата ИВЛ.
Большинство пациентов экстубируются, то есть дыхательная трубка удаляется сразу после операции. Если пациент очень болен или ему трудно дышать самостоятельно, он может оставаться на аппарате ИВЛ в течение более длительного периода времени.
После большинства процедур назначают лекарство, чтобы обратить вспять эффекты анестезии, что позволяет пациенту быстро проснуться и начать дышать самостоятельно.
Для некоторых процедур, таких как процедуры на открытом сердце, пациенту не вводят лекарство от анестезии, и он медленно просыпается самостоятельно. Этим пациентам необходимо будет оставаться на аппарате ИВЛ до тех пор, пока они не проснутся достаточно, чтобы защитить свои дыхательные пути и самостоятельно дышать.
Интубация также проводится при дыхательной недостаточности. Есть много причин, по которым пациент может быть слишком болен, чтобы дышать самостоятельно. У них может быть травма легких, у них может быть тяжелая пневмония или проблемы с дыханием, такие как ХОБЛ.Взаимодействие с другими людьми
Если пациент не может самостоятельно получать достаточно кислорода, может потребоваться вентилятор, пока он снова не станет достаточно сильным, чтобы дышать без посторонней помощи.
Риски интубации
Хотя большинство операций сопряжены с очень низким риском, а интубация — также с низким риском, могут возникнуть некоторые потенциальные проблемы, особенно когда пациенту необходимо оставаться на аппарате ИВЛ в течение длительного периода времени. Общие риски включают:
- Травма зубов, рта, языка и / или гортани
- Случайная интубация в пищевод (пищевая трубка) вместо трахеи (воздушная трубка)
- Травма трахеи
- Кровотечение
- Невозможность отлучения от аппарата ИВЛ, требующая трахеостомии.
- Аспирация (вдыхание) рвоты, слюны или других жидкостей при интубации
- Пневмония при аспирации
- Боль в горле
- Охриплость
- Эрозия мягких тканей (при длительной интубации)
Медицинская бригада будет оценивать и осознавать эти потенциальные риски и делать все возможное для их устранения.
Процедура интубации
Перед интубацией пациент обычно находится в седативном состоянии или теряет сознание из-за болезни или травмы, что позволяет рту и дыхательным путям расслабиться.Пациент обычно лежит на спине, а человек, вводящий трубку, стоит у изголовья кровати, глядя на ноги пациента.
Рот пациента осторожно открывается и с помощью прибора с подсветкой, чтобы не мешать языку и освещать горло, трубку осторожно вводят в горло и продвигают в дыхательные пути.
Вокруг трубки есть небольшой воздушный шар, который надувается, чтобы удерживать трубку на месте и не допускать выхода воздуха. Как только этот баллон надувается, трубка надежно устанавливается в дыхательных путях и привязывается к рту.
Успешность установки сначала проверяется путем прослушивания легких с помощью стетоскопа и часто подтверждается рентгенологическим исследованием грудной клетки. В полевых условиях или в операционной для подтверждения правильности установки используется устройство, измеряющее углекислый газ, который будет присутствовать только в том случае, если трубка находится в легких, а не в пищеводе.
Назальная интубация
В некоторых случаях, если рот или горло оперировали или были травмированы, дыхательная трубка проходит через нос, а не через рот, что называется назальной интубацией.
Назотрахеальная трубка (NT) входит в нос, вниз по задней стенке глотки и в верхние дыхательные пути. Это делается для того, чтобы рот оставался пустым и можно было провести операцию.
Этот тип интубации встречается реже, так как обычно легче интубировать, используя большее отверстие для рта, и потому, что для большинства это просто не требуется.
Педиатрическая интубация
Процесс интубации одинаков для взрослых и детей, за исключением размера оборудования, которое используется во время этого процесса.Маленькому ребенку требуется трубка гораздо меньшего размера, чем взрослому, и установка трубки может потребовать более высокой степени точности, поскольку дыхательные пути намного меньше.
В некоторых случаях для облегчения интубации используется оптоволоконный зонд — инструмент, который позволяет человеку, вставившему дыхательную трубку, наблюдать за процессом на мониторе.
Фактический процесс установки трубки для взрослых практически такой же, как и для детей старшего возраста, но для новорожденных и младенцев предпочтительнее назальная интубация.Подготовка ребенка к операции сильно отличается от подготовки взрослых.
В то время как у взрослого могут возникнуть вопросы о страховом покрытии, рисках, льготах и сроках восстановления, ребенку потребуется другое объяснение процесса, который должен произойти. Необходима уверенность, а эмоциональная подготовка к операции будет зависеть от возраста пациента.
Кормление во время интубации
Пациенту, который будет находиться на аппарате ИВЛ во время процедуры, а затем экстубирован после завершения процедуры, не потребуется кормление, но он может получать жидкости через капельницу.Если ожидается, что пациент будет зависеть от аппарата ИВЛ в течение двух или более дней, кормление обычно начинают через день или два после интубации.
Невозможно принимать пищу или жидкости через рот во время интубации, по крайней мере, не так, как это обычно делается при откусывании, жевании и затем глотании.
Чтобы можно было безопасно принимать пищу, лекарства и жидкости через рот, в глотку вводят трубку, которая опускается в желудок. Эта трубка называется орогастральной (OG), когда она вводится в рот, или назогастральным зондом (NG), когда вводится в нос и опускается в глотку.Затем лекарства, жидкости и питание через зонд вводятся через зонд в желудок с помощью большого шприца или насоса.
Другим пациентам пищу, жидкости и лекарства следует вводить внутривенно. Внутривенное кормление, называемое TPA или полное парентеральное питание, обеспечивает питание и калории непосредственно в кровоток в жидкой форме. Этого типа кормления обычно избегают без крайней необходимости, так как пища лучше всего всасывается через кишечник.
Удаление дыхательной трубки
Трубку снять намного легче, чем поставить.Когда пора снимать трубку. сначала необходимо удалить стяжки или ленту, которые удерживают его на месте. Затем баллон, удерживающий трубку в дыхательных путях, сдувается, чтобы трубку можно было осторожно вытащить. После того, как трубка вынута, пациенту придется самостоятельно дышать.
Не интубировать / не реанимировать
Некоторые пациенты заявляют о своих желаниях с помощью расширенной директивы — документа, в котором четко указываются их пожелания в отношении своего здоровья.Некоторые пациенты выбирают вариант «не интубировать», что означает, что они не хотят, чтобы их подключили к аппарату искусственной вентиляции легких для продления жизни. «Не реанимировать» означает, что пациент решает не проходить СЛР.
Пациент контролирует этот выбор, поэтому он может временно изменить этот выбор, чтобы ему могла быть сделана операция, требующая вентилятора. Но это обязательный юридический документ, который не может быть изменен другими при нормальных обстоятельствах.
Слово от Verywell
Необходимость интубации и помещения на аппарат искусственной вентиляции легких обычна при общей анестезии, что означает, что для большинства операций потребуется такой уход.Хотя страшно подумать о том, чтобы быть на ИВЛ, большинство хирургических пациентов дышат самостоятельно в течение нескольких минут после окончания операции.
Если вас беспокоит использование аппарата искусственной вентиляции легких во время операции, обязательно обсудите свои проблемы со своим хирургом или лицом, проводящим анестезию.
Руководства экспертов по интубации и экстубации пациента отделения интенсивной терапии Французского общества анестезии и интенсивной терапии (SFAR) и Франкоязычного общества интенсивной терапии (SRLF) | Annals of Intensive Care
Service de réanimation médico-chirurgicale, hôpital Pasteur 2, CHU de Nice, 30, voie Romaine, 06000, Nice, France
Hervé Quintard
Unité CNRS
, Sophia
Hervé Quintard
Réanimation Médicale, Centre Hospitalier Universitaire de Brest, La-Cavale-Blanche, 29609, Brest cedex, France
Erwan l’Her
Unitéde-réesicurgalesimation, служба хирургической анимации pôle anesthésie-réanimations chirurgicales, Samu-Smur, hôpital de Hautepierre, hôpitaux Universitaires de Strasbourg, 1, avenue Moliére, 67098, Strasbourg cedex, France
Julien Pottecher & Pierre Diemunsch
, Avienstecher & Pierre Diemunsch
de Stalingrad, 93009, Bobigny, France
Frédéric Adnet
EA 3509, UF recherche-enseignement-qualité, AP – HP, Université Paris 13, Sorbonne Paris Cité, 125, rue de Stalingrad, 93009, Bobigny, France
Frédéric Adnet
Периоперационное медицинское отделение, госпитальер де Клермон-Ферран, CHU Estaing, 1, rue Lucie Aubrac, 63100, Клермон-Ферран, Франция
Жан-Мишель Константин
Отделение анестезиологии и интенсивной терапии, больница Saint-Eloi, CHU de Montpellier, 80, avenue Augustin-Fliche, 34000, Монпелье, Франция
Audrey De Jong
d ‘anesthésie pédiatrique, hôpital d’enfants, 330, avenue de Grande-Bretagne TSA 70034, 31059, Toulouse cedex 9, France
Rose Fesseau
Kinésithérapie, réanimation Magellanésiepital, service d’anesiepitalis de Magellan, 33600, Пессак, Франция
Anne Freynet
Отделение интенсивной терапии, Университет Нормандии, Университетская больница Руана, 76000, Руан , Франция
Christophe Girault
UNIROUEN, EA-3830, Rouen, France
Christophe Girault
Service de réanimation médicale et USC, CHU de Nantes, 30, Boulevard Jeanx-93 France
Christophe Guitton
Service d’anesthésie réanimation 3, anesthésie pédiatrique, hôpital des Enfants, CHU de Bordeaux, place Amélie-Raba-Léon, 33000, Bordeaux, France
5 Yanon
,
,
5,
,
, Hamonic Service médicale, больница Saint-Antoine, Assistance Publique – hôpitaux de Paris, 184, rue du Faubourg Saint-Antoine, Université Pierre-et-
Мари Кюри, Париж, Франция
Эрик Мори
UMR S 1136, Inserm et Sorbonne Universités, UPMC Université Paris 06, 75012, Париж, Франция
Eric Maury
Service de réanimation heditaux Universités Mondor, AP – HP, DHU A-TVB, 94010, Créteil, France
Armand Mekontso-Dessap
Université Paris Est-Créteil, faculté de médecine de Créteil, institut Mondor de recherche birouédicale, g. 94010, Créteil, France
Armand Mekontso-Dessap
Service d’anesthésie réanimation pédiatrique, hôpital de la Timone, Assistance publique des Hôpitaux de Marseille, 264, rue Saint-Pierre de Marsede, 264, rue Saint-Pierre 9000, 13385, 13385 Michel
Service de pédiatrique, больница Enfants, CHU de Bordeaux, place Amélie-Raba-Léon, 33000, Bordeaux, France
Paul Nolent
Réanimation médico-chirurgicale, CHU Gabril-Montpied, CHU Clermont-Ferrand, 63100, Клермон-Ферран, Франция
Sébastien Perbet
Réanimation médico-chirurgicale, CHU-Blanchevardou, PôleU-Blanche, бульв. Brest cedex, Франция
Gwenael Prat
Отделение анестезиологии и интенсивной терапии, CHU de Nantes, 44093, Nantes cedex, France
Antoine Roquilly
Service des urgences Herri de Samu Lyon, 69003, Lyon, France
Karim Tazarourte
HESPER EA 7425, Université Claude-Bernard Lyon 1, University de Lyon, 69008, Lyon, France
Karim Tazarourte
Nicolas Terzi
Service de réanimation médicale, CHU de Grenoble Alpes, 38000, Гренобль, Франция
Николя Терзи
Réanimation médicale, CHU de Poitiers, Poitiers, France
Arnaud W.Thille
Inserm CIC 1402 ALIVE, Université de Poitiers, Poitiers, Франция
Arnaud W. Thille
Réanimation médico-chirurgicale, центральный госпитальер, межобщинный 10, Poissy Saint-Germain-en-Laye, Gaillard, 78300, Poissy, France
Mikael Alves
Отделение анестезии и интенсивной терапии, университет Сен-Луи – Ларибуазьер – Фернан-Видаль, Университет Париж Дидро, Assistance Publique – Hôpitaux de Paris
, Париж,
, Франция Etienne Gayat
Unite ‘942 «Биомаркер сердечно-сосудистых заболеваний» Inserm, Париж, Франция
Etienne Gayat
Service USIR-SRPR, Hospital de Forcilles, 771503000, DONTIROLLES, 9256000, Франция 9256000
Экстубация трахеиОбсуждение | Респираторная помощь
Abstract
Экстубация трахеи как в отделениях интенсивной терапии, так и в условиях анестезии является не только важной вехой для выздоровления пациента, но и процедурой, сопряженной со значительным риском осложнений или неудач.Механическая вентиляция легких связана со значительными осложнениями, которые зависят от времени по своей природе, с более длительной интубацией, что приводит к более высокой частоте осложнений, включая пневмонию, связанную с вентилятором, и увеличению смертности. Неудача экстубации и последующая повторная интубация связаны с общим увеличением продолжительности искусственной вентиляции легких, повышением смертности, большей потребностью в трахеостомии и более высокими медицинскими расходами. Эти риски требуют, чтобы процессом экстубации управляли практикующие врачи с детальным пониманием причин неудач экстубации и возможных осложнений.Предварительно разработанный план экстубации с учетом возможной необходимости повторной интубации имеет первостепенное значение.
Введение
Экстубация трахеи в условиях интенсивной терапии или анестезии является не только важной вехой для выздоровления пациента, но и процедурой, сопряженной со значительным риском осложнений или неудач. Искусственная вентиляция легких связана со значительными осложнениями, которые зависят от времени по своей природе, с более длительной интубацией, что приводит к более высокой частоте осложнений, включая вентилятор-ассоциированную пневмонию (ВАП), и повышению смертности. 1 Экстубация полезна тем, что устраняет дыхательную работу, создаваемую эндотрахеальной трубкой (ЭТТ), снижает риск ВАП, улучшает комфорт пациента и улучшает очищение дыхательных путей, обеспечивая эффективный кашель. 2 Однако неудачная экстубация и последующая повторная интубация связаны с общим увеличением продолжительности ИВЛ, повышением смертности, большей потребностью в трахеостомии и более высокими медицинскими расходами. 3
Анализ базы данных закрытых заявлений Американского общества анестезиологов (ASA) показал, что, хотя исходы, связанные с осложнениями дыхательных путей во время интубации, улучшались за последние 20 лет, этого нельзя сказать о экстубации. 4 Осложнения со стороны дыхательных путей при экстубации не ограничиваются США. Как было показано в недавнем Четвертом проекте национального аудита (NAP4) Королевского колледжа анестезиологов в Соединенном Королевстве, одна треть серьезных осложнений, связанных с обеспечением проходимости дыхательных путей, произошла при экстубации или в палате для восстановления, с уровнем смертности 5%. 5 Подобные данные привели к растущему признанию необходимости разработки стратегий безопасной и успешной экстубации.Таким образом, Общество трудных дыхательных путей (DAS) недавно опубликовало первые комплексные рекомендации по ведению экстубации трахеи в периоперационной практике взрослых. 6 Несмотря на то, что экстубация в отделении интенсивной терапии не рассматривается явно, принципы, изложенные в руководстве, применимы к экстубации в любых условиях.
Отказ экстубации
Успешная экстубация зависит от двух факторов: способности переносить спонтанное дыхание без искусственной вентиляции легких и способности поддерживать проходимость дыхательных путей после удаления ЭТТ. 7,8 Неудача экстубации часто определяется как необходимость повторной интубации в течение 24–72 часов после запланированной экстубации 8 ; однако это определение не делает различий между двумя основными типами отказов. Поэтому все чаще термин «неудача при экстубации» используется для обозначения «неспособности перенести удаление транслярингеальной трубки», 7,8 , тогда как отказ от отлучения от груди или высвобождения используется для обозначения неспособности переносить спонтанную вентиляцию без механической поддержки. . 7,9
Частота экстубации и неэффективности высвобождения варьируется в зависимости от клинических условий и факторов пациента. В общем, повторная интубация после общей анестезии при плановых операциях относительно редко, с зарегистрированной частотой 0,1–0,45%. 7 Наиболее частые причины повторной интубации включают дыхательную недостаточность, обструкцию дыхательных путей, бронхоспазм, остаточную нервно-мышечную блокаду, остаточные эффекты седативных средств / опиоидов и агрессивное введение жидкости. 7 В отделениях интенсивной терапии, где пациенты проходят искусственную вентиляцию легких после выздоровления после острой дыхательной недостаточности, повторная интубация, как ожидается, более распространена, с частотой 2–25%. 9 Неудача экстубации и высвобождения часто связана в популяции ОИТ 7 и может быть результатом обструкции верхних дыхательных путей, избыточной секреции, неспособности защитить дыхательные пути, сопутствующей недостаточности других систем органов или дисбаланса между работой дыхательная и респираторная мускулатура. 9 Как в отделении интенсивной терапии, так и после анестезии повторная интубация после неудачной экстубации обычно происходит в течение 2 часов после экстубации и редко — через 24 часа. 7
Данные проекта ASA Closed Claims Project и NAP4 указывают на то, что, хотя неэффективность экстубации в ближайшем послеоперационном периоде встречается редко, особенно при плановой хирургии, последствия серьезны, с более высокими показателями смертности и повреждений головного мозга, чем во время других фаз анестезии. 4,5,7 Отчет NAP4 показал уровень смертности 5% и уровень 13% для тяжелых исходов с неэффективностью экстубации, связанной с общей анестезией. 5 Аналогичным образом, в условиях интенсивной терапии необходимость повторной интубации связана с увеличением продолжительности ИВЛ и повышенной смертностью (до 50%). 8,10 Хотя некоторая часть этой связи может быть объяснена тем фактом, что пациенты, которым требуется повторная интубация, с большей вероятностью будут иметь сопутствующие заболевания, которые независимо увеличивают риск смерти, большинство исследований, которые корректируют тяжесть заболевания и частоту сопутствующих заболеваний показывают независимую связь между неудачей экстубации и летальностью. 9,11 Частично это можно объяснить неблагоприятными исходами, связанными с длительной ИВЛ; однако недавнее исследование Thille et al. 10 предполагает, что неудачная экстубация или незапланированная экстубация напрямую связаны с клиническим ухудшением, которое могло бы объяснить увеличение смертности. Данные свидетельствуют о том, что повторная интубация из-за неэффективности высвобождения связана с худшими исходами и более высокой смертностью, чем повторная интубация из-за неудачной экстубации. 7
Предложена концепция оптимальной частоты повторной интубации в условиях интенсивной терапии.Очень низкие показатели повторной интубации предполагают, что ИВЛ продолжается излишне долгое время, тогда как очень высокие показатели указывают на то, что слишком много пациентов экстубированы преждевременно. Предполагается, что эта оптимальная частота повторной интубации находится в диапазоне 5–15%. 10,12
Факторы риска неудачной экстубации
В периоперационном периоде был идентифицирован ряд факторов, повышающих риск неудачной экстубации. Анализ закрытых претензий ASA показал, что проблемы при экстубации чаще встречались у пациентов с ожирением или обструктивным апноэ во сне (СОАС). 4 Аналогичным образом, в отчете NAP4 наиболее частыми сопутствующими заболеваниями, связанными с повторной интубацией после анестезии, были ожирение (46%), ХОБЛ (34%) и СОАС (13%). 5 В рекомендациях по экстубации DAS учитывается наличие ранее существовавших проблем с проходимостью дыхательных путей (например, сложное начальное управление проходимостью дыхательных путей, ожирение / СОАС и повышенный риск аспирации желудочного содержимого), периоперационное ухудшение проходимости дыхательных путей (анатомическое искажение, отек или кровотечение из-за хирургическим или нехирургическим факторам) и / или ограниченному доступу к дыхательным путям как факторам риска неэффективности экстубации (Таблица 1). 6
Таблица 1. Факторы риска для дыхательных путей
из Руководства Общества с трудными дыхательными путями по ведению экстубации трахеи
Факторы, связанные с повышенным риском неудачной экстубации в отделении интенсивной терапии, включают пожилой возраст, длительную продолжительность искусственной вентиляции легких, анемию, более серьезную тяжесть заболевания, использование непрерывной внутривенной седации, необходимость транспортировки за пределы отделения интенсивной терапии и незапланированную экстубацию (таблица 2). ). 9 Медицинские и многопрофильные пациенты имеют более высокий риск неудачной экстубации, чем хирургические пациенты. 8 Было показано, что у нейрохирургических пациентов оценка комы Глазго <8 также является предиктором неэффективности экстубации. 13
Таблица 2. Факторы
, связанные с повышенным риском неудачной экстубации
Независимо от обстановки, некоторые сопутствующие заболевания могут вызывать затруднения во время экстубации, включая ревматоидный артрит, СОАС, нарушения гиповентиляции, нервно-мышечные состояния и снижение уровня сознания (Таблица 3).Общие факторы риска, такие как нарушение дыхательной или сердечно-сосудистой функции, нервно-мышечные нарушения, гипотермия, гипертермия и метаболические нарушения, также могут осложнять экстубацию. 6
Таблица 3.
Заболевания, связанные с повышенным риском неудачной экстубации
Причины неудачной экстубации
Неудача экстубации часто вызывается механизмами, влияющими на проходимость верхних дыхательных путей, включая ларингоспазм, дисфункцию голосовых связок, отек гортани, травмы дыхательных путей и обструкцию глотки.В случае тяжелой обструкции верхних дыхательных путей может развиться отек легких с пониженным давлением, требующий повторной интубации. Другие причины включают избыточную секрецию дыхательных путей, неспособность защитить дыхательные пути, сердечную недостаточность или ишемию, энцефалопатию, остаточные эффекты нервно-мышечной блокады или седативных препаратов и аспирацию. 9 Неудача при отлучении, которая не наблюдалась или не распознавалась до экстубации, также может проявляться как неудача при экстубации. 9
Ларингоспазм
Ларингоспазм — частая причина обструкции верхних дыхательных путей после экстубации, которая может привести к неэффективности экстубации.Это преувеличенное дезадаптивное проявление защитного рефлекса закрытия голосовой щели. Это обычно провоцируется стимуляцией языкоглотки или блуждающего нерва из-за инструментов для дыхательных путей или раздражения голосовых связок (например, кровью или рвотой), но может быть спровоцировано другими вредными раздражителями и может сохраняться в течение длительного времени после удаления раздражителя. Лечение ларингоспазма включает удаление раздражителей дыхательных путей и, при необходимости, введение небольшой дозы (20 мг для взрослого) сукцинилхолина с последующей повторной интубацией. 14 CPAP со 100% кислородом обычно называют терапевтическим приемом, хотя он может сблизить надгортанные складки и фактически вызвать ларингоспазм, действуя как механический стимул. 15 Двустороннее давление на выемку ларингоспазма между мыщелком нижней челюсти и сосцевидным отростком может быть эффективным при лечении ларингоспазма, вызывая сильный болевой раздражитель; это может действовать для прекращения ларингоспазма путем возбуждения пациента в полубессознательном состоянии или путем активации вегетативных путей. 14
Постобструктивный отек легких
Постобструктивный отек легких, также известный как отек легких с отрицательным давлением, может развиваться у пациентов со спонтанным дыханием, когда после экстубации возникает ларингоспазм или другие причины обструкции дыхательных путей. В результате сильного вдоха при острой обструкции дыхательных путей создается значительное отрицательное внутриплевральное давление, приводящее к нагрубанию легочной сосудистой сети и повышенному гидростатическому давлению в легочных капиллярах, что приводит к острому развитию отека легких.Это состояние наблюдается в течение нескольких минут после экстубации и обычно проявляется снижением S pO 2 и розовой пенистой мокротой. Заболеваемость этим заболеванием в послеоперационном периоде оценивается примерно в 1 из 1000, при этом молодые здоровые мужчины относятся к группе повышенного риска. 16 Другая этиология включает эпиглоттит, круп, инородное тело дыхательных путей, обструкцию ЭТТ, опухоль гортани и двусторонний паралич голосовых связок. 16 Лечение включает в себя устранение препятствий, добавление кислорода и тщательное наблюдение.CPAP может помочь ускорить разрешение отека. В тяжелых случаях может потребоваться повторная интубация и искусственная вентиляция легких. 16
Дисфункция голосовых связок
Травма блуждающего нерва или возвратного гортанного нерва (ветвь блуждающего нерва, обеспечивающая двигательную иннервацию гортани) может вызвать паралич голосовых связок. Это редкое осложнение чаще всего возникает при операциях на щитовидной железе, грудной клетке или шее. Дисфункция голосовых связок также может быть вызвана давлением манжеты ЭТТ возле переднего отдела возвратного гортанного нерва. 17 Односторонний паралич голосовых связок обычно проявляется неосложненной охриплостью, которая проходит в течение нескольких недель. Напротив, двусторонний паралич голосовых связок может вызвать обструкцию дыхательных путей, требующую немедленной повторной интубации. Выздоровление часто откладывается, и может потребоваться трахеостомия. Диагноз может быть подтвержден оптоволоконным обследованием.
Парадоксальное движение голосовых связок — часто неправильно диагностируемая причина послеоперационного стридора. Он включает приведение голосовых связок во время вдоха, что приводит к инспираторному стридору и, в тяжелых случаях, почти полной обструкции дыхательных путей.Точная этиология неизвестна, но предполагалось, что многие случаи имели неорганическую психогенную причину, и многие из описанных случаев были у пациентов с психическими заболеваниями. Диагноз ставится путем наблюдения за приведением голосовых связок во время вдоха с помощью непрямой или гибкой волоконно-оптической ларингоскопии. Лечение включает обеспечение адекватной оксигенации и вентиляции, а также введение умеренной седации бензодиазепинами или опиоидами после подтверждения диагноза. При правильном диагнозе можно избежать более инвазивного лечения с повторной интубацией или трахеостомией. 18
Отек гортани
Отек гортани — важная причина постэкстубационной обструкции. Это состояние возникает по разным причинам и может быть классифицировано как надгортанное, ретро-аритеноидное или подсвязочное. 19 Надгортанный отек чаще всего возникает в результате хирургических манипуляций, позиционирования, образования гематом, агрессивного оттока жидкости, уменьшения венозного оттока, длительной интубации или сопутствующих состояний (например, преэклампсии или ангионевротического отека).Подсвязочный отек чаще встречается у детей, особенно младенцев и новорожденных. Факторы, связанные с развитием подсвязочного отека у детей, включают интубацию трахеи, интубацию в течение> 1 ч, раскачивание ЭТТ, изменение положения головы и плотно прилегающую ЭТТ. Этиология ретро-аритеноидного отека менее подробно описана, но может быть связана с местной травмой или раздражением. Обычно отек гортани проявляется в виде инспираторного стридора в течение 30–60 минут после экстубации, хотя может возникнуть и через 6 часов после экстубации.Независимо от причины, лечение зависит от тяжести состояния и включает увлажненный кислород, распыленный рацемический адреналин и размещение пациента в положении с поднятой головой. В тяжелых случаях отек гортани может привести к неэффективности экстубации и потребовать повторной интубации. 19 Профилактические стероиды показали свою эффективность в предотвращении отека гортани у пациентов с высоким риском развития осложнений при введении по крайней мере за 4 часа до экстубации. 20
Остаточная нервно-мышечная блокада
Нервно-мышечные блокаторы часто используются во время общей анестезии для облегчения интубации и оптимизации хирургических условий и иногда используются в отделениях интенсивной терапии.Остаточная нервно-мышечная блокада (также называемая послеоперационной остаточной кураризацией [PORC]), определяемая как отношение последовательности четырех <0,9, может проявляться как отлучение от груди или неэффективность экстубации. Исследования на послеоперационных субъектах показали высокую частоту ПОРК во время экстубации вне зависимости от того, применяли ли неостигмин или нет. 21 PORC, как было показано, приводит к нарушению функции глотки и обструкции верхних дыхательных путей, 22,23 , а также к снижению пикового потока выдоха и FVC. 24 У пациентов с ПОРК наблюдалось учащение послеоперационных респираторных осложнений, включая необходимость повторной интубации. 25
Как минимум, когда нервно-мышечные блокирующие препараты вводятся во время операции или в отделении интенсивной терапии, следует использовать качественный мониторинг нервно-мышечных сокращений для оценки необходимости реверсии нервно-мышечной блокады. Клинические тесты (например, способность выдерживать 5-секундный подъем головы или способность поддерживать силу жевательных мышц) и качественный нервно-мышечный мониторинг (например, двойная стимуляция или устойчивая тетаническая реакция) показали низкую чувствительность для обнаружения PORC.Пациентам с высоким риском неэффективности экстубации может быть показано использование количественного мониторинга нервно-мышечных сокращений для обеспечения соотношения четырех четверок> 0,9 для максимального успеха экстубации.
Предотвращение неудачной экстубации
Доказательства того, что неэффективность экстубации приводит к увеличению частоты осложнений и смерти, привели к попыткам определить методы предотвращения необходимости повторной интубации. Хотя некоторые исследования показали, что неинвазивная вентиляция (НИВ) может снизить частоту повторной интубации, 26 в большинстве случаев не показали преимущества в предотвращении повторной интубации при применении ко всем пациентам после экстубации или при применении к пациентам с признаками постэкстубационной дыхательной недостаточности. 3,27 НИВЛ может играть роль в предотвращении неэффективности экстубации у определенных групп пациентов, например, с нервно-мышечными заболеваниями. 28
Использование кортикостероидов для уменьшения воспалительного отека дыхательных путей и предотвращения неэффективности экстубации широко изучалось. 29 В рекомендациях DAS указано, что стероиды следует назначать как можно скорее пациентам с высоким риском отека дыхательных путей и продолжать не менее 12 часов. Одноразовая доза стероидов, вводимая непосредственно перед экстубацией, вряд ли будет эффективной. 6
Отлучение от механической вентиляции
Прекращение искусственной вентиляции легких является важным условием экстубации у пациентов в критическом состоянии. Существует фундаментальное различие между экстубацией после плановой интубации для хирургической процедуры и экстубацией после интубации при острой дыхательной недостаточности. Отлучение от груди обычно относится к процессу оценки готовности пациента переносить удаление механической поддержки вентиляции легких, выполнения проб спонтанного дыхания (SBT) с минимальной или нулевой вентиляционной поддержкой и последующей экстубации, когда SBT указывает на то, что пациент будет переносить освобождение от искусственной вентиляции легких. вентилятор.Подсчитано, что время, проведенное в процессе отлучения, составляет 40–50% от всей продолжительности искусственной вентиляции легких. 30 Имеются данные о том, что отлучение от груди часто откладывается, что увеличивает продолжительность ИВЛ и увеличивает риск связанных с ней осложнений. 30
Отлучение от груди следует рассматривать как можно раньше, чтобы снизить частоту осложнений, связанных с длительной ИВЛ. 30 Это должно быть сбалансировано с учетом потенциального риска слишком раннего инициирования самопроизвольного дыхания. 1 Объективные параметры отлучения имеют лишь умеренную прогностическую способность и не способствуют отлучению. 31 Например, использование соотношения частота / дыхательный объем при принятии решения о начале SBT в одном исследовании привело к более длительному времени до отлучения и аналогичным результатам, 32 предполагая, что нет преимуществ в использовании этого параметра для прогнозирования готовность. В настоящее время консенсус состоит в том, что объективные параметры отлучения не должны регулярно использоваться для определения готовности к отлучению.Вместо этого пациенты могут считаться готовыми к отлучению, когда есть доказательства клинического улучшения исходного патологического процесса, приведшего к острой дыхательной недостаточности, стабильности сердечно-сосудистой системы с минимальными требованиями к вазопрессорам, адекватным мышлением, попытками спонтанной вентиляции и адекватная оксигенация (определяется как насыщение артериальной крови кислородом> 90% с F IO 2 ≤ 0,4 и PEEP ≤ 8 см H 2 O). 1,30,33
После определения готовности к отлучению от груди выполняется SBT в качестве диагностического теста для прогнозирования успеха освобождения вентилятора.Это включает в себя испытание спонтанной вентиляции либо без посторонней помощи (через тройник), либо с механической поддержкой низкого уровня (CPAP или вентиляция с поддержкой давлением [PSV] ≤ 8 см H 2 O). 1 Множественные исследования не смогли продемонстрировать превосходство одного метода над другим для SBT. Обоснованием использования PSV было преодоление сопротивления ETT; однако после длительной интубации верхние дыхательные пути обычно имеют более высокое сопротивление, чем обычно, поэтому такая компенсация обычно не требуется. 30,34 Автоматическая компенсация трубок, настройка вентилятора, которая компенсирует падение давления на ETT, сравнима с PSV низкого уровня или тройником. 35 Продолжительность SBT должна быть не менее 30 мин. 30 ; нет никакой пользы от продления продолжительности SBT до 120 минут. 36,37
Сообщается, что частота отказов от отлучения после первоначального SBT составляет 25–40%. 30 Выявлены множественные этиологии отказа от отлучения (Таблица 4).Некоторые подгруппы пациентов (например, с ХОБЛ и гиперкапнической дыхательной недостаточностью) подвержены более высокому риску отказа от отлучения. 38 Для пациентов, у которых не удалось провести начальную SBT, следует рассмотреть обратимые причины неудачи. 30
Таблица 4.
Причины отказа от отлучения
Относительно частой причиной недостаточности SBT является сердечная дисфункция. Во время SBT снижение внутригрудного давления приводит к увеличению венозного возврата и увеличению постнагрузки левого желудочка, что может ускорить левожелудочковую недостаточность и отек легких. 39,40 Эхокардиография и уровни натрийуретического пептида в сыворотке головного мозга использовались для оценки сердечной дисфункции как причины неудачного отлучения от груди. 41,42 Стратегии лечения включают уменьшение постнагрузки с помощью вазодилататоров, уменьшение преднагрузки с помощью диуретиков и CPAP.
NIV был изучен как метод отлучения от груди с потенциалом уменьшения продолжительности инвазивной механической вентиляции легких. Несколько исследований показали, что в подгруппе субъектов с обострением ХОБЛ НИВ играет роль в облегчении отлучения от груди, сокращении продолжительности интубации, снижении частоты ВАП и снижении смертности у пациентов, у которых не удалось выполнить SBT. 27,30,43 В этом случае НИВ может быть учреждена, когда пациент соответствует критериям для начала SBT, имеет проходимые дыхательные пути и может выводить выделения. 2,44 НИВ не следует использовать в качестве метода отлучения от пациентов, которым было бы технически сложно повторно интубировать. 44 Доказательства не подтверждают роль НИВЛ у пациентов без ХОБЛ, у которых не удалось провести SBT. 44
Решение о экстубации
Ограничением SBT является то, что они не оценивают проходимость дыхательных путей, 45 , что необходимо учитывать при определении того, какие пациенты подвержены риску неэффективности экстубации.При определении возможности экстубации часто выполняются два маневра. Первый — это визуализация входного отверстия гортани перед экстубацией, которая может выполняться с помощью прямой ларингоскопии, непрямой / видеоларингоскопии или гибкой волоконно-оптической ларингоскопии. Этой практике часто обучают как методу оценки проходимости дыхательных путей перед экстубацией на предмет отека и оценки возможности повторной интубации. Тем не менее, авторы считают, что такая практика имеет ограниченную ценность. ЭТТ блокирует доступ ларингоскописта к входному отверстию гортани, а анатомия дыхательных путей деформируется ЭТТ in situ, что приводит к недооценке сложности повторной интубации.Никакие исследования не показали, что ларингоскопия перед экстубацией снижает частоту повторной интубации.
Второй обычно выполняемый маневр — это проверка герметичности манжеты. Качественный тест на герметичность манжеты выполняется путем удаления пациента со спонтанной вентиляцией воздуха из контура вентиляции, спуска воздуха из манжеты и закрытия конца ЭТТ пальцем. 46,47 При отсутствии значительного отека гортани пациент сможет дышать вокруг ЭТТ, о чем свидетельствует аускультация звуков дыхания или измерение выдыхаемого углекислого газа из полости рта. 48 Количественный тест на утечку из манжеты выполняется путем сравнения выдыхаемых дыхательных объемов с надутой и спущенной манжетой, когда пациент находится на ИВЛ с контролем объема. Разница между накачанным и спущенным дыхательными объемами не менее 10–25% или 110–130 мл у взрослого человека предполагает низкую вероятность отека гортани. 49,50 Более высокие значения отсечки могут быть полезны у пациентов с затрудненными дыхательными путями, у которых ожидается сложность повторной интубации. 7 Мета-анализ теста на утечку из манжеты показал умеренную точность теста для прогнозирования стридора послеэкстубации и низкую точность для прогнозирования необходимости повторной интубации. 51 Однако при затрудненных дыхательных путях, где вероятность неудачной экстубации до теста выше, тест на утечку из манжеты может по-прежнему предоставить ценную клиническую информацию, которая поможет принять решение о продолжении экстубации.
По мнению авторов, тест на герметичность манжеты следует проводить у любого пациента, у которого существует риск неэффективности экстубации. Хотя наличие утечки из манжеты не обязательно гарантирует успешную экстубацию, стратегическая экстубация трудных дыхательных путей при наличии утечки из манжеты является разумной.При отсутствии утечки из манжеты можно рассмотреть возможность контролируемой экстубации через катетер для воздухообмена (AEC); однако может быть разумным отложить экстубацию, если ожидается, что повторная интубация будет особенно сложной, особенно если со временем условия могут улучшиться. Это должно быть сбалансировано с учетом рисков длительной механической вентиляции. Экстубация также может быть отложена, если предполагается, что отсутствие утечки из манжеты связано с воспалением дыхательных путей в результате травматической интубации или хирургии верхних дыхательных путей, челюстно-лицевой хирургии или хирургии шеи.В этих ситуациях есть некоторые данные о назначении кортикостероидов по крайней мере за 4 часа до экстубации.
Экстубация после плановой интубации
Решение о экстубации после плановой интубации для общей анестезии зависит от нескольких дополнительных факторов, включая предоперационный статус пациента, интраоперационный курс и ожидаемое послеоперационное восстановление. К факторам, которые необходимо учитывать, относятся интраоперационный курс пациента (включая продолжительность, тип и местоположение процедуры), основные медицинские состояния пациента (например, заболевание легких или сердца) и текущий клинический статус пациента (например, наличие жидкости баланс, гемодинамическая стабильность, уровень сознания, мышечная сила и температура).Должен быть оценен вентиляционный статус и соблюдены стандартные критерии экстубации (таблица 5). Если у пациента было лабильное интраоперационное течение или проблемы в любой из вышеперечисленных областей, пациента не следует экстубировать в операционной сразу по окончании операции, а следует доставить в постанестезиологическое отделение или отделение интенсивной терапии. для дальнейшей стабилизации перед экстубацией.
Таблица 5. Критерии стандартной экстубации
Экстубация трудных дыхательных путей
При составлении плана экстубации важно стратифицировать не только риск неудачной экстубации, но и возможность повторной интубации.Поэтому экстубация трудных дыхательных путей требует особого внимания. Сложные дыхательные пути, как это определено в «Практическом руководстве по лечению трудных дыхательных путей» ASA, — это «клиническая ситуация, в которой анестезиолог, прошедший традиционную подготовку, испытывает трудности с вентиляцией верхних дыхательных путей с помощью маски, трудности с интубацией трахеи или и то и другое. ” 53 Решение об экстубации пациента с заведомо или подозреваемым затруднением проходимости дыхательных путей может быть проблематичным. Основная цель экстубации затрудненных дыхательных путей, как и любых других дыхательных путей, — избежать повторной интубации, если это вообще возможно.Эта цель чрезвычайно важна при затрудненном прохождении дыхательных путей, поскольку повторная интубация почти всегда более опасна. Многие состояния, связанные с затрудненной вентиляцией через маску и / или интубацией, также могут предрасполагать к более высокому риску неудачной экстубации. В этом случае повторная интубация представляет собой более серьезную проблему для трудных дыхательных путей. Из-за вероятности серьезных осложнений, связанных с неудачной экстубацией, если повторная интубация не будет быстро достигнута, клиницисты должны быть вооружены методами, которые успешно решают специфические проблемы экстубации трудных дыхательных путей и оценивают потенциальные осложнения, связанные с экстубацией.
Очевидно, что если при индукции возникают трудности с вентиляцией через маску или эндотрахеальной интубацией, следует проявлять особую осторожность во время экстубации из-за ожидаемых трудностей повторной интубации, если это необходимо. Часто в этом сценарии наблюдается более высокий уровень неудачной экстубации из-за травмы дыхательных путей в результате нескольких попыток первоначальной защиты дыхательных путей. Отек дыхательных путей и припухлость в результате многократных попыток могут привести к обструкции после экстубации и невозможности адекватной вентиляции.
С другой стороны, может не возникнуть никаких трудностей с начальным контролем проходимости дыхательных путей, но из-за изменений в дыхательных путях, которые происходят в результате хирургического вмешательства или длительной интубации, при экстубации могут возникнуть трудности. Важно помнить, что простота управления дыхательными путями на начальном этапе не означает, что управление дыхательными путями будет легким после завершения операции. Тиреоидэктомия, эндартерэктомия сонной артерии, операции на переднем шейном отделе позвоночника и челюстно-лицевая хирургия — это лишь несколько примеров хирургических вмешательств на дыхательных путях, которые могут привести к затруднению проходимости дыхательных путей при экстубации.Длительная интубация может привести к отеку гортани и глотки, макроглоссии, травме гортани и трахеобронхиальной артерии, что может повысить риск неудачной экстубации и при необходимости затруднить повторную интубацию. Многие проблемы экстубации, связанные с хирургическими процедурами, включают послеоперационное кровотечение, повреждение нервов или прямую травму тканей. Следует соблюдать осторожность при размещении устройств рядом с дыхательными путями во время и после операции (например, шейные воротники, челюстно-нижнечелюстная фиксация или большие повязки на голове или шее).Эти устройства могут ограничивать доступ к дыхательным путям и затруднять повторную интубацию.
При принятии решения о том, следует ли экстубировать пациента с затрудненным проходимостью дыхательных путей, необходимо связаться с хирургической бригадой и / или бригадой интенсивной терапии. Важно, чтобы все стороны, участвующие в уходе за пациентом, были осведомлены о характере потенциального затруднения дыхательных путей, и между врачом следует провести четкое обсуждение рисков и преимуществ экстубации по сравнению с длительной интубацией.Следует также учитывать план будущих операций пациента; Нет смысла экстубировать пациента с затрудненными дыхательными путями, который вернется на следующее утро для повторной операции.
Стратегии экстубации
После принятия решения о экстубации можно сформулировать стратегии безопасной экстубации. Врач должен понимать различные варианты экстубации и сформулировать план действий по восстановлению контроля над дыхательными путями в случае неудачной экстубации.Экстубация после плановой интубации для общей анестезии имеет другие соображения по сравнению с экстубацией после интубации при острой дыхательной недостаточности.
Целевая группа ASA по лечению затрудненных дыхательных путей рекомендует учитывать риски и преимущества экстубации в бодрствующем состоянии по сравнению с экстубацией в состоянии глубокого наркоза. 53 Так называемая глубокая экстубация была описана у пациентов как с легкими, так и с затрудненными дыхательными путями. Экстубация пациента, находящегося в глубокой анестезии, широко преподается как средство снижения риска ларингоспазма или бронхоспазма, но нет адекватных исследований, указывающих на какую-либо реальную пользу от этого подхода.Хотя глубокая экстубация может снизить риск кашля и вздрагивания перед экстубацией, риск обструкции дыхательных путей из-за воздействия глубокой анестезии на тонус глоточных мышц является значительным; поэтому мы считаем, что эту практику не следует поощрять из-за затрудненного прохождения дыхательных путей. Экстубация в сознании — наиболее подходящий метод удаления ЭТТ у большинства пациентов с затрудненными проходимостью дыхательных путей. Аналогичным образом, пациентам, интубированным по поводу острой дыхательной недостаточности, рекомендуется восстановление после седации до экстубации из-за характера потребности в искусственной вентиляции легких у этой группы пациентов.
У пациентов с низким риском неудачной экстубации может быть выполнена стандартная экстубация. Это включает преоксигенацию с F IO 2 1,0, отсасывание трахеи и ротоглотки и экстубацию под тщательным наблюдением до тех пор, пока не будет подтверждена проходимость дыхательных путей и способность переносить экстубацию.
Для пациентов с риском неэффективности экстубации, особенно для пациентов с затрудненными проходимостью дыхательных путей, можно использовать одну из нескольких альтернативных стратегий, как описано в рекомендациях DAS. 6 К ним относятся экстубация с помощью АЭК, экстубация с помощью ларингеальной маски с помощью дыхательных путей и использование ремифентанила (внутривенный опиоид ультракороткого действия). 6
Экстубация с использованием катетера для обмена дыхательных путей
Практические рекомендации ASA и рекомендации DAS обсуждают использование устройства типа стилета или бужа для помощи при повторной интубации, если экстубация не удалась. 6,53 Стилет вводится через ЭТТ, а ЭТТ удаляется поверх стилета. Стилет остается в дыхательных путях до тех пор, пока риск неудачной экстубации не перестанет быть значительным; если возникает необходимость в повторной интубации, стилет используется в качестве ориентира, по которому продвигается ЭТТ.Многие устройства использовались при экстубации трудных дыхательных путей, включая бронхоскопы, назогастральные зонды, эластичные бужи десен и аспирационные трубки. 6 Большинство из этих устройств были впервые описаны для обмена ETT, и многие до сих пор используются для этой цели.
AEC — это длинные полые полужесткие катетеры, которые предназначены для обмена ETT, но они подходят для экстубации трудных дыхательных путей. Существует множество производителей этих типов катетеров, но все они основаны на одном и том же принципе: длинная полая трубка или стилет вставляется в ЭТТ in situ на заданную глубину, ЭТТ удаляется над катетером, а катетер остается внутри. место для проведения интубации, если повторная интубация необходима, для вдувания кислорода с помощью струйной вентиляции или для периодического измерения содержания углекислого газа в трахее в конце выдоха.Эти продукты бывают разных размеров и имеют разные характеристики в зависимости от производителя. Часто используемым AEC является Cook AEC (Cook Medical, Блумингтон, Индиана) (рис. 1).
Рис. 1.
Катетер для обмена дыхательных путей. Предоставлено Cook Medical.
Рекомендуемый размер Cook AEC для большинства взрослых пациентов — 11 французских. Этот размер АЭК хорошо переносится бодрствующим пациентом и позволяет проводить повторную интубацию с помощью ЭТТ с внутренним диаметром всего 4,5 мм. Более крупные пациенты обычно могут использовать 14 французских AEC, что позволяет провести повторную интубацию с помощью ETT с внутренним диаметром не менее 5.5 мм. Если известно, что требуется замена ЭТТ (например, в результате разрыва манжеты, что приводит к утечке из манжеты), может быть разумным использовать AEC большего диаметра. Небольшие АЭК могут легко использоваться с целью возможной повторной интубации и обычно переносятся без топизации дыхательных путей; при необходимости можно ввести 2–4% лидокаина через AEC для повышения толерантности к AEC. Этот маневр следует выполнять, пока пациент находится под наркозом, чтобы минимизировать кашель. После установки AEC следует закрепить лентой, чтобы предотвратить миграцию или случайную экстубацию.AEC должен быть хорошо промаркирован, так как его можно легко принять за зонд для кормления из-за схожего диаметра и цвета (светло-желтый).
Раздражение карины — частая причина непереносимости из-за дискомфорта, бронхоспазма и приступообразного кашля; поэтому правильная оценка глубины во время экстубации имеет важное значение. Периодическое обсуждение с пациентом проблем, связанных с дыхательными путями, также важно, поскольку понимание пациентом клинических последствий потери дыхательных путей может повысить их порог толерантности.
Cook AEC поставляются с двумя адаптерами Rapi-Fit: один с 15-миллиметровым разъемом для подключения к контуру анестезии или мешку Амбу, а другой с разъемом Luer-Lok для струйной вентиляции. Перед использованием АЭК для оксигенации, вентиляции или повторной интубации обязательно подтвердить правильность установки визуализацией (с прямой или непрямой ларингоскопией) или капнографией. Катетеры имеют маркировку расстояния, позволяющую правильно определить глубину. Чтобы избежать баротравмы или перфорации бронхов в результате посткаринального введения, эти катетеры следует вводить на глубину 20–22 см (не более 25 см) при использовании для оротрахеальной интубации; при назотрахеальной интубации глубина 27–30 см является подходящей.Из-за риска баротравмы инсуффляцию кислорода или струйную вентиляцию следует использовать только в качестве меры по спасению жизни и только при наличии свободных верхних дыхательных путей. 6
При попытке повторной интубации через AEC рекомендуется одновременная прямая или видеоларингоскопия для втягивания мягких тканей и облегчения продвижения ETT над AEC. Следует использовать наименьший эффективный размер ЭТТ, чтобы свести к минимуму воздействие ЭТТ на структуры гортани. В качестве альтернативы, Parker Flex-Tip ETT (Parker Medical, Englewood, Colorado) имеет мягкий изогнутый передний скос, который сводит к минимуму зазор между AEC и просветом ETT и способствует плавному проходу в трахею. 52
Cook Medical недавно разработала набор для поэтапной экстубации, специально разработанный для экстубации трудных дыхательных путей (рис. 2). В настоящее время он доступен в Европе, Австралии и Канаде и состоит из катетера для поэтапной реинтубации, 14 французских катетеров AEC с тупым мягким наконечником и проволоки для поэтапной экстубации (гибкая проволока диаметром 0,035 дюйма с полимерным покрытием, обеспечивающая минимальное раздражение). и максимальный комфорт пациента на месте, но с достаточной жесткостью, чтобы обеспечить надежный путь для катетера для повторной интубации). 54 Проволока для поэтапной экстубации продвигается через ЭТТ перед экстубацией на заданную глубину. ЭТТ удаляется, а проволока остается закрепленной на месте до тех пор, пока риск неудачной экстубации не будет определен как приемлемый. В случае необходимости повторной интубации катетер для поэтапной повторной интубации продвигается по проволоке, а затем ЭТТ продвигается по катетеру для повторной интубации.
Рис. 2.
Набор для поэтапной экстубации, который включает 14 ступенчатый катетер для повторной интубации French и катетер 0.Проволока для поэтапной экстубации 035 дюймов. Предоставлено Cook Medical.
Ларингеальная маска Экстубация с помощью дыхательных путей
Экстубация под общей анестезией предотвращает кашель и неблагоприятные гемодинамические эффекты во время экстубации, которые могут быть нежелательными для пациентов с определенными факторами риска (например, сердечным заболеванием или реактивными дыхательными путями) или после определенных хирургических процедур (например, нейрохирургических или челюстно-лицевых процедур) . Однако такая практика может привести к обструкции дыхательных путей и необходимости в маневрах поддержки дыхательных путей и, как таковая, может не подходить для экстубации с повышенным риском.Дыхательные пути ларингеальной маски играют важную роль в облегчении экстубации под общей анестезией у пациентов с высоким риском неудачи, выступая в качестве моста к успешной экстубации. Было показано, что гемодинамический стресс и кашель или вздрагивание снижаются во время выхода из груди с установленным дыхательным путем ларингеальной маски по сравнению с экстубацией трахеи как в бодрствующем, так и в состоянии глубокого наркоза. 55,56
Описаны различные методы использования дыхательных путей ларингеальной маски при экстубации. 6 Введение ларингеальной маски в дыхательные пути после экстубации было описано как с LMA Classic, так и с LMA ProSeal (LMA North America, Сан-Диего, Калифорния). 6,55 Использование волоконно-оптической бронхоскопии в сочетании с ларингеальной маской для дыхательных путей полезно в условиях, когда оценка функции голосовых связок является важной частью плана экстубации, например, при сложных операциях на щитовидной железе. 57 Обычная техника обмена дыхательными путями ЭТТ / ларингеальной маски включает сначала размещение дыхательных путей ларингеальной маски позади ЭТТ, процедуру, часто называемую маневром Бейли в честь доктора П. М. Бейли. 58
Метод экстубации ремифентанила
Использование ремифентанила — еще один метод в рекомендациях DAS для облегчения трудной экстубации. 6 Было показано, что инфузия ремифентанила во время экстубации снижает кашель и гемодинамические изменения, связанные с экстубацией трахеи. 59 Из-за очень короткого периода полувыведения ремифентанила инфузии можно легко титровать до оптимального клинического эффекта, сводя к минимуму риск кашля (при слишком низкой дозе) и апноэ (при слишком высокой дозе). 6 Эту стратегию следует рассматривать для пациентов, у которых нежелательные гемодинамические эффекты и кашель, связанные с экстубацией, например, пациенты со значительным сердечным или реактивным заболеванием дыхательных путей или после определенных хирургических процедур. 6
Лечение неудачной экстубации
Начало респираторного дистресса после экстубации должно предупредить клинициста о том, что экстубация у пациента не выполняется. Гиперкапния, гипоксия и брюшное дыхание — все это признаки того, что может потребоваться повторная интубация.Тяжелый постэкстубационный стридор и неспособность управлять выделениями являются дополнительными показаниями к повторной интубации.
Пациенты, которым не удалось экстубировать, имеют повышенный уровень смертности по сравнению с пациентами, успешно экстубировавшимися с первой попытки, или пациентами, которые не прошли первую попытку дыхания, но не были экстубированы. 3,60 Это говорит о том, что неудачная экстубация сама по себе увеличивает смертность. Исследования также показали, что среди пациентов, которым требуется повторная интубация, смертность выше у пациентов, у которых повторная интубация отложена.Не было показано, что НИВЛ снижает частоту повторной интубации и может увеличить смертность, задерживая повторную интубацию. 61 Таким образом, данные свидетельствуют о том, что своевременная повторная интубация в случае неудачи имеет первостепенное значение. Клиницисты должны быть готовы быстро оценить реакцию пациента на экстубацию и действовать немедленно, когда очевидно, что дыхательная недостаточность неизбежна. 8
Незапланированная экстубация
Незапланированная экстубация — обычное явление в отделении интенсивной терапии у пациентов на ИВЛ, которым часто требуется повторная интубация.Незапланированная экстубация может быть следствием действий пациента (преднамеренная) или во время обычного ухода за больными и оказания медицинской помощи (непреднамеренная). 62 Факторы риска незапланированной экстубации включают низкий уровень седации, поездки из отделения интенсивной терапии, мужской пол, получение портативной рентгенограммы грудной клетки и соотношение медсестер и пациентов 1: 3. 62–64 Использование фиксаторов не показало снижения частоты незапланированной экстубации и, в некоторых исследованиях, было связано с более высокой частотой повторной интубации. 63,65
Пациенты, у которых произошла незапланированная экстубация до того, как будут выполнены критерии отлучения, должны быть немедленно повторно интубированы. 66 НИВЛ может иметь преимущество при лечении незапланированной экстубации у пациентов, которые соответствуют критериям отлучения от груди и могут управлять своей секрецией. 66
Исследования будущего
Дальнейшие исследования экстубации должны быть сосредоточены на индивидуальных предикторах неудачной экстубации и разработке методов, позволяющих максимально увеличить вероятность успешной экстубации у пациентов с высоким риском неудачной экстубации.Следует изучить различные методы выполнения теста на герметичность манжеты, чтобы определить подход, обеспечивающий наивысшую прогностическую силу. Кроме того, необходимо выяснить конкретные подгруппы пациентов, у которых тест имеет наивысшую ценность.
Патофизиологические состояния, которые способствуют отказу от отлучения, также должны быть идентифицированы, наряду со стратегиями, облегчающими отлучение этих пациентов. 30 Конкретным примером является потребность в надежных методах оценки неэффективности отлучения из-за сердечной дисфункции и определения методов лечения для улучшения успеха отлучения в этом сценарии.Роль НИВ в процессе прекращения искусственной вентиляции легких и в предотвращении необходимости повторной интубации также требует дальнейшего изучения. Текущие данные о роли НИВ в отлучении от груди и экстубации неоднозначны: некоторые исследования демонстрируют потенциальную пользу НИВЛ, 26 , но многие испытания не показали преимущества при использовании в неотобранных популяциях. 3,27 Дальнейшие исследования могут, возможно, выявить подгруппы пациентов, в которых метод может быть полезным, что было показано для пациентов с обострением ХОБЛ и нервно-мышечными заболеваниями. 27,28
Выводы
Из-за осложнений, связанных с длительной интубацией, пациенты, получающие инвазивную искусственную вентиляцию легких, должны быть экстубированы как можно быстрее. Однако риски, связанные с неудачей экстубации и повторной интубацией, требуют, чтобы процесс экстубации контролировался практикующими врачами с детальным пониманием причин неудач экстубации и возможных осложнений. Предварительно разработанный план экстубации с учетом возможной необходимости повторной интубации имеет первостепенное значение.
Сноски
- Переписка: Карлос А. Артиме, доктор медицины, кафедра анестезиологии, Медицинская школа Техасского университета в Хьюстоне, 6431 Fannin Street, MSB 5.020, Хьюстон, Техас 77030. Электронная почта: carlos.artime {at} uth.tmc .edu.
Д-р Хагберг представил версию этой статьи на 52-й конференции журнала Respiratory Care Journal «Искусственные дыхательные пути и вспомогательные компоненты дыхательных путей для взрослых», которая проходила 14 и 15 июня 2013 г. в Санкт-Петербурге, Флорида.
Д-р Артиме работал в бюро докладчиков и в качестве бесплатного консультанта компании Mylan Pharmaceuticals, а также получал исследовательскую поддержку от Cadence Pharmaceuticals.Д-р Хагберг был неоплачиваемым консультантом в Ambu A / S и получал исследовательскую поддержку от Ambu, Cadence Pharmaceuticals, Karl Storz Endoscopy и King Systems.
- Авторские права © 2014, Daedalus Enterprises
Пусто:
Я ценю отличный разговор, Карин. У меня есть пара комментариев и один вопрос. Вы упомянули остаточную нервно-мышечную блокаду. Конечно, литература действительно поддерживает это как важную причину респираторной заболеваемости не только из-за обструкции верхних дыхательных путей, но и из-за дальнейшего снижения ОФВ 1 и ФЖЕЛ у пациентов, у которых есть факторы риска.Неудача при отлучении также может быть связана с сердечными причинами. Переход на вентиляцию с отрицательным давлением, конечно, связан с довольно значительными изменениями сердечного и респираторного взаимодействия. Переход к спонтанной вентиляции может значительно изменить как преднагрузку желудочка, так и постнагрузку, особенно постнагрузку ЛЖ [левого желудочка]. Я знаю, что есть литература об отлучении от груди пациентов с СОАС [обструктивным апноэ во сне] и дисфункцией ЛЖ. Мне было интересно, встретили ли вы что-нибудь в своих поисках литературы по таким соображениям.
Хагберг:
Они действительно не обращались конкретно к этой группе пациентов, но теперь, когда вы упомянули об этом, в этой области предстоит проделать очень много работы. Я знаю, что вы специализируетесь на кардиологии, верно? Так что это может быть отличным уроком для вас в вашем учреждении.
Пусто:
Я пытался уговорить Стивена [Коллинза] на это.
Хагберг:
Нам действительно нужно больше исследований. Очень часто это анекдотично или какая практика была. Я бы посоветовал вам и вашему младшему коллеге подумать о разработке протокола для этих более проблемных пациентов.Вы знаете, как я уже сказал, рекомендации 1 ASA [Американского общества анестезиологов] на самом деле являются просто рекомендациями; это не алгоритмический подход и не относится конкретно к этим типам пациентов. Я действительно думаю, что теперь, когда рекомендации 2 DAS [Общества трудных дыхательных путей] перешли к алгоритмическому подходу, ASA также рассмотрит это, что я поддерживаю.
Гесс:
Я думаю, что существует большая путаница в отношении тестов на герметичность манжеты и того, как их проводить.Например, в отделении интенсивной терапии я никогда не видел, чтобы тест на герметичность манжеты проводился так, как я знаю, что вы делаете в операционной [операционной], где вы отпускаете манжету и кладете большой палец на конец трубки. Что мы делаем в отделении интенсивной терапии, так это оказываем положительное давление на трахею, отпускаем манжету и затем пытаемся качественно или количественно оценить объем утечки. Я думаю, что для сообщества интенсивной терапии было бы очень полезно, если бы у нас был стандартизованный способ сделать это, и не только стандартизованный способ сделать это, но и истинное указание , когда мы должны это сделать, потому что ценность Тест на герметичность манжеты будет потерян, если вы сделаете его на всех: слишком много ложных срабатываний и ложных отрицаний.У пациентов, относящихся к группе риска, это может иметь место.
Хагберг:
Вы абсолютно правы. Нет хорошего стандартизированного метода; это не единообразно. В этом есть необходимость. Так что интересно, что мы обсуждаем области, в которых необходимо проделать дальнейшую работу, и, похоже, идет дальнейшая стандартизация. Во всей нашей практике все становится более стандартизированным; просто меньше места для ошибки. Итак, вы абсолютно правы; это проблема, и нам нужно улучшить ее.
Гесс:
Я нахожу интригующим то, что, по вашему мнению из операционной, вы экстубировали кого-то в LMA [дыхательные пути ларингеальной маски]. Я никогда такого не видел. В отделении интенсивной терапии нашим подходом было бы экстубировать кого-либо до НИВ [неинвазивной вентиляции]. Я нахожу интригующим то, что у вас есть пациент, страдающий болезненным ожирением и которому, без сомнения, нужен CPAP, и вы устанавливаете LMA, чтобы обеспечить CPAP. В отделении интенсивной терапии я бы применил назальную или ороназальную маску и таким образом проводил CPAP.
Хагберг:
Я думаю, что одним из преимуществ LMA является легкий доступ для повторной интубации.Поэтому мы склонны использовать его с оптоволоконной визуализацией голосовых связок, когда мы удаляем его, а затем его легко снова вставить и повторно интубировать, если это необходимо. Так что если вам нужна немедленная повторная интубация, это немного другое дело. Я думаю, что это действительно важно. Некоторым пациентам это хорошо, потому что он стентирует жировую ткань. Обычно язык может откатываться назад и вызывать непроходимость, но когда пациент сидит с этим LMA внутрь, жировая ткань действительно остается немного более открытой, и пациенты переносят это очень хорошо.Но мы не проводили исследования, в котором сравнивали бы пациентов с осложнениями и частоту повторной интубации по сравнению с пациентами без осложнений.
Гесс:
Распространенная причина, по которой мы не экстубируем пациентов в отделении интенсивной терапии, — это контроль секреции. Мне не ясно, как LMA может помочь.
Хагберг:
Опять же, это больше касается визуализации, когда вы удаляете трубку, так что, когда вы выводите трубку, вы можете увидеть, не накапливаются ли секреты и так далее. Что LMA имеет тенденцию делать, так это предотвращать попадание секретов в голосовую щель.Когда мы удаляем LMA, мы часто не сдуваем его, выводя секреты наружу, когда мы выходим с устройством.
Гесс:
Возможно, мы должны попробовать это у пациентов, которые обсуждают, следует ли экстубировать или нет.
Хагберг:
Да, оставьте LMA позади. В операционной, обмен, который я показал, был трепанацией черепа, когда вам не нужно много кашлять или толкать трубку. В итоге мы заставляем их дышать через трубку, удаляем трубку, и вы можете провести глубокую экстубацию или экстубацию в бодрствующем состоянии и в любом случае оставить LMA на месте.Иногда у пациентов после операции на щитовидной железе мы хотим изучить функцию голосовых связок, поэтому мы выполняем поэтапную экстубацию, используя LMA в качестве моста. Что касается LMA, вы можете применять CPAP так же, как и с другими устройствами, но я думаю, что способность легко повторно интубировать имеет важное значение, а также предотвращает распространение секрета, что может вызвать ларингоспазм.
Рамачандран:
Пара комментариев по поводу OSA и NIV. Исследование показало, что использование Boussignac CPAP у пациентов с патологическим ожирением помогает предотвратить значительную десатурацию после экстубации, если его применять сразу после экстубации с лицевой маской.Mokhlesi et al за последние несколько месяцев показали некоторые интересные данные по апноэ во сне; риск повторной интубации в 3–5 раз выше, чем при апноэ без сна, согласно общенациональной стационарной выборке. Они показали, что уровень их смертности значительно ниже, чем у тех пациентов, у которых развилась дыхательная недостаточность без нарушения дыхания во сне, и стоимость лечения также ниже. Это действительно удивительно. Таким образом, их острая потребность в послеоперационном вмешательстве на дыхательных путях увеличивается, но их общий респираторный риск на самом деле ниже.Так что я думаю, что история апноэ во сне имеет несколько нюансов; Я не думаю, что это так просто, как мы думаем. Наконец, я провел ретроспективный анализ 3 более чем на 1000 случаев. Мы наблюдали 8 случаев пневмоторакса; Я не ожидал этого, когда рассматривал наши дела. У нас также была очень высокая частота отказов при замене трубки в описанных вами сценариях. Частота неудач повторной интубации при замене трубки была в целом близка к 10%, особенно с двухпросветной трубкой, но у пациентов, у которых мы оставляли ее на различные периоды времени после операции, частота неудач при повторной интубации составляла 20%. % в нашем населении.Вы упомянули о мерах предосторожности при использовании катетеров для воздухообмена, и я думаю, что существуют некоторые соображения безопасности пациента, которые, вероятно, имеют первостепенное значение.
Хагберг:
Определенно, прежде чем использовать катетер для воздухообмена для повторной интубации или оксигенации, вы должны подтвердить, что вы действительно находитесь в трахее. Это один из самых важных моментов, который следует помнить при его использовании, поэтому у вас будет больше шансов на успех. Я не знаю, упоминали ли вы в своем исследовании, что когда вы собираетесь использовать его для повторной интубации или оксигенации / вентиляции, вы подтверждаете его правильное размещение.Я думаю, что это одна из самых важных вещей, которую нужно выяснить: глубина ее размещения, а также правильность размещения в трахее. Часто они случайно удаляются или оказываются в неправильном месте. Имеются сообщения о разрыве желудка с использованием инсуффляции O 2 через это устройство, даже небольшого количества O 2 . Я обычно не использую его для оксигенации, если он мне не нужен для вентиляции. Я думаю, вы абсолютно правы; струйная вентиляция сама по себе — сложный метод.Большинство из нас в этой комнате не делают это каждый день, и это чревато осложнениями. Поставщик должен знать, что он делает, правильный ли это пациент и есть ли у вас подходящее оборудование, много разных вещей, которые следует учитывать при использовании более инвазивных методов.
Рамачандран:
Внешний диаметр воздухообменного катетера Кука и ЭТТ [эндотрахеальная трубка] может быть одной из причин, почему повторная интубация затруднена. В этом сценарии у пациента с респираторным дистресс-синдромом будет меньше шансов принять трубку с обжимкой для рта.
Хагберг:
При использовании этих катетеров для воздухообмена я действительно рекомендую выполнять ларингоскопию во время процедуры. У меня была одна только вчера: как выяснилось, дыхательные пути были очень тяжелыми. Мы закончили тем, что использовали видеоларингоскоп McGrath для визуализации голосовой щели, так как мы увидели изображение 3 степени с помощью DL [прямой ларингоскопии]. VL [видеоларингоскоп] просто не позволял языку мешать во время обмена, потому что мы сначала вводили один просвет, а затем заменяли его на двухпросветную трубку.Я думаю, что это очень хороший момент для использования ларингоскопии, прямой или видео, поскольку вы переносите трубку через устройство для смены трубок.
Пусто:
Я хотел спросить Криш [Рамачандрана], Карина или кого-либо из других участников дискуссии: пользовались ли вы новым гибким обменником наконечников Cook?
Хагберг:
Я выполнил ранее упомянутый обмен с этим, потому что он более прочный и более длинный. Сначала мы попробовали педиатрический, потому что он был в комнате, но он не работал.Я использовал дополнительную твердость с клинком McGrath с изогнутым лезвием, и эта комбинация сработала хорошо.
Пусто:
Есть ли какие-либо объективные данные, свидетельствующие о том, что это безопаснее в отношении случаев пневмоторакса, о которых вы упомянули?
Рамачандран:
Мы не меняли предложение. Я думаю, что это связано с мыслью доктора Хагберга о том, что трудно убедиться, что вы сохраняете глубину. Это очень трудно. Трение этих разных трубок различно; смазывать их чревато, потому что тогда вы потеряете контроль.Ситуация плохая, дыхательные пути затруднены, и ты изо всех сил пытаешься вернуться. Я не думаю, что есть какие-то простые пути. Материальное улучшение могло бы стать шагом вперед. Если мы сможем создать катетеры для обмена дыхательных путей с чрезвычайно низким трением, возможно, это станет проще.
Хагберг:
Вы правы: диаметр обменного катетера, связанный с диаметром трубки, очень важен. Вот почему вы используете катетер Кука большего размера при известной замене трубок, а когда это пробная экстубация, я обычно использую катетер меньшего диаметра.
Пусто:
Что касается послеоперационного CPAP, был выявлен ряд потенциальных преимуществ. Мы знаем, что с кардиореспираторной точки зрения он может помочь улучшить систолическую функцию ЛЖ. Очевидно, что пациентам с СОАС он может быть показан в послеоперационном периоде. Также есть знаменательное исследование Squadrone et al 4 , которое показало, что пациенты общей хирургии после операции были рандомизированы для получения либо CPAP, либо высокопоточного O 2 через маску. Было отмечено резкое снижение риска повторной интубации в группе CPAP.Они объяснили этот эффект ателектазом. Мы знаем, что ателектаз — большая проблема в операционной. Многие анестезиологи не всегда это понимают, но это происходит очень быстро под общей анестезией и может быть связано с конкретными факторами риска пациента, такими как ожирение, но также связано с тем, как мы управляем вентиляцией и оксигенацией. Многим из этих пациентов с высоким риском может быть показан CPAP.
Наполитано:
Один комментарий об изменении, которое мы сделали пару лет назад в описанной вами популяции пациентов: известные проблемы с проходимостью дыхательных путей, ненормальный тест на утечку из манжеты, мы просто ждали еще один день, ждем еще один день, и это действительно увеличивает время интубации и механическая вентиляция.Теперь, в день ненормального теста на герметичность манжеты, мы сделаем бронхоскопию и посмотрим на гортань, и вы сможете решить, отек ли это и не слишком ли велика трубка. Вы действительно можете сказать, а затем составить план и определить, что нужно сделать. Я думаю, что эта практика обычно не используется.
Хагберг:
Вы правы, это не так. Я думаю, что в будущем это может быть больше, особенно при бронхоскопии; его так легко воткнуть.
Наполитано:
Теперь это часть нашего сложного алгоритма прохождения дыхательных путей.
Коллинз:
Понятно, что эти пациенты находятся в отделениях понижательной или интенсивной терапии. В связи с этим вы показали очень актуальный слайд, касающийся общения врача и персонала в отделениях открытого типа. Вероятно, логистически сложно определить, кто принимает это решение в таких подразделениях. Классическая ситуация: хирургическая бригада приходит и говорит: «Давайте экстубируем пациента сегодня». Я очень ценю этот слайд и считаю, что это важный момент.
Хагберг:
В моем случае та, которую я описал, была двухпросветной трубкой, и я сказал: «Мы собираемся оставить этого пациента интубированным и просто перейдем на однопросветную трубку», и хирург хмыкнул и корчился.На следующий день пациенту пришлось вернуться на операцию! Это тоже общение; нам нужно знать план, и если мы все не поговорим друг с другом, мы не узнаем, что делать. Так часто с передачей обслуживания в отделениях интенсивной терапии возникает недопонимание или отсутствие связи.
внеплановая экстубация — безопасность дыхательных путей
СТАТИСТИКА
1. Лукас да Силва и др. Незапланированная эндотрахеальная экстубация в отделении интенсивной терапии. Anesth Analg 2012; 114: 1003–14
2.ДеЛассенс А и др. Влияние незапланированной экстубации и повторной интубации после отлучения от груди на риск внутрибольничной пневмонии в отделении интенсивной терапии: проспективное многоцентровое исследование. Анестезиология. 2002; 97 (1): 148-56.
3. DeGroot RI, et al. Факторы риска и исходы после незапланированной экстубации в отделении интенсивной терапии: исследование случай-контроль. Critical Care, 2011, 15: R19
4. Dasta, et al. Ежедневная стоимость дня интенсивной терапии. Crit Care Med 2005 June 33 (6) 1266-71
5. Фишер Д.Ф. и др., Сравнение коммерческих и некоммерческих фиксирующих устройств для эндотрахеальной трубки.Респир. Забота, 2014. 59 (9): с. 1315-23.
6. Медицина, S.f.C.C. Статистика интенсивной терапии. 2017; Доступно по адресу: http://www.sccm.org/Communications/Pages/CriticalCareStats.aspx.
7. Moons, P., et al., Разработка инструмента оценки риска для преднамеренной самоэкстубации у пациентов интенсивной терапии. Intensive Care Med, 2004. 30 (7): p. 1348-55.
8. Needham, D.M. и П.Дж.Проновост, Важность понимания затрат на интенсивную терапию и механическую вентиляцию легких. Crit Care Med, 2005.33 (6): с. 1434-5.
9. Wunsch, H., et al., Работа в отделениях интенсивной терапии и использование аппаратов ИВЛ в США. Crit Care Med, 2013. 41 (12): с. 2712-9.
НАБОР ABCDEF
1. Барр, Дж. И др., Руководство по клинической практике лечения боли, возбуждения и делирия у взрослых пациентов в отделении интенсивной терапии. Crit Care Med, 2013. 41 (1): стр. 263-306.
2. Барр, Дж., Освобождение пациентов ОИТ от глубокой седации и механической вентиляции — обзор передовых методов, в ОИТ: Сила контроля боли, минимальной седации и ранней подвижности, С.Т. Балас М, Харгетт К., редактор. 2015, Общество интенсивной терапии.
3. Sneyers, B., et al., Предикторы недостаточного использования клиницистами суточного прерывания седативного эффекта и его шкал. J Crit Care, 2017. 38: с. 182–189.
4. Sneyers, B., et al., Что мешает нам следовать рекомендациям по седации в отделениях интенсивной терапии? Многоцентровое качественное исследование. J Crit Care, 2014. 29 (2): стр. 291-7.
5. Снейерс, Б. и др., Существующие практики и препятствия, мешающие врачам и медсестрам соблюдать рекомендации по анальгетической седации в отделении интенсивной терапии — национальное исследование.Crit Care, 2014. 18 (6): с. 655.
6. Таниос, М.А., и др., Предполагаемые препятствия для использования протоколов седации и ежедневного прерывания седации: мультидисциплинарный обзор. Журнал интенсивной терапии. 24 (1): с. 66-73.
7. Rubin, E. 2018.
8. Dale, C.R., et al., Улучшенный протокол обезболивания, седации и делирия, связанный с уменьшением продолжительности делирия и механической вентиляции. Анналы Американского торакального общества, 2014. 11 (3): с. 367-374.
ФАКТОРЫ, УВЕЛИЧИВАЮЩИЕ ИНЦИДЕНТЫ УП
1.да Силва PS, Fonseca MC. Незапланированная эндотрахеальная экстубация в отделении интенсивной терапии: систематический обзор, критическая оценка и рекомендации, основанные на фактах. Anesth Analg. 2012; 114 (5): 103-1014.
2. Макнетт М., Кербер К. Незапланированные экстубации в отделении интенсивной терапии: факторы риска и стратегии уменьшения нежелательных явлений. J Clin Outcomes Manag. 2015; 22 (7): 303-311.
3. Айдиган С., Нуртен К. Оценка риска незапланированной экстубации в отделении интенсивной терапии для взрослых. Dimension Crit Care Nurs.2017; 36 (1): 14/21.
4. де Гроот Р.И., Деккерс О.М., Герольд И.Х. и др. Факторы риска и исходы после незапланированной экстубации в отделении интенсивной терапии: исследование случай-контроль. Crit Care. 2011: 15 (1): R19
Паллиативная помощь в EMRA
Предоставление паллиативной помощи и помощи в конце жизни стало важным аспектом неотложной медицины; это стало особенно актуальным во время пандемии COVID-19. Меры по обеспечению комфорта и терминальная экстубация могут быть одними из самых важных процедур, которые вы выполняете во время смены.
Ближе к концу вашей смены СМП представляет 94-летнюю женщину, которую через неизвестный период времени обнаружили в своем доме соседи. Ей потребовалась интубация в полевых условиях фельдшером из-за депрессивного уровня сознания; ни семья, ни форма POLST не были доступны на месте происшествия. Ее жизненно важные показатели стабильны по прибытии, в анамнезе у нее была гипертония, ранее был ишемический инсульт и фибрилляция предсердий, принимавшая кумадин. Ее КТ показывает большое внутрипаренхиматозное кровоизлияние с внутрижелудочковым расширением и смещением средней линии.Бригады неотложной помощи, неврологии и нейрохирургии считают, что ее кровотечение имеет мало шансов на выздоровление. Обсуждение с ее детьми, которые подошли к постели, показало, что она не хотела получать агрессивное лечение или находиться на искусственной вентиляции легких в течение какого-либо периода времени. Принято решение о переходе на меры комфорта. Ваше отделение интенсивной терапии загружено на полную мощность, и вы принимаете пациентов в отделении неотложной помощи; поэтому вы принимаете решение о окончательной экстубации пациента в отделении неотложной помощи и переводе ее в службу паллиативной помощи.
Паллиативная помощь в ED
Паллиативная помощь — тема, вызывающая растущий интерес в EM. Более 50% гериатрических и 80% пациентов с метастатическим раком посещают отделение неотложной помощи в течение последних месяцев жизни. 1 Помимо обсуждения предварительных указаний, целей оказания помощи, форм POLST и услуг хосписа, обеспечение паллиативной помощи и помощи в конце жизни стало важным аспектом неотложной медицины. Поставщики медицинских услуг, вероятно, столкнутся с необходимостью окончательно экстубировать пациента в отделении неотложной помощи во время своей карьеры; это стало особенно актуальным в период пандемии COVID-19.Меры по обеспечению комфорта и терминальная экстубация могут быть одними из самых важных процедур, которые вы выполняете в течение своей смены.
Работа в команде и общение
Обсуждение целей оказания медицинской помощи и сообщение плохих новостей являются фундаментальными навыками для клинициста EM. После принятия решения о переходе на комфортную заботу эффективное общение с членами семьи становится ключом к пониманию их желаний и установлению ожиданий. Несколько исследований показали, что открытый и четкий диалог с семьями относительно желаний их родственников и лечения симптомов способствовал более высокому удовлетворению семьи во время ухода в конце жизни в отделениях интенсивной терапии. 2,3 Убедитесь, что вы подробно объяснили, какие действия будут выполнены, и объяснили признаки процесса умирания, которые могут заметить члены семьи. Подчеркните, что ваша команда будет внимательно следить за тем, чтобы пациенту было комфортно. Если возможно, подумайте о переводе пациента в отдельную палату в более тихую часть отделения, где больше места для членов семьи и близких. Можно рассмотреть табличку на двери, указывающую на необходимость уединения. Убедитесь, что медицинская бригада и респираторные терапевты осведомлены о плане и уделяют приоритетное внимание комфорту пациента и семьи.Подумайте о том, чтобы поговорить со службами донорства органов, социальными работниками и духовными специалистами, если этого требует семья, а также команда паллиативной помощи вашей больницы.
Подготовка пациента
Перед окончательной экстубацией подумайте о нескольких этапах подготовки пациента. Это будет последний раз, когда члены семьи смогут увидеть своего любимого живым. Поэтому сострадание и уважение к пациенту, семье и близким имеют первостепенное значение. Постарайтесь организовать комнату и обеспечить пациента достаточным количеством одеял и подушек.Отрегулируйте одежду или больничную одежду для пациента.
Неофициальные данные указывают на аспирацию и рвоту, которые иногда могут возникать в процессе терминальной экстубации: рассмотрите возможность декомпрессии содержимого желудка пациента с помощью назогастрального зонда, если он уже установлен. Бригада по уходу должна снять манжеты для измерения артериального давления, телеметрические провода и любые другие устройства для мониторинга в комнате; это обеспечивает спокойную обстановку для пациента и снижает дополнительный стресс для семьи. Если возможен только удаленный мониторинг, поставщики медицинских услуг могут рассмотреть возможность оставить только пальцевую пульсоксиметрию для отслеживания формы волны / пульса на телеметрии, чтобы зафиксировать время смерти.Если ожидается длительный курс лечения и он не причинит дискомфорта пациенту, мочевые катетеры могут оставаться на месте по усмотрению врача и семьи; презервативы-катетеры можно рассматривать у пациентов мужского пола как менее назойливый вариант. Уход за ранами у пациентов с травматическими повреждениями должен быть ограничен, чтобы ограничить запах и дренаж и сохранить достоинство пациента.
Если пациент принимает вазопрессоры, внутривенно вливание жидкостей или получает какое-либо другое непаллиативное вмешательство, их следует прекратить до терминальной экстубации.У пациентов с автоматическими имплантируемыми кардиовертер-дефибрилляторами (AICD) функция дефибриллятора должна быть отключена с помощью кольцевого магнита, а вспомогательные устройства для левого желудочка (LVAD) могут быть отключены от источника батареи или блока контроллера трансмиссии. В зависимости от рекомендаций вашего штата и состояния пациента эндотрахеальные трубки (ЭТТ) и доступ для внутривенного вливания должны оставаться на месте до проведения оценки в офисе местного коронера. Прекращение поддерживающего жизнь лечения может быть отложено для достижения надлежащего и упреждающего лечения симптомов.Поставщик должен рассмотреть возможность отсрочки прекращения оказания помощи в связи с прибытием семьи или духовными обрядами, но это не должно чрезмерно продлевать страдания пациента.
Лекарства
До терминальной экстубации медработники должны активно лечить любые симптомы, которые испытывает пациент, а также предвидеть симптомы, которые могут возникнуть после экстубации. Опиоиды, бензодиазепины и холинолитики являются краеугольными камнями фармакотерапии умирающего пациента. Соответствующее, раннее и частое повторное дозирование является ключом к тому, чтобы пациент чувствовал себя комфортно во время процесса умирания.
Опиоиды играют большую роль в паллиативной помощи при лечении боли и одышки. Морфин является основой паллиативной помощи, но медработники также могут использовать гидроморфон или фентанил (Таблица 1). Болюсное введение морфина пациентам, ранее не принимавшим опиоиды, обычно начинается с 0,1 мг / кг внутривенно для обезболивания или 0,05 мг / кг внутривенно при воздушном голоде. 4 Это следует повторять каждые 15-30 минут для достижения желаемого эффекта. Пациентам, постоянно принимающим опиоиды, могут потребоваться значительно более высокие дозы. 5 Поддержание адекватных уровней в сыворотке может быть достигнуто с помощью инфузий, препаратов длительного действия или повторного дозирования. Настои особенно полезны для облегчения титрования. Например, инфузия морфина в дозе 2 мг / час и 2 мг внутривенно каждые 15 минут при внезапной боли или RR> 18 с увеличением скорости на 1 мг / час, если 3 или более PRN используются в течение одного часа, является одним из широко используемых подходов. 4 Может потребоваться титрование доз до 10 мг / час или более, особенно у пациентов с хроническим употреблением опиоидов или тяжелой дыхательной недостаточностью. 5
Поставщики медицинских услуг могут быть обеспокоены использованием опиоидов для ухода за пациентами, нуждающимися в комфортной помощи, из-за теоретического эффекта подавления дыхательного влечения и, таким образом, ускорения смерти. В паллиативной помощи это называется «двойным эффектом». Медицинские работники имеют юридический и этический мандат на обеспечение надлежащего комфорта в качестве основной цели, даже если это может ускорить смерть пациента в качестве побочного эффекта. 4 Однако есть свидетельства того, что при титровании опиоидов для субъективного респираторного комфорта они существенно не изменяют PaCO2, PaO2 или общую выживаемость. 6 Фактически, должным образом повышенная доза морфина ассоциировалась с отсутствием изменений или с увеличением времени до смерти. 5, 7 Однако опиоиды, безусловно, не являются доброкачественными препаратами, и медработники должны быть готовы справляться с побочными эффектами, включая реакцию на гистамин и тошноту.
Пациенты, приближающиеся к концу жизни, также могут испытывать беспокойство и / или делирий. Основа лечения будет включать бензодиазепины и нейролептики (таблица 1). 4 Эти лекарства необходимо будет титровать для достижения значительного эффекта в эффективных дозах из-за многих факторов, включая возраст, пол, функцию почек / печени и предшествующее воздействие этих лекарств.Сопутствующие заболевания и прогноз пациента могут повлиять на ваш выбор лекарств, например, использование лоразепама для пациентов с нарушением функции печени или мидазолама, когда приоритетом является более быстрое начало заболевания.
Некоторые пациенты могут испытывать тошноту или рвоту и особенно подвержены риску после экстубации и приема опиоидов. Ондансетрон — это обычно назначаемое противорвотное средство, которое может быть особенно эффективным у пациентов, получающих химиотерапию. Дексаметазон также может облегчить тошноту, связанную с применением химиотерапии. 8 Следует рассмотреть возможность применения метоклопрамида, если предполагается, что гастропарез или компрессия желудка способствуют этому. 8 Наконец, антагонисты дофамина могут быть эффективными при рефрактерной тошноте. 8
Секреции обычно вызывают беспокойство членов семьи и близких из-за характерного предсмертного хрипа. 9 Антихолинергические средства могут быть предоставлены для уменьшения выработки секреции с гликопирролатом и скополамином, демонстрируя эквивалентную эффективность. 10 Эти лекарства только ограничивают выработку новой секреции, поэтому им может потребоваться время, чтобы эффективно показать изменение симптомов. Ключевым моментом является частое нежное всасывание. Офтальмологические капли с атропином действуют быстро и могут вводиться перорально, если внутривенный доступ невозможен или кожа пациента не поддается наложению пластырей. 10 (таблица 1)
При выборе лекарств для оказания симптоматической помощи и подготовки к терминальной экстубации медработники ЭМ должны учитывать начало действия, период полувыведения и дозировку.В отличие от пациентов, которые были госпитализированы на несколько часов или дней, пациенты, поступающие в отделение неотложной помощи, еще не получали предшествующего лечения или не достигли терапевтического уровня. Обычно необходим начальный болюс с последующей инфузией или лекарствами длительного действия. Повышение гибкости ваших заказов с помощью титрования и / или PRN позволит вашей команде удовлетворить потребности пациентов в условиях, когда пациенты должны будут часто проходить повторную оценку. Наличие дополнительных доз PRN у постели больного во время процесса экстубации может помочь избежать задержек в лечении.Внутривенные лекарства предпочтительнее из-за более быстрого начала и простоты титрования. Если внутривенный доступ недоступен, поставщики могут рассмотреть возможность введения определенных лекарств через щечную, назальную, подкожную, пероральную или внутримышечную терапию. (Таблица 1) Медицинская бригада должна внимательно следить за пациентом на предмет признаков дистресса, включая сжатие кулаков, слезы, гримасу, тахикардию, потоотделение, тахипноэ, использование дополнительных мышц и расширение носа. Стандартизированные оценочные шкалы, такие как оценка седативного воздействия-возбуждения (SAS) или шкала седативного действия Рамсея (RASS), могут предоставить дополнительные данные.Некоторые рекомендации обычно не рекомендуют кетамин из-за опасений возникновения реакций. 11-14 Паралитические агенты во время терминальной экстубации не рекомендуются, поскольку они могут затруднить медицинскую бригаду возможность оценить пациента на предмет наличия признаков дистресса и без необходимости ускорить процесс смерти. 11-14 Пропофол может рассматриваться как седативное / анксиолитическое средство и обладает противорвотными свойствами. 13
Терминальная экстубация
После того, как пациент получил адекватное лечение и прекращены другие меры по поддержанию жизни, его можно рассматривать для терминальной экстубации.Существует два основных метода снятия пациента с аппарата ИВЛ — терминальная экстубация и терминальное отлучение — каждый с различными показаниями и результатами. 4,11,13,17-20 Терминальная экстубация (без медленного снижения респираторной поддержки) может быть рассмотрена у пациентов без значительного респираторного нарушения (например, у тех, кто интубирован по поводу депрессии ГКС) и все еще имеет рвотный рефлекс. Терминальное отлучение предпочтительнее, когда есть опасения по поводу респираторной недостаточности (например, ОРДС, отека легких, ХОБЛ).
Для выполнения терминального отлучения пациенты должны быть переведены в режим IMV или PS, а затем должны иметь ступенчатое снижение FiO2 до 40% и PEEP до 5 см H 2 О. При каждом понижении пациент следует повторно оценить признаки недостатка воздуха или возбуждения и получить соответствующие болюсные дозы и титрование инфузий в соответствии с симптомами. RSBI (индекс быстрого обмеления дыхания: частота дыхания, деленная на дыхательный объем) может использоваться для определения уровня дистресса. 4 Терминальное отлучение обычно длится 10-60 минут в зависимости от пациента. 4,12 После того, как параметры аппарата искусственной вентиляции легких были отменены и симптомы пациента устранены, поставщик может рассмотреть возможность экстубации пациента. Если во время отлучения от груди или удаления ЭТТ ожидается неминуемая потеря проходимости дыхательных путей или значительный респираторный дистресс-синдром, в нескольких рекомендациях предлагается проактивный, скорее реактивный подход с использованием агрессивной паллиативной седации. 4,12
При выполнении экстубации приготовьте аспирацию, выключите сигнализацию вентилятора и, если возможно, попросите врача-респираторного терапевта у постели больного.Во время экстубации подумайте о том, чтобы накрыть грудь пациента впитывающими подушечками, чтобы предотвратить попадание секрета и крови на халат. Поставщикам услуг следует подумать о ношении СИЗ в зависимости от обстоятельств, поскольку это может привести к образованию аэрозолей. После отключения аппарата ИВЛ инструкции по снятию ЭТТ различаются. 11,13,18 Многие поставщики услуг удаляют ЭТТ для удобства пациентов и по семейным просьбам. Однако в некоторых случаях, таких как массивное кровохарканье, серьезная травма лица, значительные выделения или опухший язык, пациенту может быть удобнее держать ЭТТ на месте с помощью тройника и увлажненного воздуха.Если ожидается появление стридора или его обнаружение после экстубации, медицинские работники могут назначить небулайзерный адреналин или стероиды, такие как метилпреднизолон, для облегчения симптомов (таблица 1). 11,21 Как правило, в руководствах не рекомендуется переходить на неинвазивную вентиляцию легких после экстубации. 14
Установление ожиданий
Члены семьи могут узнать, сколько времени займет процесс умирания и какие симптомы могут возникнуть. Ответить на эти вопросы может быть сложно, но важно предвидеть лечение симптомов, ожидания семьи и расположение.В среднем пациенты ОИТ выживают от 35 минут до 7,5 часов после терминальной экстубации. 11 Медицинские работники должны уметь распознавать ключевые симптомы, требующие вмешательства у умирающего пациента. Наиболее частые симптомы, требующие вмешательства, включают усталость (28,7%), боль (22,1%) и респираторный дистресс (22,1%). 22 Несколько исследований показали, что медицинским работникам сложно точно предсказать время выживания отдельных пациентов после экстубации. 11,22,23 Предсмертный хрип (звук скопления секрета в гипофаринксе и бронхиальном дереве), дыхание с движением нижней челюсти, дыхание Чейна-Стокса и цианоз конечностей являются обычными симптомами у умирающего пациента, однако ни один из них не является специфическим прогнозирующим. о неминуемой смерти (можно отметить от нескольких часов до нескольких дней до смерти) или использовать для точного прогнозирования продолжительности выживания. 24 Другие факторы, такие как оценка по шкале GCS, SpO 2 , а также количество и продолжительность необходимой седации / анальгезии, также не были определены для прогнозирования времени смерти. 11 Поставщикам услуг важно сообщать об этих неопределенностях семьям при установлении ожиданий.
Улучшение процесса
Оказание медицинской помощи в конце жизни в отделении неотложной помощи — важный навык для поставщиков медицинских услуг. Модель клинической практики ABEM включает паллиативную помощь как неотъемлемую часть обучения в ординатуре. 25 В программах следует рассмотреть возможность включения дидактических занятий и имитационного моделирования в дискуссии о конце жизни и экстубации в терминальной стадии. Резиденты могут продолжать совершенствовать эти навыки и процессы в своих отделениях, проводя специальное обучение для других резидентов, медсестер и вспомогательного персонала ED, обсуждая руководящие принципы с руководством отделения и проводя разбор полетов после индивидуальных случаев. Существует несколько руководств, на которые могут ссылаться поставщики. 12,13,26,27 Паллиативная помощь, и особенно процесс терминальной экстубации, непросто изменить.Переход от ведения тяжелобольного пациента к применению комфортного ухода требует больших затрат для пациентов, их семей и медицинских бригад. Четкое общение, создание подходящей среды, агрессивное лечение симптомов и понимание концепций терминальной экстубации помогут обеспечить сострадательный и достойный процесс для ваших пациентов и их семей.
Решение по делу
После обсуждения плана с семьей пациента и медсестрой вы переводите пациента в отдельную палату, предназначенную для ухода за пациентами в конце его жизни.Медсестра вводит болюсную дозу и инфузию морфина. Как только ваш пациент почувствует себя комфортно, респираторный терапевт окончательно экстубирует его. Вы и медсестра часто повторно осматриваете пациента на предмет дополнительных доз лекарств PRN и осторожного отсасывания по мере необходимости. После наблюдения в течение 40 минут и проверки с семьей у вашего пациента по-прежнему слабый пульс и SpO2 около 84%. Вы обсуждаете это с командой паллиативной помощи, которая принимает ее к себе на службу. Ваша пациентка мирно скончалась 6 часов спустя вместе со своей семьей у постели больного.
Пункты выдачи
- При переводе пациента на комфортный уход и выполнении терминальной экстубации в отделении неотложной помощи поддерживайте открытое и четкое общение с пациентом, его семьями, медсестрой и вспомогательным персоналом.
- Важно установить сцену. Создайте личное пространство, выключите мониторы и избегайте ненужных процедур, чтобы отразить уважение и сострадание, которых заслуживает эта ситуация.
- Знайте и внимательно следите за симптомами, связанными с процессом умирания.Соответствующие лекарства, такие как опиаты, бензодиазепины и холинолитики, следует давать раньше и по мере необходимости.
- Ознакомьтесь с процессом терминальной экстубации. Понимание подготовительных этапов и постэкстубационного ухода имеет важное значение для обеспечения комфортного, сострадательного и достойного процесса для вашего пациента. Обучение и установление руководящих принципов для отдела могут помочь облегчить этот трудный процесс.
ССЫЛКИ
1.Обермейер З., Кларк А.С., Макар М., Шур Дж. Д., Катлер Д.М. Использование неотложной медицинской помощи и льготы по программе Medicare Hospice для больных раком с плохим прогнозом. Американское гериатрическое общество. 2016; 64 (2): 323-29.
- Gerstel E, Engelberg RA, Koepsell T, Curtis JR. Продолжительность прекращения жизнеобеспечения в отделении интенсивной терапии и связь с удовлетворением семьи. Американский журнал респираторной медицины и реанимации. 2998; 178 (8): 798-804.
- Hinkle LJ, Bosslet GT, Torke AM.Факторы, связанные с удовлетворенностью семьи уходом в конце жизни в отделении интенсивной терапии. Сундук . 2015; 147 (1): 82-93.
- Wang D, Creel-Bulos C. Системный подход к переходу на комфортную медицинскую помощь в отделении неотложной помощи. J из Emerg Med. 2019; 56: 267-74.
- Mazer, MA. Инфузия опиоидов при терминальной отмене ИВЛ в отделении реанимации. Журнал по лечению боли и симптомов. 2011; 42 (1): 44-51.
- Clemens KE, Klaschik E. Симптоматическая терапия одышки сильными опиоидами и ее влияние на вентиляцию легких у пациентов паллиативной помощи. J Устранение болевых симптомов . 2007; 33: 473-81.
- Сайкс Н., Торнс А. Использование опиоидов и седативных средств в конце жизни. Ланцет Онкол. 2003; 4: 312-18
- Залински Р.Дж., Зимми Э. Паллиативная помощь. Неотложная медицина Тинтиналли: комплексное учебное пособие, 8e.Нью-Йорк, штат Нью-Йорк: Макгроу-Хилл. 2016.
- Серый г. Использование антихолинергических средств для управления терминальными секрециями. Доказательства имеют значение . 2007; 1 (3).
- Kintzel PE, Chase SL, Thomas W, Vancamp DM, Clements EA. Антихолинергические препараты для лечения шумного дыхания у взрослых пациентов хосписа. Am J Health Syst Pharm. 2009; 66: 458-64.
- Кэмпбелл М.Л. Как отменить ИВЛ: систематический обзор литературы. AACN Adv Crit Care .2007; 18 (4): 397-403.
- Kompanje EO, Ван дер Ховен Б., Баккер Дж. Ожидание дистресса после прекращения ИВЛ в отделении интенсивной терапии в конце жизни. Медицина интенсивной терапии. 2008; 34 (9): 1593-1599.
- Truog RD, Кэмпбелл ML, Curtis JR, Haas Ce, Luce JM, Rubenfeld GD, Rushton CH, Kaufman DC. Рекомендации по уходу в конце жизни в отделении интенсивной терапии: согласованное заявление Американского колледжа реаниматологии. Медицина интенсивной терапии .2008; 36 (3): 953-63.
- Downar J, Delaney JW, Hawryluck L, Kenny L. Руководство по отмене мер жизнеобеспечения. Медицина интенсивной терапии. 2016; 42 (6): 1003-17.
- Lexi-Drugs. Lexicomp. Wolters Kluwer Health, Inc. Хадсон, Огайо. Доступно по адресу: http://online.lexi.com. По состоянию на 18 апреля 2020 г.
- Thomas E. Безопасность и эффективность атропина при гиперсекреции слюны. Пост Ро Чи . 2012; 2 (2) ноября: 8-9.
- Телье Д., Деланной П.Я., Робино О., Мейбек А., Баусеки Н., Чиче А., Лерой О., Жорж Х.Сравнение терминальной экстубации и терминального отлучения от искусственной вентиляции легких у пациентов в отделении интенсивной терапии. Minerva Anestesiologica. 2017; 83 (4): 375-82.
- Rubenfeld GD. Принципы и практика отмены жизнеобеспечивающего лечения. Клиники интенсивной терапии. 2004; 20 (3): 435-51.
- Роберт Р., Ле Гуж А., Кентиш-Барнс Н., Коттеро А., Жиро Б., Адда М. и др. Окончательное отлучение от груди или немедленная экстубация для отмены ИВЛ у тяжелобольных пациентов. Медицина интенсивной терапии. 2017; 43 (12): 1793-807.
- Кэмпбелл М.Л., Бизек К.С., Тилль М. Реакции пациентов во время быстрого окончательного отлучения от ИВЛ: проспективное исследование. Медицина интенсивной терапии. 1999; 27 (1): 73-7.
- Cheng KC, Hou CC, Huang HC. Внутривенное введение метилпреднизона снижает частоту возникновения постэкстубационного стридора у пациентов интенсивной терапии. Медицина интенсивной терапии. 2006; 34 (5): 1345-50.
- Кларк К., Коннолли А., Клэпхэм С., Куинси К., нетерпеливый К., Карроу, округ Колумбия.Были диагностированы физические симптомы на момент смерти: последовательное когортное исследование для описания распространенности и интенсивности проблем, с которыми сталкиваются неизбежно умирающие пациенты паллиативной помощи, с указанием диагноза и места оказания помощи. Журнал паллиативной медицины. 2016; 19 (12).
- Селби Д., Чакраборти А., Лилиен Т., Стейси Е., Чжан Л., Майерс Дж. Точность клинициста при оценке продолжительности выживания: роль состояния пациента и прогностические категории, основанные на времени. Журнал по лечению боли и симптомов. 2011; 42 (2): 578-88.
- Морита Т., Итики Т., Цунода Дж., Иноуэ С., Чихара С. Перспективное исследование процесса умирания неизлечимо больных раком. Американский журнал хосписной и паллиативной медицины. 1998; 15 (4): 217-22.
- Советник Флорида, Бабу К., Иденс М.А., Горгас Д.Л., Хобгуд С. и др. Модель клинической практики экстренной медицины 2016 г. Журнал неотложной медицины. 2017 июн 1; 52 (6): 846-9.
- О’Махони С., МчХью М., Заллман Л., Селвейн П.Удаление вентилятора: процедуры и результаты: отчет о сотрудничестве между отделением интенсивной терапии и службой паллиативной помощи. Журнал по лечению боли и симптомов. 2003; 26 (4): 954-61.
- Sedillot N, Holzapfel L, Jacquet-Francillon T, Tafaro N, Eskandanian A, et al. Пятиступенчатый протокол приостановки и прекращения жизнеобеспечения в отделении неотложной помощи: обсервационное исследование. Европейский журнал неотложной медицины.

 Продолжить доставку кислорода маской до полного восстановления пациента
Продолжить доставку кислорода маской до полного восстановления пациента Ответная реакция со стороны дыхательных путей (например, кашель, срыгивание или изменение характеристик дыхания) свидетельствуют о неадекватности глубины и потребности в углублении анестезии
Ответная реакция со стороны дыхательных путей (например, кашель, срыгивание или изменение характеристик дыхания) свидетельствуют о неадекватности глубины и потребности в углублении анестезии