Бесцветный газ с резким запахом нашатырного спирта: Аммиак — Инструкция по поведению в случае химической аварии
Аммиак и его воздействие на организм человека
Аммиак в переводе с греческого (hals ammoniakos) — амонова соль. Аммиак — бесцветный газ с резким запахом, температура плавления — 80° С, температура кипения — 36° С, хорошо растворяется в воде, спирте и ряде других органических растворителей. Синтезируют из азота и водорода. В природе образуется при разложении азотсодержащих органических соединений.
Чистый аммиак был получен английским химиком и философом Джозефом Пристли в 1774 году. Промышленную технологию получения аммиака разработали и осуществили в 1913 году немецкие химики Фриц. Габер и Карл Бош, получившие за свои исследования Нобелевские премии.
Аммиак — один из самых важных продуктов химической промышленности. Большая часть получаемого в промышленности аммиака идет на приготовление азотной кислоты, азотных удобрений, красителей. Применяется аммиак и для получения взрывчатых веществ. Широко используются водные растворы аммиака. Как слабое летучее основание, он применяются в химических лабораториях и производствах. С помощью аммиака получают пищевую соду.
С помощью аммиака получают пищевую соду.
В медицине 10% водный раствор аммиака известен как нашатырный спирт. Резкий запах аммиака раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров, поэтому при обморочных состояниях или алкогольном отравлении пострадавшему дают вдыхать пары нашатырного спирта.
При пайке металлов используют хлорид аммония — нашатырь — Nh5Сl. При высокой температуре нашатырь разлагается с образованием аммиака, который очищает поверхности паяльника и спаиваемого изделия от оксидов металлов.
При испарении жидкого аммиака поглощается большое количество теплоты, поэтому его используют в холодильных установках.
Аммиак используется для охлаждения каналов энергоснабжения Международной космической станции (МКС), которые обеспечивают МКС электричеством.
На станции есть два независимых аммиачных контура охлаждения, которые отводят тепло от охлаждаемого водой внутреннего оборудования, а также от электрических приборов, установленных на внешней поверхности МКС.
Жидкий аммиак вызывает сильные ожоги кожи, поэтому его обычно перевозят в стальных баллонах (окрашены в желтый цвет, имеют надпись «Аммиак» черного цвета), железнодорожных и автомобильных цистернах, по воде — в специальных танкерах, транспортируют также по трубопроводам.
Смесь аммиака с воздухом взрывоопасна. Аммиак горит при наличии постоянного источника огня. Емкости могут взрываться при нагревании.
Газообразный аммиак является токсичным соединением. При его концентрации в воздухе рабочей зоны около 350 мг/куб. м (миллиграмм на кубический метр) и выше работа должна быть прекращена, а люди выведены за пределы опасной зоны. Предельно допустимая концентрация аммиака в воздухе рабочей зоны равна 20 мг/куб. м.
Аммиак опасен при вдыхании. При остром отравлении аммиаком поражаются глаза и дыхательные пути, при высоких концентрациях возможен смертельный исход. Вызывает сильный кашель, удушье, при высокой концентрации паров — возбуждение, бред. При контакте с кожей — жгучая боль, отек, ожег с пузырями. При хронических отравлениях наблюдаются расстройство пищеварения, катар верхних дыхательных путей, ослабление слуха.
При хронических отравлениях наблюдаются расстройство пищеварения, катар верхних дыхательных путей, ослабление слуха.
При отравлении аммиаком необходимо принять следующие меры:
Первая медицинская помощь: промыть глаза и лицо водой, надеть противогаз или ватно-марлевую повязку, смоченную 5% раствором лимонной кислоты, открытые участки кожи обильно промыть водой, немедленно покинуть очаг заражения.
При попадании аммиака в желудок надо выпить несколько стаканов теплой воды с добавлением одной чайной ложки столового уксуса на стакан воды и вызвать рвоту.
Индивидуальная защита: изолирующий и фильтрующие противогазы марок М, КД, респиратор РПГ-67КД, при их отсутствии — ватно-марлевая повязка, смоченная 5% раствором лимонной кислоты, защитный костюм, резиновые сапоги, перчатки.
Зону поражения необходимо изолировать. В зону аварии входить только в полной защитной одежде.
При утечке и разливе: устранить источники открытого огня. Устранить течь. Для осаждения газов использовать распыленную воду.
Оповестить об опасности отравления местные органы власти. Эвакуировать людей из зоны, подвергшейся опасности заражения ядовитым газом. Не допускать попадания вещества в водоемы, тоннели, подвалы, канализацию.
При пожаре: убрать из зоны пожара, если это не представляет опасности, и дать возможность догореть. Не приближаться к горящим емкостям. Охлаждать емкости водой с максимального расстояния. Тушить распыленной водой, воздушно-механической пеной с максимального расстояния.
Материал подготовлен на основе информации РИА Новости и открытых источников
— Брянская городская администрация
ОТКЛЮЧИТЬ
ИНВЕРСИЯ
СИНИЙ
Ч/Б
A
A
A
Сегодня 4 Апреля 2023. В Брянске
Версия для слабовидящих | Мобильная версия
Брянская городская администрация
Бежицкий район
Советский район
Фокинский район
Володарский район
Бежицкий район
Адрес администрации:
241035, г. Брянск, ул. Комсомольская, 15
Комсомольская, 15
Телефон: (4832) 30-81-55
Сайт: http://bezhadm.ru/
Советский район
Адрес администрации:
241050, г. Брянск, ул. Карла Маркса, д. 10
Телефон: (4832) 74-27-95
Сайт: https://sovadm32.ru/
Фокинский район
Адрес администрации:
241020, г. Брянск, ул. Челюскинцев, д. 4
Телефон: (4832) 63-14-07
Сайт: http://fokinka32.ru/
Володарский район
Адрес администрации:
241022, г. Брянск, пер. Волгоградский, д. 1
Телефон: (4832) 26-15-21
Сайт: http://vol-adm-bryansk.ru/
Справочник горожанина
Город сегодня
Нужное/Полезное
Правила жизни
- Детям и родителям о правилах безопасности на воде в летний период
- Детям о правилах обращения с огнём
- Как избежать травматизма: памятка жителям
- Как правильно спасаться от жары?
- Методические материалы для населения в случае возникновения ЧС
- Механическая асфиксия у детей до 1 года
- О безопасности использования объектов газового хозяйства
- О выплате денежного вознаграждения гражданам за добровольную сдачу незаконно хранящегося оружия
- О пожарной безопасности
- О правилах безопасности на льду водоёмов
- О правиле «золотого часа»
- Осторожно, гололёд!
- Осторожно, ледостав!
- Осторожно, мошенники!
- Осторожно: клещи!
- Осторожно: ребёнок может выпасть из окна!
- Памятка для инвалидов по слуху о возможных способах обращения в экстренные службы
- Памятка для населения при обморожении
- Памятка для родителей о воспитании ребёнка
- Памятка населению о мерах пожарной безопасности в весенне-летний период
- Памятка о выявлении наркопритонов в жилом секторе
- Памятка о действиях при угрозе теракта или возникновении ЧС
- Памятка о мерах пожарной безопасности во время отопительного сезона
- Памятка о мерах пожарной безопасности при устройстве и проведении новогодней ёлки
- Памятка по правилам поведения при опасности возникновения и возникновении террористического акта
- Памятка юным велосипедистам
- Памятки населению в случае выявления нахождения беспилотных воздушных судов
- Пожарная безопасность в жилых помещениях
- Порядок действия населения по сигналу «Внимание всем!»
- Порядок перехода проезжей части по нерегулируемому переходу
- Правила безопасного поведения на объектах железнодорожного транспорта
- Правила безопасности при катании с горок
- Правила поведения в лесу
- Правила поведения при грозе, ливнях, граде и сильном ветре
- Правила проезда железнодорожных переездов для водителей
- Проверь ягоды и грибы на безопасность!
- Рекомендации намеревающимся посетить купель
- Родители: пренебрежение детьми правилами поведения на воде приведет к трагедии!
- Родителям и детям о правилах дорожного движения
- Сжигание сухой травы грозит пожарами
- Соблюдать безопасность на воде
- Советы от МЧС при пожаре в общественном месте
- Уроки газовой грамотности
- Что делать, если произошел пожар?
Газ Nh4 и его датчик
Введение в аммиак
Газообразный аммиак представляет собой химическое соединение, состоящее из одного атома азота и трех атомов водорода с формулой Nh4. В чистом виде аммиак представляет собой бесцветный газ, но его легко определить по запаху, так как он имеет резкий запах. Аммиак обычно встречается в виде газа, который является едким и вредным при длительном воздействии, требующем разрешения на опасную безопасность.
В чистом виде аммиак представляет собой бесцветный газ, но его легко определить по запаху, так как он имеет резкий запах. Аммиак обычно встречается в виде газа, который является едким и вредным при длительном воздействии, требующем разрешения на опасную безопасность.
Газообразный аммиак обычно используется при производстве удобрений, хладагентов и чистящих растворов, однако вы, скорее всего, почувствуете его запах задолго до того, как он станет для вас вредным. Степень опасности, которую представляет газообразный аммиак, значительно варьируется в зависимости от его количества и продолжительности воздействия.
Промышленное производство аммиака является одним из самых высоких для неорганических химикатов с многочисленными крупными заводами по производству аммиака по всему миру, производящими 235 миллионов тонн в 2021 году. Это в основном осуществляется с помощью процесса Габера, искусственного процесса фиксации азота, в котором водород используется в качестве катализатора.
Характеристики газа
- Бесцветный
- Состояние газа
- Сжатый
- Токсичный
- Легковоспламеняющийся
- Коррозионный
- Легче воздуха
- Водорастворимый
- Взрывоопасно (при высоких концентрациях и в замкнутом пространстве)
- Резкий удушливый запах
- Может разлагаться при высоких температурах с образованием легковоспламеняющегося газообразного водорода
- Удобрения на основе аммиака и управление сельскохозяйственными угодьями могут вызывать выбросы закиси азота.
- Молекулы аммиака имеют форму треугольной пирамиды
- ДРУГИЕ НАЗВАНИЯ: Аммиак безводный, аммиак, азан, нитрид водорода
- КАС 7664-41-7
Промышленное обнаружение Nh4, опасности и источники
- Фермы : Аммиак, производимый компостными кучами на грибных фермах, может образовывать газообразный аммиак. Навозные ямы и любые закрытые или замкнутые пространства, где содержатся сельскохозяйственные животные, также могут содержать газообразный аммиак.

- Обработка воды : Аммиак используется для производства монохлорамина, который используется в качестве дезинфицирующего средства.
- Холодильные системы : Катки, пивоваренные заводы / заводы по производству напитков и заводы по производству льда используют жидкий аммиак / водный раствор аммиака — Nh4(aq). Если он протекает, он становится газообразным аммиаком.
- Удобрения и чистящие средства : Жидкий аммиак часто разбавляют и смешивают с другими химическими веществами.
- В некоторых производственных процессах также используется аммиак, в том числе его объединение с HCl или соляной кислотой для получения хлорида аммония.
- Может подвергаться воздействию аммиака при использовании чистящих средств, содержащих аммиак.
- Другие источники профессионального облучения включают серебрение зеркал, производство клея, дубление кожи и азотирование печей.
- Аммиак получают как побочный продукт при перегонке угля и воздействии пара на цианамид кальция, а также при разложении азотистых материалов.

- Аммиак естественным образом производится из соевых бобов, семян примулы вечерней, ягненка и листьев табака.
Количество утечек аммиака увеличивается из-за более широкого использования природных хладагентов по сравнению с фторсодержащими газовыми аналогами.
(Новости технологического оборудования и управления)
Сценарии высокого риска
- Более теплые здания могут производить аммиак в более высоких концентрациях, чем холодные здания.
- В замкнутом пространстве аммиак может взорваться при попадании источника воспламенения.
- Если не считать случайного выброса аммиака, вероятность воздействия высоких концентраций аммиака максимальна при входе в замкнутое пространство.
- С технической точки зрения, в тот момент, когда рабочий ломает плоскость отверстия, он фактически входит в замкнутое пространство, и когда речь идет об аммиаке, рабочие должны исходить из того, что замкнутое пространство представляет собой опасную среду.

- В случае утечки или процедуры CSE было бы ошибкой полагать, что отчетливый запах аммиака послужит адекватным предупредительным сигналом.
- могут измерять концентрацию аммиака и быстро предупреждать рабочих об изменениях качества воздуха.
Детекторы газа
Вопросы по обнаружению Nh4?
СВЯЖИТЕСЬ С НАМИ
Особые области применения и соображения
- Медленно движущаяся вода : Медленно движущаяся или стоячая вода может иметь высокие концентрации газообразного аммиака из-за отсутствия турбулентности и улетучивания и большего накопления метаболических отходов и продуктов разложения, включая аммиак (ВОЗ 1986).
- Высокая плотность рыбы : Уменьшение течения реки может привести к концентрации рыбы в прудах или других убежищах, концентрированию экскрементов и повышению концентрации аммиака.
- Присутствие в органических отходах : Органические отходы – это остатки любого когда-то живого организма или их экскременты.
 Выведение аммиака из организма также происходит с мочой, поэтому его средняя концентрация в хозяйственно-бытовых стоках составляет 40 мг/л. Идентификация органического вещества в водоемах или водных растворах помогает определить источник.
Выведение аммиака из организма также происходит с мочой, поэтому его средняя концентрация в хозяйственно-бытовых стоках составляет 40 мг/л. Идентификация органического вещества в водоемах или водных растворах помогает определить источник.
– Уровень аммиака в воде <1 мг/л может быть опасен. - Растительный материал обычно имеет низкое содержание азота, а связанные разлагатели могут поглощать аммиак и снижать его водную концентрацию. Определение типа органических отходов, присутствующих в водоеме, поможет выявить возможные причины. Чрезмерное количество органических отходов в воде может привести к образованию сероватого оттенка с видимыми отложениями ила в зонах отложений.
- Зловонный запах : Газообразный аммиак имеет характерный резкий запах (подумайте о средствах для мытья окон и полов). Концентрации аммиака в ручьях редко бывают достаточно высокими, чтобы иметь этот запах, но вода с неприятным, септическим запахом или запахом органических отходов может иметь относительно высокие концентрации аммиака.

- Взвешенные вещества : Взвешенные вещества из сточных вод или стоков могут содержать большое количество аммиака или действовать как катализаторы роста бактерий, способствуя накоплению аммиака. Определение типа присутствующего взвешенного материала важно для выявления возможных причин.
- Щелочная, бескислородная или теплая вода : Характеристики воды, которые способствуют образованию аммиака (например, аноксия) или повышают токсичность (например, высокий уровень pH и температура), являются признаками того, что причиной может быть аммиак.
- Раствор аммиака , также известный как водный раствор аммиака представляет собой раствор аммиака в воде. Он служит различным целям: он входит в состав бытовых чистящих средств, дезинфицирующих средств для очистки воды, производства продуктов питания для снижения кислотности пищи и даже затемнения мебели.
- Медицинское использование проходит испытания, например, газообразный аммиак используется в качестве стимулятора дыхания для предотвращения обморока.

Риски для здоровья и обращение с Nh4
0 — 0,5 ppm
Типичные фоновые уровни низких концентраций.
0,6–23 ppm
Все еще считается низкой концентрацией, но обычно ее можно определить по запаху.
24 — 29 частей на миллион
Иногда может быть обнаружено раздражение носа и горла (2-6 часов воздействия)
30 — 49 частей на миллион
Слегка раздражает некоторых людей через 10 минут воздействия
50 — 71 частей на миллион
5 Умеренно раздражает большинство людей после 10 минут воздействия
72 — 139 ppm
Непрерывное воздействие Nh4 может вызвать раздражение носа и горла уже через 5 минут.
140 — 499 частей на миллион
Вызывает невыносимое раздражение у большинства людей через 30 минут
500 — 1499 частей на миллион
Немедленно возникает сильное раздражение носа и горла, возникает слезотечение (плач)
частей на миллион
2500 — 4 4
1500 — 4 может привести к отеку легких (накопление жидкости в легких, потенциально смертельное)
2500 — 4500 частей на миллион
Смерть вероятна через 30+ минут воздействия
5000 частей на миллион +
Часто вызывает быструю остановку дыхания, с большой вероятностью смерть
ПЕРВАЯ ПОМОЩЬ спасения (например, носить соответствующее защитное снаряжение). Вынести пострадавшего на свежий воздух. Если дыхание затруднено, обученный персонал должен дать экстренную подачу кислорода. НЕ позволяйте пострадавшему двигаться без необходимости. Симптомы отека легких могут проявляться с задержкой. Немедленно позвоните в токсикологический центр или к врачу. Лечение требуется срочно. Транспортировка в больницу.
Вынести пострадавшего на свежий воздух. Если дыхание затруднено, обученный персонал должен дать экстренную подачу кислорода. НЕ позволяйте пострадавшему двигаться без необходимости. Симптомы отека легких могут проявляться с задержкой. Немедленно позвоните в токсикологический центр или к врачу. Лечение требуется срочно. Транспортировка в больницу.
ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
- Обращение: Немедленно сообщайте об утечках, разливах или отказах предохранительного оборудования (например, системы вентиляции). В случае разлива или утечки немедленно наденьте аварийный респиратор и покиньте помещение.
 НЕ работайте с этим продуктом в одиночку. Получите медицинскую помощь при всех воздействиях. Симптомы могут быть отсрочены. Предотвращайте случайный контакт с несовместимыми химическими веществами.
НЕ работайте с этим продуктом в одиночку. Получите медицинскую помощь при всех воздействиях. Симптомы могут быть отсрочены. Предотвращайте случайный контакт с несовместимыми химическими веществами.
ОСОБЫЕ РЕСУРСЫ
Откройте для себя самую передовую и точную технологию обнаружения горючих газов
Посмотреть веб-семинар
Газы летучих органических соединений — защитить работников от скрытых опасностей
ПОСМОТРЕТЬ ВЕБИНАР
Газ h3S — что нужно знать о сероводороде
Прочтите статью
Воздействие сероводорода (h3S) в нефтегазовой промышленности: риски и предотвращение
Прочтите статью
Выбор подходящего детектора горючих газов для вашей рабочей площадки
Читать статью
Каталожные номера
https://www.ccohs.ca/oshanswers/chemicals/chem_profiles/ammonia.html
https://www.
 cdc.gov/niosh/topics/ammonia/default.html
cdc.gov/niosh/topics/ammonia/default.htmlhttps://www.health.ny.gov/environmental/emergency/chemical_terrorism/ammonia_tech.htm
https://www.worksafebc.com/en/health-safety/hazards-exposures/аммиак
https://www.atsdr.cdc.gov/toxprofiles/tp126-c1-b.pdf
https://enviromed.ca/index.php?id_cms=28&controller=cms
https://www.foodmanufacturing.com/facility/article/21103964/ammonia-and-the-associated-risks-of-confined-space-entry-incidents-for-food-refrigeration
https://lpelc.org/wp-content/uploads/2019/03/Section-5-Fact-Sheet-Manure-Gases.pdf
https://www.chemicalbook.com/ProductChemicalPropertiesCB9854275_EN.htm
- https://www.mydigitalpublication.com/publication/frame.php?i=683123&p=&pn=&ver=html5&view=articleBrowser&article_id=3814002
Факты об аммиаке
Техническая информация
Копия документа Факты об аммиаке (техническая информация) доступна в формате Adobe Portable Document Format (PDF, 63 КБ, 3 стр. )
)
Примечание для читателя: Этот информационный бюллетень предназначен для предоставления общей информации и информации о конкретном химическом агенте. Для получения информации о готовности и реагировании (например, для сотрудников службы экстренного реагирования и скорой медицинской помощи) обратитесь к следующим ресурсам Департамента:
- Карточка готовности и реагирования на химический терроризм (PDF, 45 КБ, 7 стр.)
- Настенная диаграмма «Химический терроризм» (PDF, 97 КБ, 1 стр.)
Что такое аммиак?
Аммиак (NH 3 ) является одним из наиболее часто производимых промышленных химикатов в Соединенных Штатах. Он используется в промышленности и торговле, а также естественным образом присутствует в организме человека и в окружающей среде. Аммиак необходим для многих биологических процессов и служит предшественником для синтеза аминокислот и нуклеотидов. В окружающей среде аммиак является частью азотного цикла и образуется в почве в результате бактериальных процессов. Аммиак также образуется в результате разложения органических веществ, включая растения, животных и отходы животноводства.
Аммиак также образуется в результате разложения органических веществ, включая растения, животных и отходы животноводства.
Некоторые химические/физические свойства аммиака:
- При комнатной температуре аммиак представляет собой бесцветный сильно раздражающий газ с резким удушливым запахом.
- В чистом виде известен как безводный аммиак и гигроскопичен (легко впитывает влагу).
- Аммиак обладает щелочными свойствами и вызывает коррозию.
- Газообразный аммиак легко растворяется в воде с образованием гидроксида аммония, щелочного раствора и слабого основания.
- Газообразный аммиак легко сжимается и под давлением образует прозрачную жидкость.
- Аммиак обычно транспортируют в виде сжатой жидкости в стальных контейнерах.
- Аммиак не легко воспламеняется, но контейнеры с аммиаком могут взорваться при воздействии высокой температуры.
Как используется аммиак?
Около 80% аммиака, производимого промышленностью, используется в сельском хозяйстве в качестве удобрения. Аммиак также используется в качестве газообразного хладагента для очистки воды и в производстве пластмасс, взрывчатых веществ, текстиля, пестицидов, красителей и других химических веществ. Он содержится во многих бытовых и промышленных чистящих средствах. Бытовые чистящие растворы аммиака производятся путем добавления газообразного аммиака в воду и могут содержать от 5 до 10% аммиака. Растворы аммиака для промышленного использования могут иметь концентрацию 25% или выше и вызывать коррозию.
Аммиак также используется в качестве газообразного хладагента для очистки воды и в производстве пластмасс, взрывчатых веществ, текстиля, пестицидов, красителей и других химических веществ. Он содержится во многих бытовых и промышленных чистящих средствах. Бытовые чистящие растворы аммиака производятся путем добавления газообразного аммиака в воду и могут содержать от 5 до 10% аммиака. Растворы аммиака для промышленного использования могут иметь концентрацию 25% или выше и вызывать коррозию.
Как люди могут подвергаться воздействию аммиака?
Большинство людей подвергаются воздействию аммиака при вдыхании газа или паров. Поскольку аммиак существует в природе, а также присутствует в чистящих средствах, воздействие может происходить из этих источников. Широкое использование аммиака на фермах, в промышленных и коммерческих помещениях также означает, что воздействие может произойти в результате случайного выброса или преднамеренного террористического нападения.
Безводный газообразный аммиак легче воздуха и будет подниматься вверх, так что обычно он рассеивается и не оседает в низинах. Однако в присутствии влаги (например, при высокой относительной влажности) сжиженный безводный газообразный аммиак образует пары, которые тяжелее воздуха. Эти пары могут распространяться по земле или в низинах с плохим воздушным потоком, где люди могут подвергнуться воздействию.
Однако в присутствии влаги (например, при высокой относительной влажности) сжиженный безводный газообразный аммиак образует пары, которые тяжелее воздуха. Эти пары могут распространяться по земле или в низинах с плохим воздушным потоком, где люди могут подвергнуться воздействию.
Каков механизм действия аммиака?
Аммиак сразу же при контакте с имеющейся влагой кожи, глаз, полости рта, дыхательных путей и особенно слизистых поверхностей взаимодействует с образованием очень едкого гидроксида аммония. Гидроксид аммония вызывает некроз тканей за счет разрушения липидов клеточных мембран (омыление), что приводит к разрушению клеток. Когда клеточные белки разрушаются, вода извлекается, что приводит к воспалительной реакции, вызывающей дальнейшее повреждение.
Каковы непосредственные последствия воздействия аммиака на здоровье?
Вдыхание: Аммиак вызывает раздражение и коррозию. Воздействие высоких концентраций аммиака в воздухе вызывает немедленное жжение в носу, горле и дыхательных путях. Это может вызвать бронхиолярный и альвеолярный отек и разрушение дыхательных путей, приводящее к дыхательной недостаточности или недостаточности. Вдыхание более низких концентраций может вызвать кашель и раздражение носа и горла. Запах аммиака обеспечивает адекватное раннее предупреждение о его присутствии, но аммиак также вызывает обонятельную усталость или адаптацию, снижая осознание длительного воздействия низких концентраций.
Это может вызвать бронхиолярный и альвеолярный отек и разрушение дыхательных путей, приводящее к дыхательной недостаточности или недостаточности. Вдыхание более низких концентраций может вызвать кашель и раздражение носа и горла. Запах аммиака обеспечивает адекватное раннее предупреждение о его присутствии, но аммиак также вызывает обонятельную усталость или адаптацию, снижая осознание длительного воздействия низких концентраций.
Дети, подвергшиеся воздействию тех же концентраций паров аммиака, что и взрослые, могут получить большую дозу, поскольку у них больше отношение площади поверхности легких к массе тела и повышенное отношение минутного объема к массе. Кроме того, они могут подвергаться воздействию более высоких концентраций, чем взрослые в том же месте, из-за их меньшего роста и более высоких концентраций паров аммиака, изначально обнаруженных у земли.
Контакт с кожей или глазами: Воздействие низких концентраций аммиака в воздухе или растворе может вызвать быстрое раздражение кожи или глаз. Более высокие концентрации аммиака могут вызвать серьезные травмы и ожоги. Контакт с концентрированными растворами аммиака, такими как промышленные чистящие средства, может привести к коррозионным повреждениям, включая ожоги кожи, необратимое повреждение глаз или слепоту. Полная степень повреждения глаз может не проявляться в течение недели после воздействия. Контакт со сжиженным аммиаком также может вызвать обморожение.
Более высокие концентрации аммиака могут вызвать серьезные травмы и ожоги. Контакт с концентрированными растворами аммиака, такими как промышленные чистящие средства, может привести к коррозионным повреждениям, включая ожоги кожи, необратимое повреждение глаз или слепоту. Полная степень повреждения глаз может не проявляться в течение недели после воздействия. Контакт со сжиженным аммиаком также может вызвать обморожение.
Проглатывание: Воздействие высоких концентраций аммиака при проглатывании раствора аммиака приводит к коррозионному поражению полости рта, горла и желудка. Проглатывание аммиака обычно не приводит к системному отравлению.
Как лечить воздействие аммиака?
Противоядия от отравления аммиаком не существует, но последствия аммиака можно лечить, и большинство людей выздоравливают. Немедленное обеззараживание кожи и глаз большим количеством воды очень важно. Лечение состоит из поддерживающих мер и может включать введение увлажненного кислорода, бронходилататоров и обеспечение проходимости дыхательных путей. Попавший внутрь нашатырный спирт разбавляют молоком или водой.
Попавший внутрь нашатырный спирт разбавляют молоком или водой.
Помогут ли лабораторные тесты принять решение о лечении, если кто-то подвергся воздействию аммиака?
Лабораторные анализы на воздействие аммиака бесполезны при принятии решений о неотложной помощи. Доступны медицинские тесты, которые могут обнаружить аммиак в крови или моче. Однако, поскольку аммиак обычно присутствует в организме, результаты этих анализов не могут служить биомаркерами воздействия. После воздействия низких уровней аммиак либо быстро выводится из организма, либо метаболизируется до соединений, обнаруживаемых эндогенно в заметных количествах. Клинические показатели уровня аммиака или азота в организме после воздействия экзогенного аммиака не изменились или изменились минимально по сравнению с предыдущими уровнями. Воздействие высоких концентраций оказывает немедленное и явное токсическое действие, что обычно обеспечивает достаточную основу для диагностики.
Как я могу получить дополнительную информацию об аммиаке?
Позвоните по следующим номерам или посетите веб-сайты, указанные в разделе «Источники».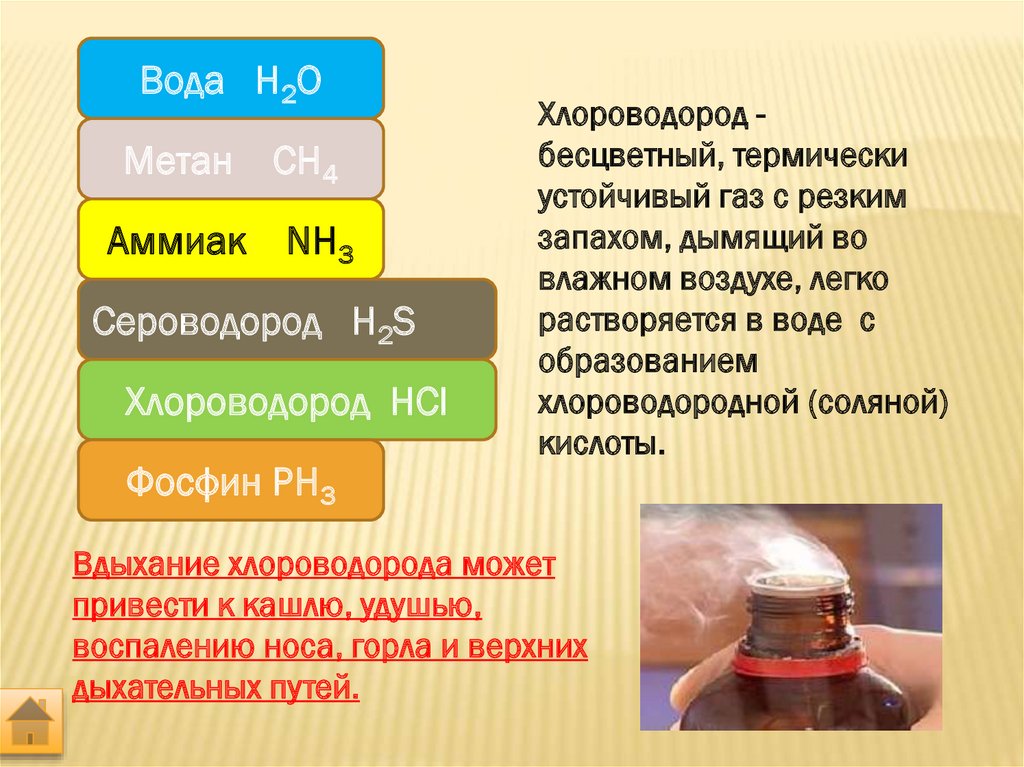
- Горячая линия Центров по контролю и профилактике заболеваний (1-888-246-2675)
- Агентство регистрации токсичных веществ и заболеваний (1-888-422-8737)
- Региональный токсикологический центр (1-800-222-1222)
Источники:
Агентство регистрации токсичных веществ и заболеваний. 2004. ToxFAQ для аммиака. Отдел токсикологии Министерства здравоохранения и социальных служб США. Служба общественного здравоохранения: Атланта, Джорджия. По состоянию на 6 мая 2004 г. http://www.atsdr.cdc.gov/tfacts126.html
Агентство регистрации токсичных веществ и заболеваний. 2004. Руководство по медицинскому контролю (MMG) аммиака. Отдел токсикологии Министерства здравоохранения и социальных служб США. Служба общественного здравоохранения: Атланта, Джорджия. По состоянию на 6 мая 2004 г. http://www.atsdr.cdc.gov/MHMI/mmg126.html
Центры по контролю и профилактике заболеваний. 2003. Бюллетени готовности и реагирования на чрезвычайные ситуации в области общественного здравоохранения.




 Выведение аммиака из организма также происходит с мочой, поэтому его средняя концентрация в хозяйственно-бытовых стоках составляет 40 мг/л. Идентификация органического вещества в водоемах или водных растворах помогает определить источник.
Выведение аммиака из организма также происходит с мочой, поэтому его средняя концентрация в хозяйственно-бытовых стоках составляет 40 мг/л. Идентификация органического вещества в водоемах или водных растворах помогает определить источник. 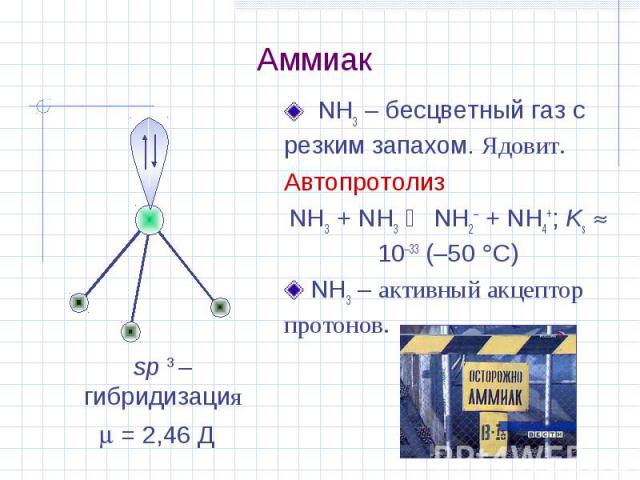

 НЕ работайте с этим продуктом в одиночку. Получите медицинскую помощь при всех воздействиях. Симптомы могут быть отсрочены. Предотвращайте случайный контакт с несовместимыми химическими веществами.
НЕ работайте с этим продуктом в одиночку. Получите медицинскую помощь при всех воздействиях. Симптомы могут быть отсрочены. Предотвращайте случайный контакт с несовместимыми химическими веществами. cdc.gov/niosh/topics/ammonia/default.html
cdc.gov/niosh/topics/ammonia/default.html